고등학생을 위한 적외선 분광법 : (1) 기초
"분자의 진동 운동과 적외선 분광법"
0. 들어가기
어쩌다 보니, 지역 심화과학반 프로그램에서 ‘적외선 분광기를 이용한 물질 분석’ 수업을 하게 되었다. 개인적으로 진행하고 있는 교수학습자료개발 활동과 맞물려 현장에 적용할 수 있는 흔치 않은 기회였다. 적외선 분광기는 자외선-가시광선 분광기에 비해 워낙 고가인데다, 중고등학교 수준에서 활용 범위가 넓지 않은 편이서 일반 학교가 보유하는 경우는 드물다. 이번 프로그램 역시 학교가 아닌, 지역 수리과학정보체험센터 심화실험실에서 진행했다. 분광학 관련 내용을 진지하게 다루기에는 터무니없이 부족한 시간이었기에 블로그에 보충하여 내용을 정리해두고자 한다.

적외선 분광기도 기본적인 분석 원리는 이전에 포스팅했던 자외선-가시광선 분광법과 크게 다르지 않다. 다만, 사용하는 빛의 파장이 적외선 영역이라는 점이 다르다. 적외선은 가시광선이나 자외선보다 파장은 길고 에너지가 작은 빛이다. 물론, 눈에는 보이지 않는다.
[참고] 고등학생을 위한 분광광도법 (1) : https://stachemi.tistory.com/129
자외선-가시광선 분광법은 색을 갖는 주변 물질들과 연관 지어 설명할 수 있기 때문에, 고등학교 수준에서도 관심만 가지면, 관련 내용을 쉽게 받아들이고 이해할 수 있다. 하지만 적외선 분광법은 스펙트럼의 모양도 복잡하고, 분자 운동에 대한 설명 과정이 필요하여 아무래도 조금 어렵다고 느끼기 쉽다. 제목은 호기롭게 "고등학생들을 위한 적외선 분광법"이라고 붙였지만, 사실, "대학생들에게 더 적절할 것 같은데..." 하는 생각을 몰래하고 있다. (정작 본인은 대학생 시절 수강했던 분광학 수업 대부분을 이해하지 못한 채 졸업했다...)
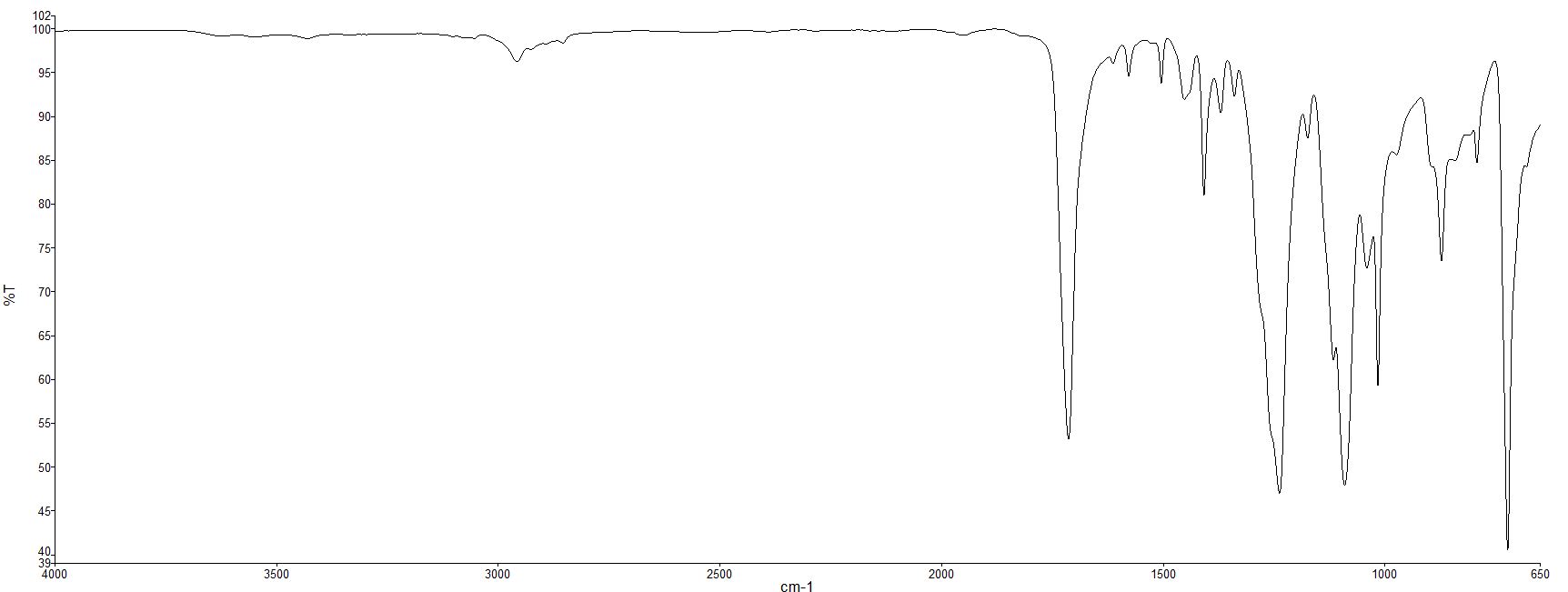
1. 분자의 진동 운동
모든 물질은 원자(atom)로 만들어진다. 원자들은 모여 분자(molecule)를 이룬다. 분자는 '물질의 성질을 나타내는 최소 단위의 입자'다. 대부분의 분자들은 원자들의 화학 결합을 통해 만들어진다. 세 개의 원자로 이루어진 물(H2O) 분자도, 무수히 많은 원자들이 모여 만들어진 고분자 플라스틱도 화학 결합을 통해 만들어진다.

원자들이 결합한다는 것은 각각의 원자들이 일정 거리만큼 떨어져 균형을 이루고 있다는 뜻이다. 서로 적당한 거리를 유지하며, 에너지적으로 안정한 상태를 갖는 것이 분자다.
[참고] 화학 결합과 거리에 따른 에너지 https://stachemi.tistory.com/153

가장 간단한 분자인 수소 기체(H2)는 두 수소 원자가 74 pm 정도 떨어져 있으며, 물(H2O) 분자는 하나의 산소를 가운데에 두고, 두 수소가 104.5 ˚의 각도와 95.84 pm 만큼 떨어져 있다.
분자를 이루는 원자들이 서로가 서로에게 묶여 있는 상태이며, 마치 두 사람이 손을 잡고 있는 것과 같다. 손을 맞잡은 두 사람의 움직임은 홀로 존재할 때에 비해 제한적이다. 두 사람이 완벽하게 자유로워지려면 결합을 끊어내야 한다.
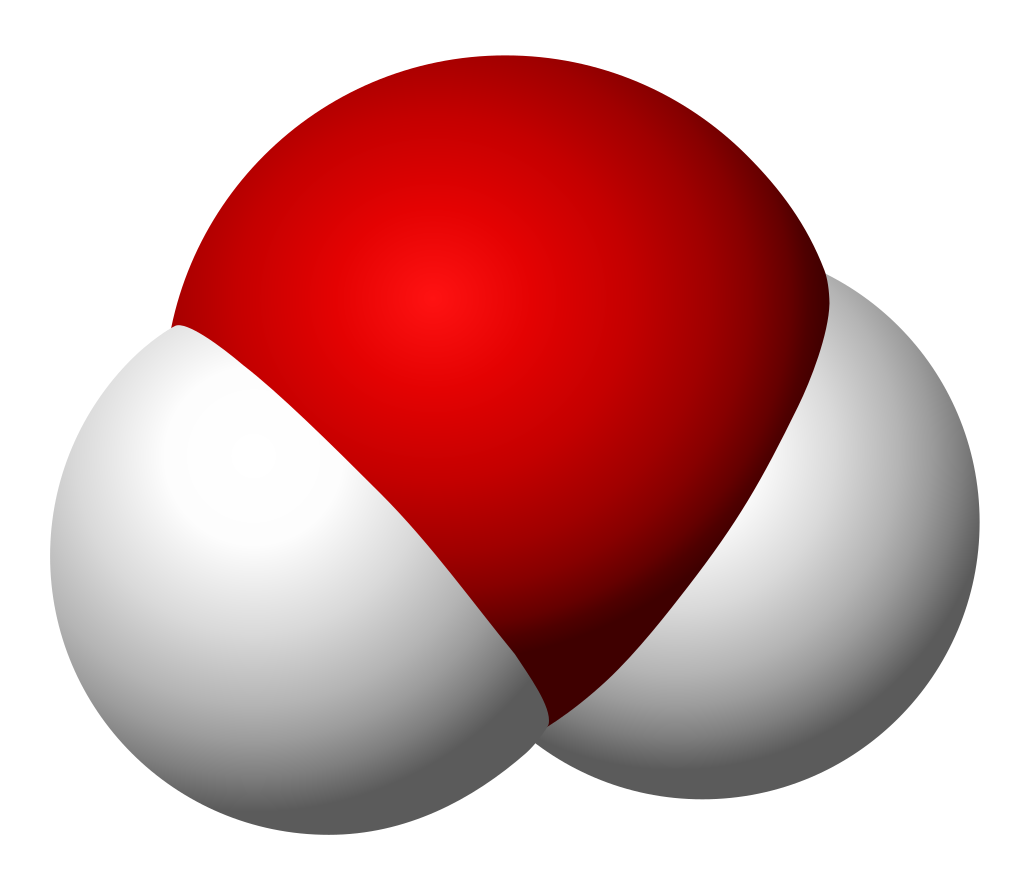


위 그림은 물의 분자 모형이다. 특히, 가운데 모형은 원자 알맹이를 공(ball), 결합을 막대기(stick)로 나타내었다해서 '공-막대기 모형(Ball & Stick Model)'이라 부른다.
일반적으로 분자 내 결합을 기다란 막대기로 표현하는 경우가 많아, 결합 길이가 고정된 경직된 구조로 여기기 쉽지만, 결합을 스프링이나 고무줄처럼 생각하는 것이 좋다. 결합 길이는 늘어나거나 줄어들 수도 있고, 각도도 조금씩 달라질 수 있다. 분자를 이루는 원자들의 움직임에 따라 결합 길이, 각도가 변할 수 있다.
물 분자 가운데 위치한 산소 원자만 좌우로 까딱까딱 움직인다고 생각해보자. 산소 움직임에 따라 왼쪽 수소와 오른쪽 수소까지의 거리가 멀어지거나 가까워진다. 물론, 고무줄을 한없이 늘이거나 한없이 압축시킬 수 없듯, 결합 길이와 각도의 변화도 제한적인 범위에서만 가능하다.
분자 내 원자는 서로 묶여있지만, 끊임없이 움직이며, 손을 꼭 잡은 채 꼼지락대는 어린 아이들과 같다. 이러한 움직임을 분자의 진동 운동(vibratory motion)이라 한다. 아래 그림은 물 분자의 진동 운동을 나타낸 것이다. 결합 길이가 늘어나고, 줄어드는 '신축(stretch) 운동'과 결합 각도 변화를 갖는 '굽힘(bend) 운동'을 확인할 수 있다.

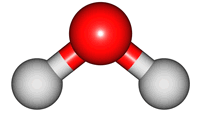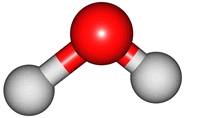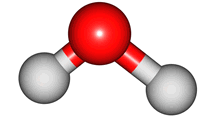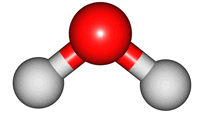
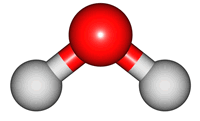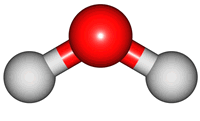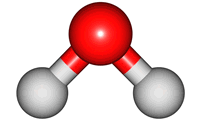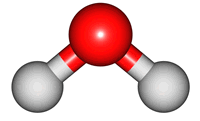
2. 진동 운동과 빛의 파장
고무줄이나 스프링의 길이를 늘이기 위해서는 어떻게 해야 할까? 너무 당연하게 들리겠지만, 고무줄이나 스프링의 양쪽 끝을 붙잡고, 힘을 주어 잡아당겨야 한다. 달리 표현하면 우리가 고무줄이나 스프링에 일을 해주어야 한다. 굵기가 굵고, 땡땡할수록 같은 길이를 늘이는데 필요한 힘이 커진다.

이를 분자에 적용해본다면, 분자를 진동시키기 위해서는 에너지가 필요하다. 분자를 진동시키기에 적절한 에너지의 빛은 적외선 영역의 빛이다. 적외선 영역은 가시광선이나 자외선에 비해 파장이 길다.
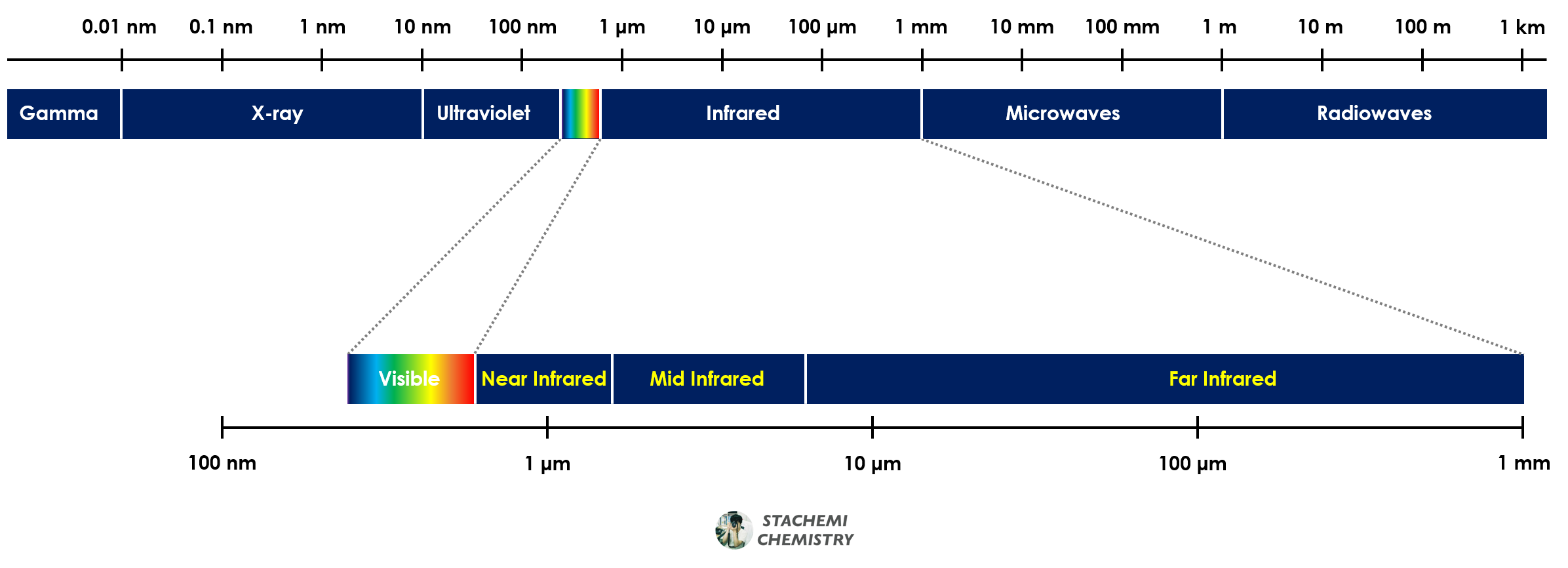
결합의 종류에 따라 진동시키기 위한 적외선 파장(에너지)에도 차이가 있다. 강한 결합을 진동시키는 것이 약한 결합을 진동시키는 것보다 더 어렵다. 마치 굵은 스프링을 진동시키기 위해 필요한 에너지가 더 큰 것과 비슷하다. 탄소-탄소 삼중 결합(C≡C)을 진동시키기 위해서는 단일 결합(CㅡC)을 진동시킬 때보다 많은 에너지가 필요하다. 달리 말하면, 삼중 결합의 진동 운동을 위해 더 짧은 파장의 적외선을 흡수해야 한다는 뜻이다.
C≡C 신축 진동 : 2150 cm-1
C=C 신축 진동 : 1650 cm-1
C―C 신축 진동 : 1200 cm-1
결합 종류와 세기에 따라 흡수하는 적외선 파장 영역대가 다르다는 것은, 물질들이 갖는 독특한 구조와 결합의 특징이 적외선 스펙트럼으로 나타난다는 것을 의미한다. 우리가 분석하고자 하는 시료의 구조적 특징을 기억해둔 뒤, 그 특징이 적외선 스펙트럼에 나타나는지 확인함으로써 시료의 정체에 가까워질 수 있다.
3. 적외선 분광법으로 물질 확인하기
살리실산(salicylic acid)과 아세트산 무수물(acetic acid anhydride)을 약간의 산 촉매와 함께 반응시키면, 아스피린(aspirin, 아세틸 살리실산)을 합성할 수 있다. 반응물인 살리실산(SA)과 생성물인 아스피린(ASA)은 겉보기에 모두 흰색 가루로, 큰 차이를 느끼지 못하지만, 분명 다른 구조의 물질이다. 우리는 합성이 성공적으로 이루어졌음을 어떻게 확인할 수 있을까?

아스피린의 합성 유무를 확인할 수 있는 방법은 다양하다. 반응물인 살리실산(SA)과 아스피린(ASA)으로 추정되는 물질의 녹는점을 측정하여 확인할 수 있으며, 자외선-가시광선 흡수 스펙트럼의 변화를 통해서도 구분할 수 있다. 연구실 환경이라면 NMR 스펙트럼으로 합성물의 구조를 확인하는 것이 가장 보편적이다.
- 살리실산의 녹는점 : 158.6 ℃
- 아스피린의 녹는점 : 135.0 ℃
물론, 이번 글의 주제인 적외선 분광법을 통해서도 아스피린 합성 여부를 확인할 수 있다. 반응물인 살리실산과 생성물인 아스피린의 구조적 차이에 주목하자.
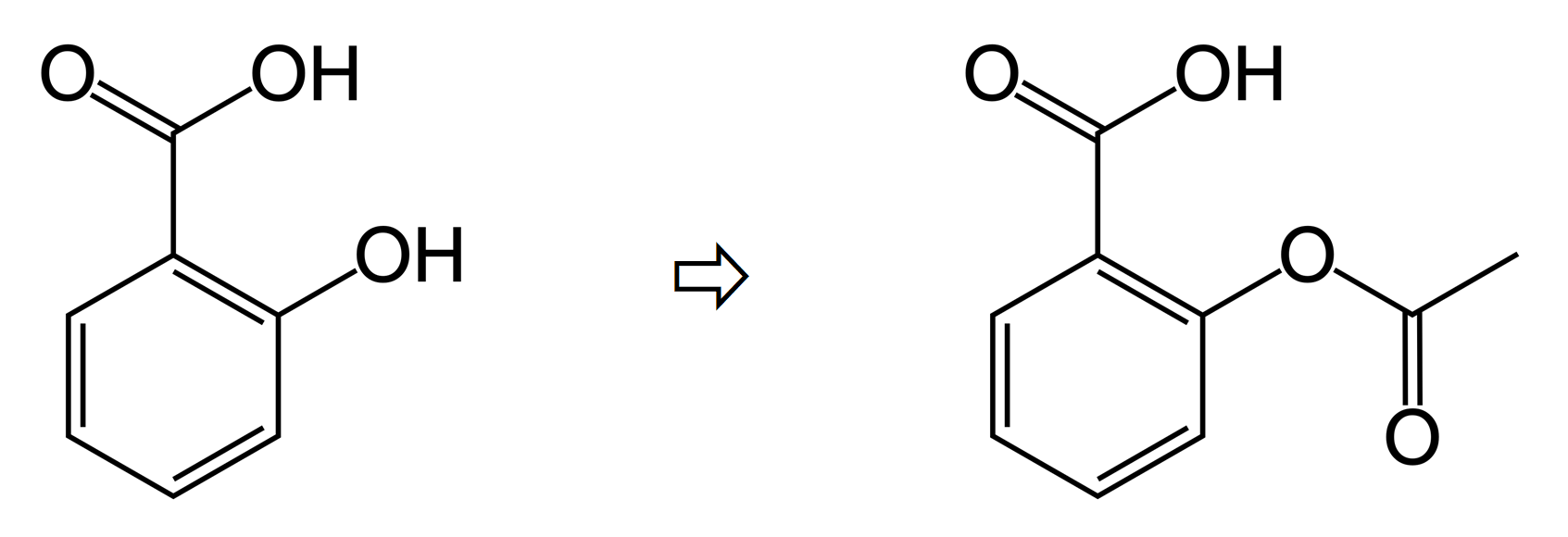
만약, 성공적으로 아스피린이 합성되었다면, 살리실산의 하이드록시 그룹(-OH) 없어지고, 그 자리에 에스터 그룹(-OCOCH3)이 자리할 것이다. 생성물의 적외선 스펙트럼에서 살리실산의 -OH 결합에 의한 흡수띠가 사라졌는지 확인하고, 에스터 그룹의 C=O 흡수띠가 새롭게 나타났는지를 확인하면 된다.
* 물론, 그밖의 변화를 통해서도 확인가능하겠지만, 보통 산소가 관여한 결합의 흡수띠를 통해 찾는 것이 편하다. 흡수띠에 따른 구체적인 분석 방법은 별도 글을 통해 알아보도록 하자.

따라서 적외선 분광법을 이용하여 물질을 분석하기 위해서는 분자 내 결합들의 흡수 파장 영역을 기억해두는 것이 도움이 된다. 결합 종류에 따른 흡수띠의 위치, 모양 등을 모두 기억할 수는 없겠지만, 특징적인 몇가지 흡수띠를 알고 있다면, 간단한 유기 분자들의 스펙트럼을 분석하는데는 충분히 활용 가능할 것이다.
고등학생을 위한 적외선 분광법 (1) 기초
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
[다음 글] 고등학생을 위한 적외선 분광법 (2) 작용기와 스펙트럼 기초 :
https://stachemi.tistory.com/285
고등학생을 위한 적외선 분광법 : (2) 작용기와 스펙트럼 기초
* 본문의 내용은 고등학생을 위한 적외선 분광법 : (1) 기초편과 연결됩니다. https://stachemi.tistory.com/269 고등학생을 위한 적외선 분광법 : (1) 기초 고등학생을 위한 적외선 분광법 : (1) 기초 "분자의
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| 전자기파 (electromagnetic wave) (0) | 2022.08.01 |
|---|---|
| 전자의 스핀 (feat. 슈테른-게를라흐 실험) (0) | 2022.07.25 |
| 오비탈의 침투 효과 (Penetration Effect of Orbitals) (12) | 2022.06.23 |
| 주기율표의 역사 (3) 모즐리가 밝혀낸 원자 구조의 비밀 (0) | 2022.06.17 |
| 18족 원소 이야기 (0) | 2022.05.28 |



