전자기파 | electromagnetic wave
1. 전자기파 (electromagnetic wave)
전자기파는 전기장과 자기장이 수직방향으로 진동하는 파동이다. 진동 간격에 따라 자외선, 가시광선, 적외선 등으로 구분되는데, 사람 눈으로 들어와 시각 신호를 만들어낼 수 있는 약 400 ~ 700 nm 영역의 가시광선을 빛(light)이라 한다. 인간의 눈으로 감지할 수 있는 전자기파의 영역은 매우 제한적인 편이다.
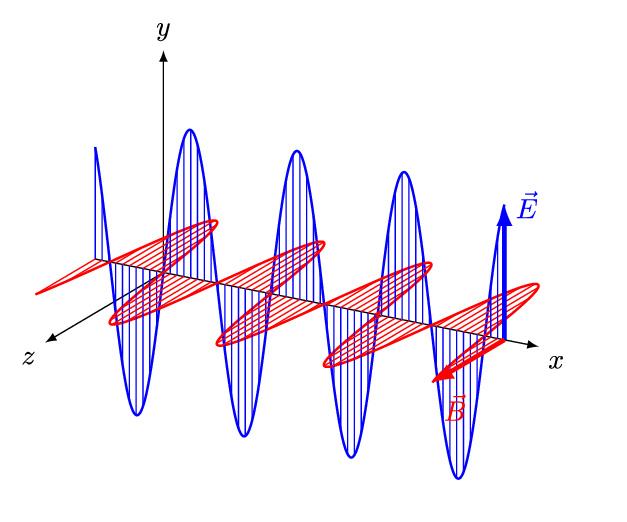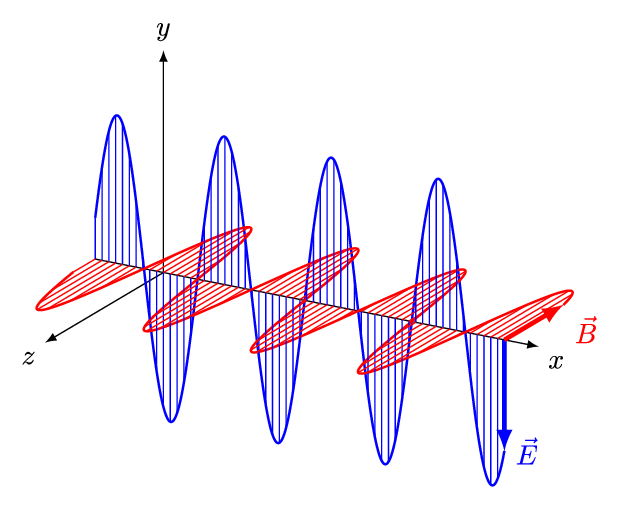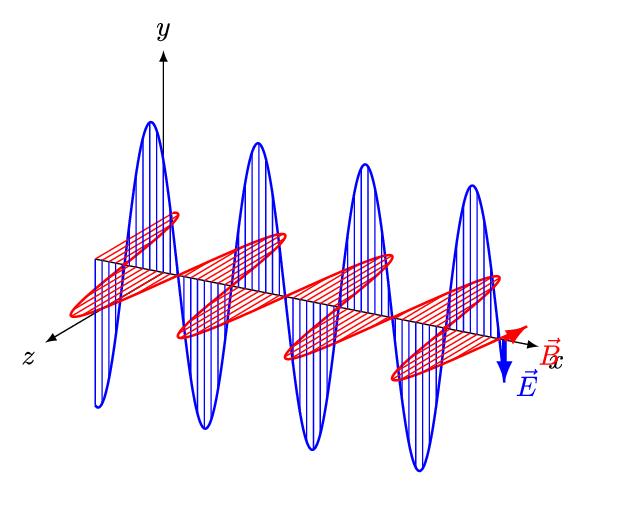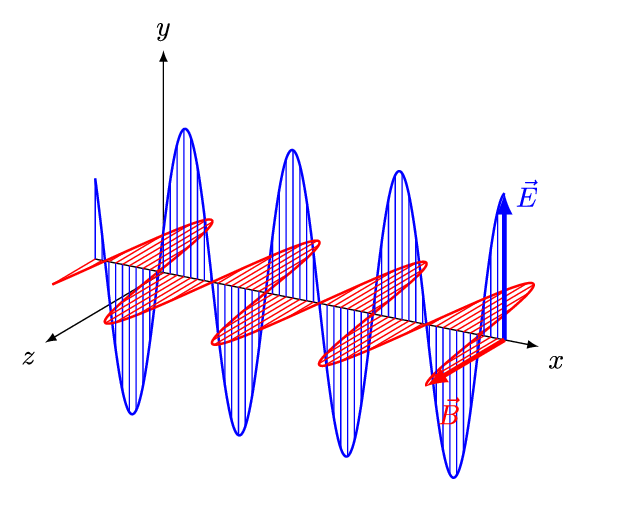
그렇다면, 눈으로 볼 수 없는 전자기파의 존재는 어떻게 알았을까? 가시광선을 제외한 전자기파 복사 현상은 19세기 초에 발견되었다.
적외선(infrared)은 1800년, 런던 왕립 학회 천문학자 윌리엄 허셜(William Herschel, 1738-1822)에 의해 알려졌다. 허셜은 태양 빛을 통과시키는 다양한 필터를 테스트하던 도중, 유리 프리즘을 통해 굴절된 스펙트럼의 붉은색 바깥쪽 영역에서 온도가 상승하는 것을 관찰했다. 이를 통해 붉은색 바깥쪽에 가열 효과를 일으키지만, 눈에 보이지는 않는 광선이 존재한다는 사실을 알아냈다. 이 빛은 처음에 '열 광선(calorific rays)'이라 불렸으나 나중에 적외선(Infrared)으로 명명되었다.

그로부터 1년 뒤, 독일 물리학자 요한 빌헬름 리터(Johann Wilhelm Ritter, 1776-1810)은 허셜과 비슷한 방식의 프리즘 실험으로 자외선을 발견했다. 리터는 삼각형 프리즘에 의해 분산된 태양 스펙트럼을 관찰하던 도중, 보라색 바깥쪽 영역에서 염화은(AgCl) 시료가 더 빠르게 감광된다는 사실을 알아냈다. 리터의 실험은 사진 기술의 초기 모델이 되었는데, 이러한 보라색 바깥쪽 광선이 화학반응을 일으킬 수 있다고 하여 '화학 광선(chemical rays)'이라 불렀다.
2. 진동수와 파장 (frequency & wavelength)
전자기파는 진동하는 파동이다. 이 때, 파장(wavelength, λ)은 파동이 1 회 진동하는 동안 이동한 거리이다. 파장은 미터(m), 센티미터(cm), 마이크로미터(μm), 나노미터(nm) 등의 길이 단위로 나타낼 수 있다. 아래 그림에서 푸른색 파동이, 붉은색 파동에 비해 파장이 짧다.
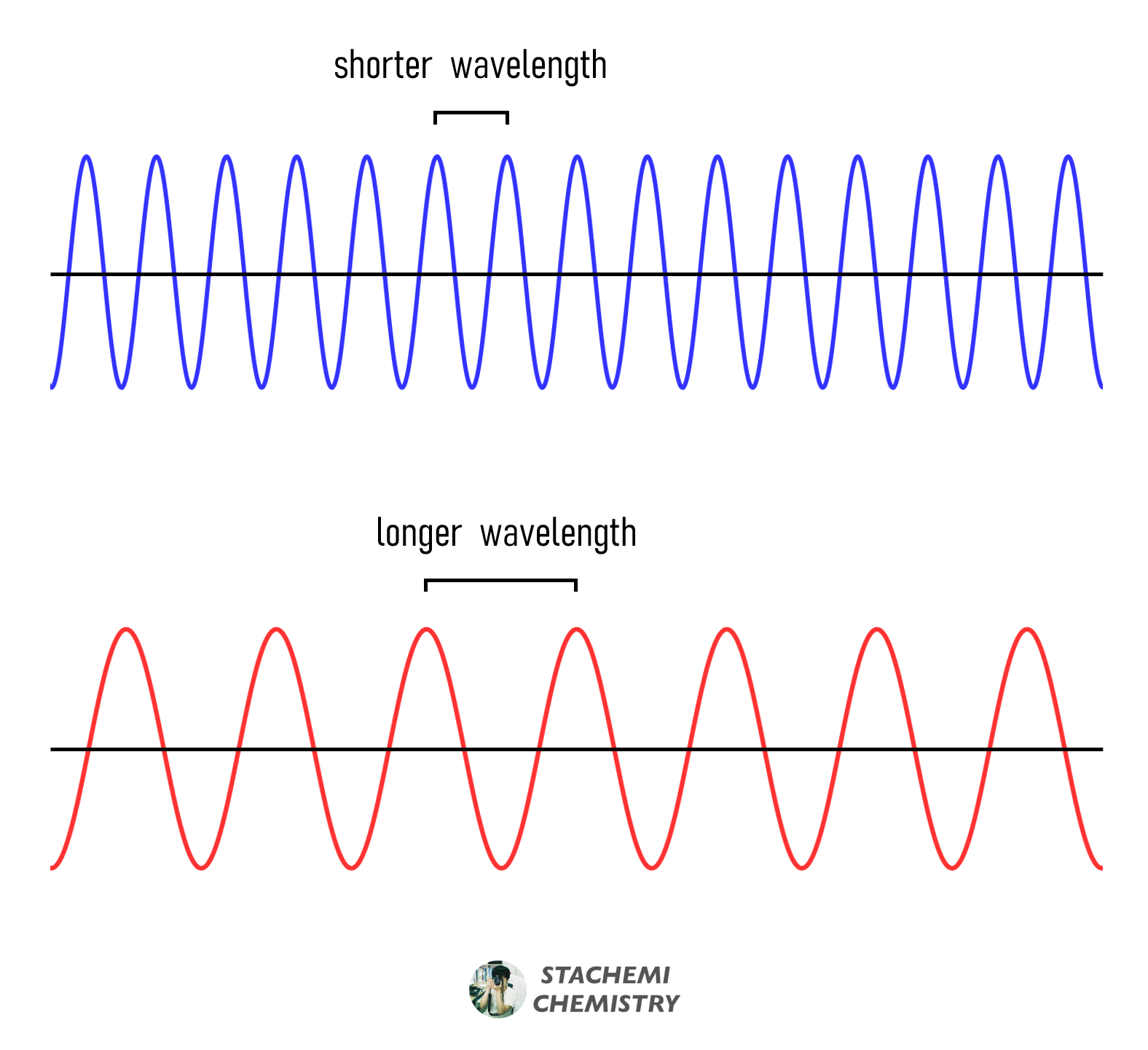
진동수(frequency, υ)는 파동이 1 초 동안 진동한 횟수이다. 진동 횟수를 시간(초)으로 나눈 값이므로 단위는 [1/sec]가 된다. 파장이 짧을수록, 같은 시간 동안에 많이 진동할 수 있다. 따라서 진동수(υ)와 파장(λ)은 반비례한다.
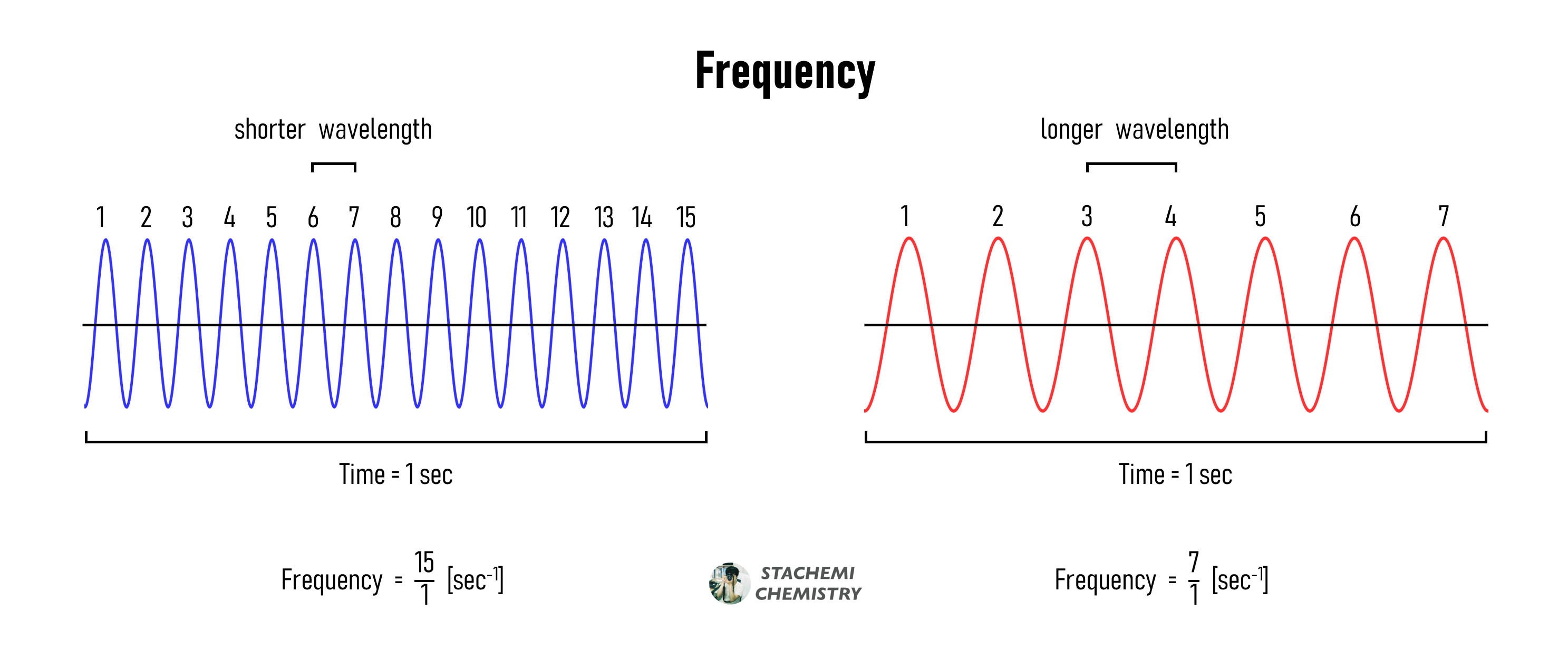
파장은 길이 단위 [m]이고, 진동수는 시간의 역수 단위 [sec-1]를 가지므로, 둘을 곱하면 속도 단위 [m/sec]를 얻을 수 있다. 빛의 속도(c ) = 3 x 108 [m/s] 로 일정하다. ( c = 299,792,458 m/s )

3. 빛 에너지
빛 에너지는 말 그대로 빛이 갖는 에너지를 말한다. 일반적으로 빛이 가시광선 영역(400 ~ 700 nm)에 해당하는 전자기파 의미로 사용되므로 가시광선의 에너지라고 엄밀하게 해석할 수도 있지만, 넓은 의미에서는 모든 전자기파의 복사 에너지로 사용된다. (전자기 복사 에너지)
입자론적 관점에서 빛은 광자(photon)라는 알맹이의 모임으로 구성된다고 여기는데, 광자 하나의 에너지(E )는 플랑크상수(h )와 광자의 진동수(υ ) 곱으로 나타낼 수 있다. ( E = hν )

진동수, 빛의 속도, 파장 사이에 υ = c / λ 관계가 있으므로 광자의 에너지는 다음과 같이 나타낼 수 있다. ( E = hc / λ )

빛 에너지는 파장에 반비례하며, 파장이 짧을수록 큰 에너지를 갖는다.
아래 전자기파 스펙트럼에서 에너지 크기는 파장이 짧은 감마선(γ-ray) > X선(X-ray) > 자외선(UV) > 가시광선(visible) > 적외선(IR) > 마이크로파(microwave) > 라디오파(radio wave) 순이다.
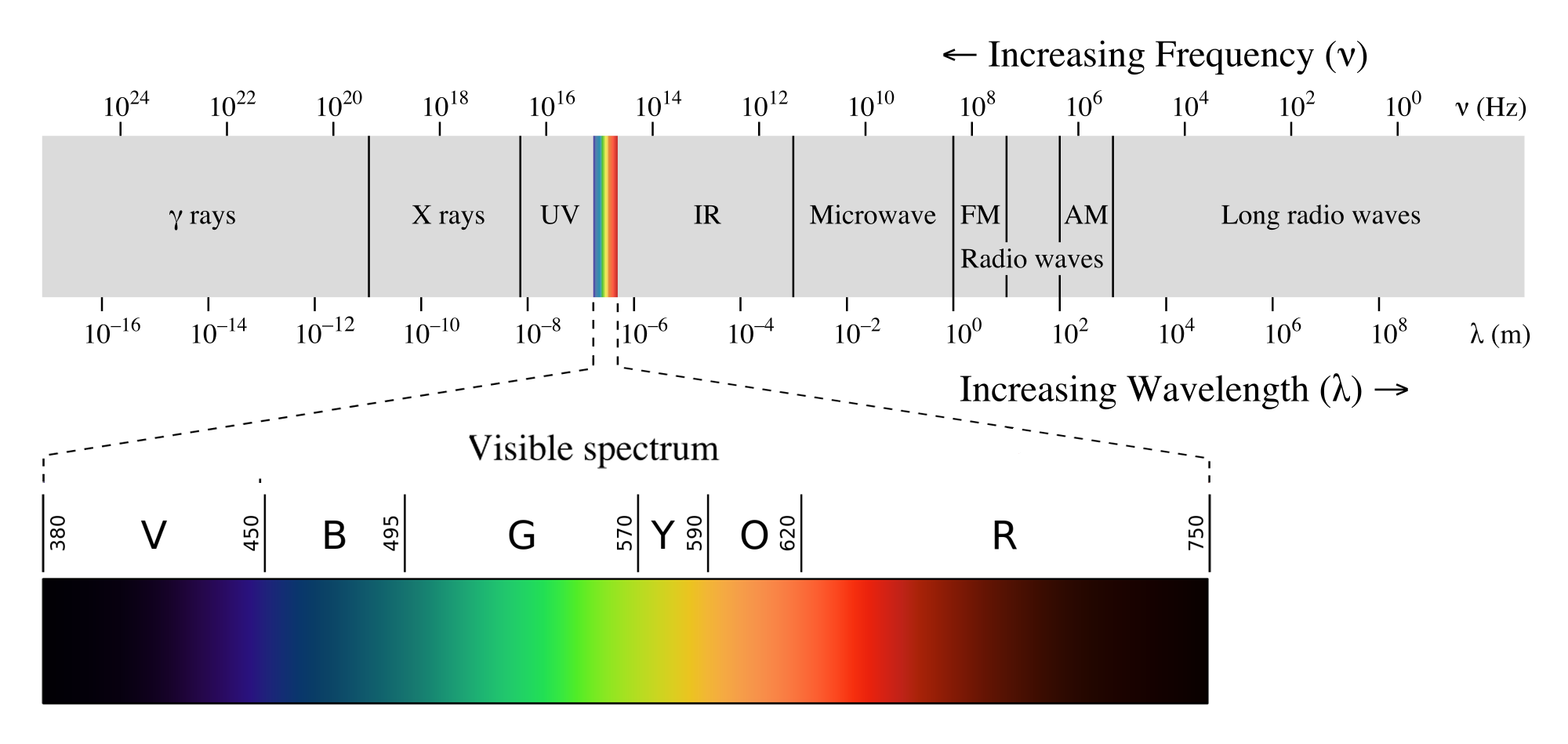
가시광선 영역은 색으로 구분된다. 백색광이 프리즘을 통과하면, 파장에 따라 빨주노초파남보 무지갯빛 연속 스펙트럼을 관찰할 수 있다. 붉은색 빛(Red, 700 nm부근) 보다 보라색 빛(Violet, 400 nm 부근)의 파장이 더 짧고, 에너지는 더 크다.

짧은 파장의 빛이 긴 파장의 빛보다 에너지가 크다는 것을 어떻게 확인할 수 있을까? 수소 기체(H2)와 염소 기체(Cl2)로부터 염화수소(HCl) 기체를 생성하는 반응은 대표적인 광화학 반응인데, 파장에 따른 빛 에너지 차이를 직접 확인할 수 있는 좋은 예시가 된다.
H2 (g) + Cl2 (g) → 2HCl (g)
[참고] 수소와 염소의 광화학 반응 : https://youtu.be/tJhVy1x9X2c?t=176
이 반응을 일으키기 위해서는 약간의 에너지가 필요하다. 처음 개시 단계를 위한 것인데, 1 몰의 기체 Cl2 결합을 끊어 원자화시키기 위한 에너지가 필요하다. 약 243.36 kJ/mol 정도인데, 이를 가해주어야 하는 빛의 파장으로 환산해보면 약 491.5 nm로 가시광선의 푸른색 ~ 보라색 사이에 해당한다.
개시 단계(initiation) : Cl2 (g) → Cl· (g) + ·Cl (g) ΔH = 243.36 kJ
전자기파 (electromagnetic wave)
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 플라스틱 종류별 적외선 스펙트럼 (9) | 2022.09.14 |
|---|---|
| 혼성 오비탈 : 분자의 결합과 구조를 설명하는 효과적인 방법 (0) | 2022.08.11 |
| 전자의 스핀 (feat. 슈테른-게를라흐 실험) (0) | 2022.07.25 |
| 고등학생을 위한 적외선 분광법 : (1) 기초 (2) | 2022.07.20 |
| 오비탈의 침투 효과 (Penetration Effect of Orbitals) (12) | 2022.06.23 |



