* 본문은 고등학교 고급화학 수준에서 작성되었습니다. 원자가 결합 이론(VBT) 관점에서의 파동함수 중첩과 혼성 오비탈 종류에 따른 세부적인 기하 구조 차이에 대한 내용은 담고 있지 않습니다. 사전에 참고하시기 바랍니다.
혼성 오비탈 | hybrid orbital
CH4는 어떻게 동등한 4개의 결합을 가질 수 있을까?
1. 메테인의 결합과 구조
가장 간단한 탄소 화합물, 메테인(CH4)은 정사면체 구조를 갖는다. 탄소 원자를 중심으로 4 개의 수소 원자가 109.5 ˚ 각도를 이루며 존재한다. 탄소와 수소는 전자를 공유하여 총 4 개의 결합을 이루며 이때, 중심 탄소의 원자가(valence)는 4이다.
[참고] 원자가(valence)는 원자의 결합 능력을 나타내기 위한 값이며, 해당 원자가 가질 수 있는 결합 수처럼 생각할 수 있다.
이를 루이스 전자점 식으로 나타내면, 다음과 같다.

루이스 전자점 식은 원자들 사이의 공유 결합과 참여한 전자를 직관적으로 보여줄 수 있어서 꽤나 유용하다. 여기에 현대 원자 모형을 더해보면 어떨까?
현대 원자 모형은 오비탈 모형으로, 원자내 전자의 상태를 전자구름에 빗대어 나타낸다. 원자들 사이의 결합은 오비탈(전자구름) 간의 겹침(overlap)으로 설명가능하며, 이는 각각의 전자구름들이 뭉게뭉게 포개어지는 장면을 떠올리게 한다.
[참고] 현대적 원자 모형 : 오비탈과 양자수 https://stachemi.tistory.com/121

탄소와 수소로부터 메테인이 만들어지는 과정을 살펴보면, 탄소 전자구름이 수소 전자구름 4 개와 겹쳐져 메테인 전자구름을 만든다. 총 네 군데에서 겹침이 발생한다.
설명 과정에서 오비탈(전자구름)이라는 용어가 사용되었지만, 표현된 모형만 봐서는 앞서 살펴본 루이스 전자점 식과 크게 다르지 않아 보인다. 물론, 3차원 공간상의 구조를 고려한다면, 표현된 메테인은 정사면체 구조이겠지만 말이다.

원자의 전자배치 관점에서 조금 더 들여다보자.
결합전, 바닥 상태 탄소 원자는 1s2 2s2 2px1 2py1 의 전자 배치를 갖는다. 탄소의 가장 바깥 껍질(n = 2)에 전자가 4 개 있음을 확인할 수 있다. 그런데 홀전자는 2px1, 2py1, 2 개 뿐이다.
루이스 전자점 식에서는 바깥 껍질 전자 4 개를 모두 똑같은 점으로 나타내었기에 구분되지 않았지만, 오비탈 전자 배치 상으로는 2s 전자 2 개는 이미 짝지은 상태이고, 나머지 2 개는 2px, 2py에 각각 존재함을 알 수 있다. (물론, 여기서 x, y는 임의의 축일 뿐이다.) 이대로라면, 탄소의 원자가를 2 라고 하는 것이 적절하지 않나?
어찌어찌 탄소의 원자가가 4 이고, 4 개의 결합을 가질 수 있다 해도 분명 바깥 껍질에는 두 종류의 오비탈이 존재한다. s 오비탈과 p 오비탈은 모양이 다르고, 다른 분포를 갖는다. 이는 결합에 사용될 탄소의 전자들이 놓인 환경이 같지 않다는 뜻이다.

여기서 생기는 궁금증을 정리하면 다음과 같다.
1. 탄소의 최외각 껍질에 홀전자는 2 개뿐인데, 어떻게 4 개의 결합을 가질 수 있을까?
2. 메테인의 4 개 결합은 어떻게 동등할 수 있을까?
1931년, 이를 설명하기 위해 미국의 화학자 라이너스 폴링(Linus Pauling, 1901-1994)은 오비탈 혼성화(orbital hybridization)라는 개념을 도입했다. 폴링은 이를 통해 결합의 형성 과정을 효과적으로 설명해냈으며, 더 나아가 분자 구조 전반에 대한 설명을 가능케 했다.

2. 전자 승진 (promotion of electrons)
메테인의 화학식은 CH4, 분명 4 개의 C-H 결합을 갖는다. 탄소와 수소가 전자를 공유하여 결합을 만들기 위해서는 탄소의 원자가 전자 4 개가 모두 짝짓지 않은 홀전자 상태로 존재해야 한다. 그런데, 탄소의 바닥상태 전자 배치는 이를 만족하지 못한다.
이 문제는 전자 승진(promotion of electrons)이라는 개념을 통해 비교적 쉽게 설명될 수 있었다. promotion은 승진, 승격, 촉진 등의 용어로 번역되어 다소 생소한 느낌을 줄 수 있지만, 내용 자체는 친숙할 것이라 생각한다.
승진(promotion)은 결합에 필요한 홀전자 수(원자가)를 가질 수 있도록 일부 전자가 들뜨는 과정을 말한다.
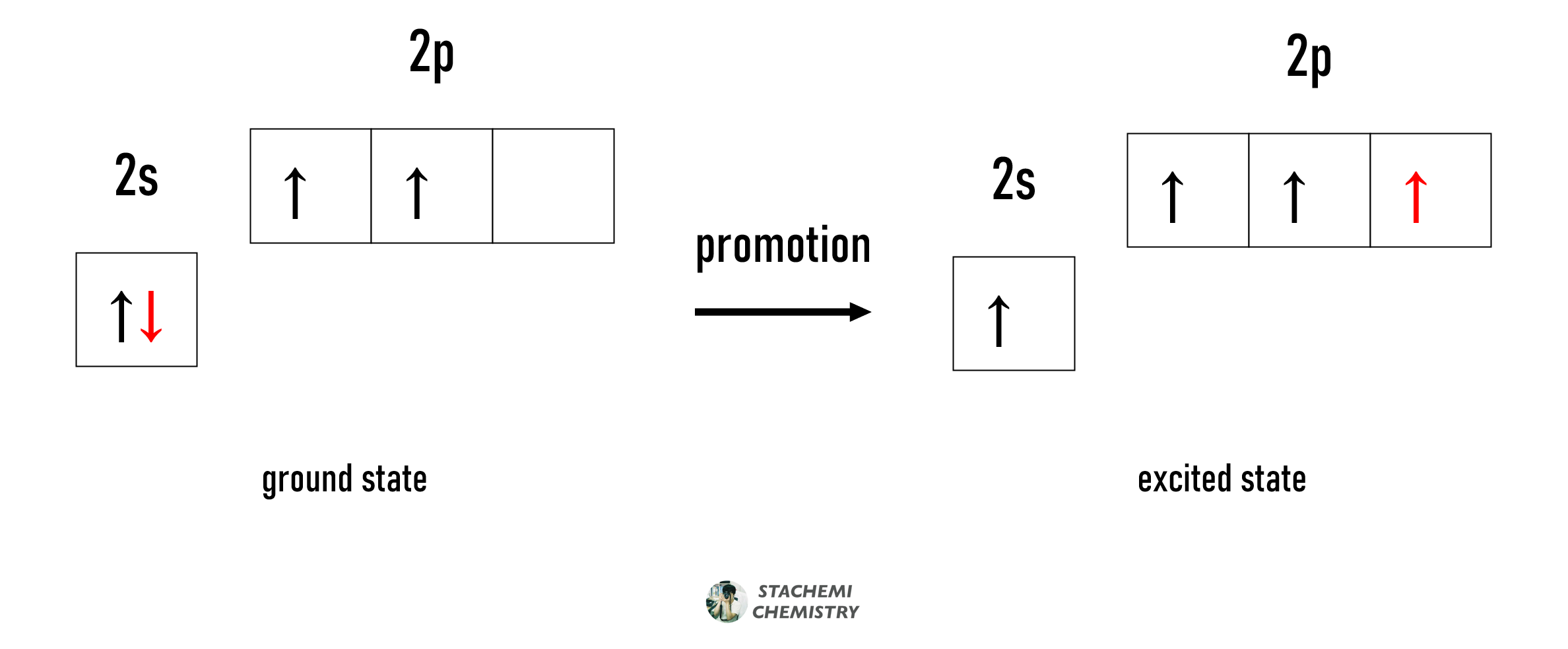
전자 승진은 쌓음 원리(Aufbau principle)를 위배하는 에너지적으로 불리한 과정임이 분명하지만, 이후 결합 형성을 통해 얻을 수 있는 에너지적 이득(안정성)이 훨씬 크기 때문에 거치는 과정쯤으로 설명될 수 있다. (마치, 가까운 미래에 큰 이익을 볼 것이 분명한 상황에서 필요한 초기 투자금 정도라고나 할까?)
일단, 전자 승진 과정을 거쳐 탄소의 홀전자 수가 4 개가 되었으니, 첫 번째 궁금증에 대해서는 어느 정도 해결이 되었다고 하자.
3. 오비탈 혼성화 (orbital hybridization)
홀전자가 2 개뿐인 탄소가 4 개의 결합을 갖는다는 부분은 전자 승진을 통해 어느 정도 해소되었지만, 두 번째 궁금증은 해소되지 않는다. 메테인의 모든 C-H 결합은 구별 불가능할만큼 동등하다는 것이다.
결합에 참여하는 수소의 전자 4 개는 모두 1s 오비탈로 같은 조건이라고 할 수 있지만, 탄소는 그렇지 않다. 승진을 통해 들뜬 탄소 원자가 결합에 참여시킬 수 있는 전자는 2s 오비탈 전자 1 개와 2p 오비탈 전자 3 개이다. 따라서 하나의 결합 (H1s + C2s)은 나머지 세 결합 (H1s + C2p)과 다른 성질을 가져야 한다. (결합 길이가 길거나 짧거나, 강하거나 약하거나 등등...)
* C-H 결합 1 : 수소 1s + 탄소 2s
* C-H 결합 2 : 수소 1s + 탄소 2px
* C-H 결합 3 : 수소 1s + 탄소 2py
* C-H 결합 4 : 수소 1s + 탄소 2pz
또한, 모양이 같은 탄소의 2p 오비탈은 x, y, z 축 위에 각각 분포하고 있으며, 이대로 수소의 1s 오비탈들과 겹침이 일어나서 결합을 형성했다 하더라도 세 결합의 결합각(∠HCH)은 90 ˚에 가깝게 관찰되어야 한다.
하지만 실제 관찰된 메테인의 구조는 네 결합이 모두 동등하여 구분할 수 없고, 109.5 ˚의 동일한 결합각(∠HCH)을 갖는다. 이는 우리의 예측에서 많이 벗어난 결과이다.
이 문제는 폴링이 제안한 혼성화(hybridization) 개념으로 설명 가능하다. 혼성화는 결합의 재료가 되는 중심 원자의 오비탈들(탄소의 2s 과 2px, 2py, 2pz )을 완전히 혼합한 다음, 균등한 4 개의 새로운 오비탈로 만드는 것이다. 이렇게 만들어진 새로운 오비탈을 혼성 오비탈(hybrid orbital)이라 한다.

마치, 모양과 색깔이 제각각인 반죽 4 개를 모두 한 덩어리로 합쳐 버린 뒤에 완전히 혼합하여 똑같은 크기와 모양의 반죽 4 개로 나누는 것과 같다.

만들어지는 혼성 오비탈의 수는 혼합 반죽 재료가 된 원자 오비탈 수의 합과 언제나 같다. 2s + 2px + 2py + 2pz, 총 4 개 오비탈이 재료로 사용되면, 만들어진 혼성 오비탈 또한 넷이다.
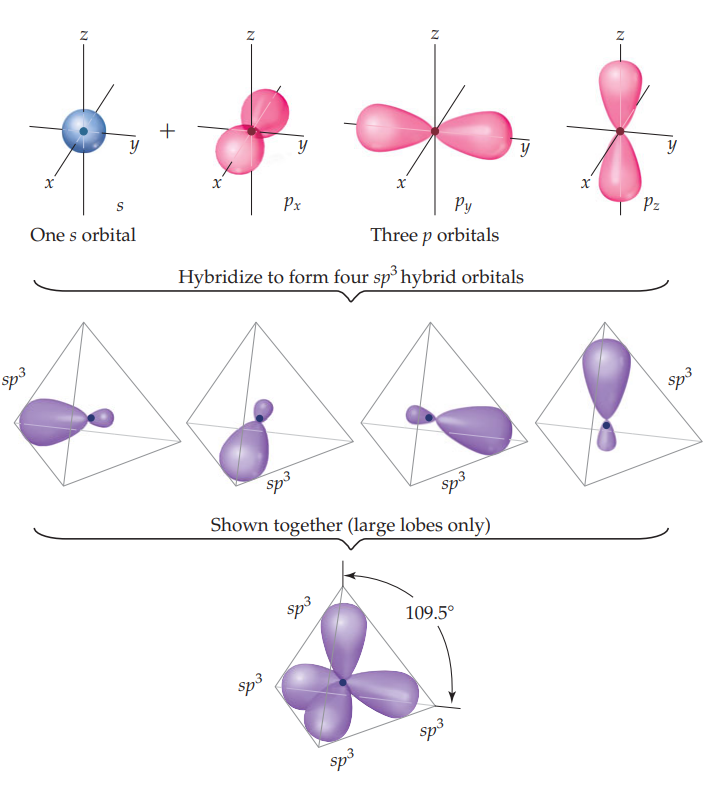
혼성 오비탈의 모양은 재료가 되는 오비탈이 적절히 혼합된 모양을 갖는다. 위의 경우 s 오비탈 25%(1/4), p 오비탈 75%(3/4)로 혼합된 모양을 갖는다. 이를 sp3 혼성 오비탈이라 표현하며, 혼성화에 참여한 재료 오비탈의 수와 종류에 따라 sp 오비탈, sp2 오비탈, sp3 오비탈, dsp3(또는 sp3d ) 오비탈, d 2sp3(또는 sp3d 2) 오비탈 등으로 이름 붙인다. 이름에 따라 혼성 오비탈의 모양(s,p, d 혼합 비율)도 각각 다르겠다.
4. 마치며...
혼성 오비탈 이론은 분자들의 결합과 구조를 '설명'하는데 매우 유용하다. 하지만, 그것이 곧 분자의 결합이 그러해야 함, 분자의 기하 구조가 그러해야 함에 대한 '이유'가 될 수는 없다. 그저 우리가 자연을 직관적으로 이해할 수 있도록 도와주는 유용한 수학적 '방법'일 뿐이다. 이론 때문에 자연이 실재하는 것이 아니다.
메테인의 동등한 네 결합, 정사면체 구조라는 관찰 '결과(현상)'를 효과적으로 설명하기 위해 중심 탄소의 '승진'과 '혼성화'라는 아이디어(개념, 이론)가 필요한 것이다. 따라서 "메테인의 중심의 탄소 원자가 sp3 혼성을 하기 때문에 메테인(CH4)의 구조는 정사면체이다."는 말은 어딘가 어색한 표현이라고 할 수 있다. 마치 인간의 아이디어(생각)을 위해 자연의 분자들이 그렇게 존재해야만 한다는 말이 되어버린다. 앞 뒤가 바뀌었다.
혼성 오비탈은 분자들로부터 관찰된 결과(현상)을 설명하기에 직관적이고, 편리한 해석 방법(도구) 일뿐이며, 우리는 이 도구를 자연(분자, 결합)을 이해하는데 적절히 사용하면 된다. 따라서 "메테인의 정사면체 구조는 중심 탄소의 sp3 혼성화 개념을 통해 설명할 수 있다."가 보다 적절한 표현이라고 할 수 있다.
혼성 오비탈
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 화학사 이야기 - 루이스 구조식과 옥텟 규칙 (2) | 2022.09.29 |
|---|---|
| 플라스틱 종류별 적외선 스펙트럼 (9) | 2022.09.14 |
| 전자기파 (electromagnetic wave) (0) | 2022.08.01 |
| 전자의 스핀 (feat. 슈테른-게를라흐 실험) (0) | 2022.07.25 |
| 고등학생을 위한 적외선 분광법 : (1) 기초 (2) | 2022.07.20 |



