* 본문 내용은 고등학교 화학1을 공부하는 학생을 대상으로 작성한 글입니다. 최대한 파동함수 언급 없이 오비탈 개념을 설명하다 보니 본질에서 벗어난 비유적 표현/용어들이 사용되었음을 감안해주시면 감사하겠습니다.
현대적 원자 모형 : 오비탈과 양자수
1. 무엇을 학습해야 할까?
* 공부를 할 때, 세부 단원에서 내가 최종적으로 성취해야 할 목표가 무엇인지 정확하게 아는 것은 굉장히 중요하다. 수업을 시작할 때, 선생님들께서 학습 목표를 소리 내어 읽게 하거나 칠판에 적는 행위들은 그저 시간을 보내기 위함이 아니라 '이번 시간을 통해 성취해야 하는 목표가 이것이다!'라는 것을 사전에 알리는 의미다.
* 2015개정 교육과정에는 성취기준이 함께 제시되어 있다. 성취기준은 개별 학교 실정과 특성에 맞게 교사 개개인이 일부 수정할 수 있는 여지가 있지만 특별한 일이 없으면 대부분 제시된 기준을 그대로 사용하는 편이다. 수능이나 학력평가와 같이 국가 수준으로 진행되는 시험에서는 철저하게 교육과정과 성취기준에 근거하여 출제하기 때문에 학생들은 이를 사전에 파악해 둘 필요가 있다.
* 2015 개정 교육과정 화학1 성취기준을 살펴보면, '양자수'와 '오비탈'을 이용해서 원자의 현대적 모형을 설명하도록 되어 있다. 물론, 이전(2009개정) 교육과정에서도 '오비탈' 개념은 포함되어 있었지만 '양자수' 개념은 내용 요소에 없었으며, 현대적 원자 모형을 설명하도록 명시한 것도 현 교육과정에서 바뀐 부분이다.
| 영역 | 핵심개념 | 일반화된 지식 | 내용 요소 |
| 물질의 구조 | 물질의 구성 입자 | 원소는 주기성을 갖는다. | * 양자수 * 오비탈 * 전자배치 * 주기율표 * 유효 핵전하, 원자 반지름, 이온화 에너지의 주기성 |
< 이전(2009개정) 교육과정 >
2. 개성 있는 원소
- 화1204-1. 오비탈과 스핀 개념을 설명할 수 있다.
- 화1204-2. 배타 원리, 훈트 규칙, 쌓음 원리를 적용하여 다전자원자의 전자 배치를 설명할 수 있다.
< 현(2015개정) 교육과정 >
2. 원자의 세계
- 12화학I 02-02 : 양자수와 오비탈을 이용하여 원자의 현대적 모형을 설명할 수 있다.
- 12화학I 02-03 : 전자 배치 규칙에 따라 원자의 전자를 오비탈에 배치할 수 있다.
* 따라서 학생들은 '현대적 원자 모형을 오비탈을 통해 설명하는 것'에 목표를 두고 학습할 필요가 있다. (그런데, 그게 그렇게 말처럼 간단하지는 않다.)
2. 오비탈에 대해 알아보자
목표는 현대적 원자 모형을 설명하는 것이다. 오비탈과 양자수라는 용어가 생소하긴 하지만, 현대에 이르러 원자의 구조를 어떻게 설명하고 있는지에 대해 아는 것이 먼저다.
가. 결국은 핵과 전자로 이루어진 원자의 구조를 설명한다.
* 한마디로 오비탈(orbital)은 현대 원자 모형이다. 즉, 원자 내부의 핵과 전자가 어떤 형태로 존재하는지를 설명하기 위한 개념이다. 그런데, 이전 모형들과 달리 그림 모형이나 비유로 설명하기가 좀 애매하다. 그래서 조금 생소하게 느껴지는 것뿐이다.
* 영국의 J.J. 톰슨은 전자를 발견한 뒤에, 원자 구조를 플럼 푸딩(plum pudding)에 빗대어 설명했다. 내가 발견했으면, 초코칩 쿠키 모형이라고 했을지도 모른다. 톰슨은 영국 사람이었기에 플럼 푸딩으로 대중을 이해시켰다.

* 러더퍼드는 원자핵을 발견한 뒤, 태양계의 행성에 빗대어 설명했다. 보어는 전자가 정해진 트랙(궤도, orbit)를 돌고 있는 원자 구조를 제시했다. 현대의 오비탈 모형도 이러한 비유 모형과 다르지 않다.
* 현대 모형인 오비탈을 이해하는 데 있어서 '전자구름 모형'이라는 표현이 더 쉽다. 즉, 원자 구조를 전자 구름(electron cloud)에 빗대어 설명하는 것이다. 아래의 <그림 2>는 수소 원자의 오비탈(전자 구름)을 표현한 것이다. 전자가 마치 구름처럼 원자 내부에 퍼져있는 형상이다.

* 그런데 좀 이상하다. 분명, 수소 원자에는 전자가 1 개 뿐인데, 전자가 퍼진다는 것이 무슨 말인가? 전자가 쪼개지기라도 한다는 말인가?
* 보어의 궤도 모형까지는 이미지가 딱 정형화되고, 머릿 속에 그려지는데, 오비탈 모형은 전자구름 모형이라고 빗대어 표현하긴 했지만, 전자 1 개가 구름처럼 분포를 갖는다는 것은 애매하고 명확하게 와닿지 않는다.
* 보어는 궤도 모형을 통해 전자가 정해진 궤도(트랙)를 회전하고 있는 것처럼 설명했다. 보어 모형에 따르면, 수소 원자 내부에 존재하는 1 개의 전자는 (어떤) 궤도 위에서 정확히 발견할 수 있다. 궤도 위 존재 확률이 100%이다. 전자가 어떤 운동을 하는지도 알 수 있다. 보어는 원운동이라 했다.

* 그런데, 1927 년에 독일의 하이젠베르크가 '전자가 어디에서, 어떤 운동을 하는지는 정확하게 알 수 없다! 특정 값 이상의 불확실성을 항상 갖는다'는 사실을 수학적으로 증명해버렸다. 이런... (불확정성의 원리)
* 이 때부터 우리는 전자의 위치와 운동량을 완벽하게 알 수 없다는 것을 인정해야만 했다.
* 결국, 우리는 '전자는 어디 있을까?', '전자를 어디에서 발견할 수 있을까?' 등의 질문에 '확신'의 대답을 할 수 없으며, 발견 '확률'로만 대답할 수 있다는 것을 알게 되었다. 이것이 보어의 궤도(orbit) 모형과 현대의 오비탈(orbital) 모형의 가장 큰 차이점이다.
* 그렇다면 우리는 원자의 구조 또한 확률 개념으로 설명할 수밖에 없다. 수소 내부에 1 개의 전자가 존재하는 것은 분명한데, 어디에 있는지 정확히 알 수 없고, 확신할 수 없다. 단지, 그 전자 1 개가 존재할 확률이 큰 곳과 작은 곳이 있을 뿐이다. 존재 확률이 크고/작음에 따라 그 위치를 진하고/흐리게 (또는 밝고/어둡게) 표현할 수 있을 뿐이다.

* 위의 <그림 2>를 다시 살펴보자. 무수히 많은 점들로 표현되었다. 여기서 점은 전자 1 개, 2 개가 아니라 그 지점에 '전자 존재 확률이 있음'을 표현한 것이다. 점이 좁은 공간에 오밀조밀 많이 표현되어 진하게 보인다는 것은, 그 부근에서 전자 발견 확률이 크다는 것을 말한다.
* 결과적으로 수소 원자 구조를 확률 개념을 통해 표현해놓고 보니, 존재하는 전자는 1 개뿐인데, 마치 구름이 퍼져있는 것과 같은 모양이 되었다.
현대 원자 모형 = 오비탈(orbital) = 전자 구름 모형 = 전자 존재 확률 분포
나. 그렇다면 모든 전자는 언제나 같은 분포(모양)를 가질까?
* 하늘에 구름도 다양한 모양이 있듯이 원자 속 전자 구름의 분포(모양, 확률분포)도 언제나 똑같이 나타나는 것은 아니다. 다시 말해 전자구름도 다양한 모양을 가진다.
* <그림 2>는 전자 존재 확률이 전방향으로 고르게 분포한 구형(sphere)이다. 하지만, 구 모양이 아닌 다른 모양일 수도 있다. 같은 구 모양이라도 내부 전자의 확률 분포가 다를 수 있다.
* 물론, 뒤에서 다루겠지만, 전자의 확률 분포(전자 구름의 모양)가 달라진다는 것은 해당 분포를 갖는 전자의 에너지 값도 달라진다는 것이다. 전자는 안정한 분포를 갖고 싶어 한다. 전자가 1개만 있다면, 가장 안정한 확률분포를 가지려 할 것이다. (전자는 핵에서 멀어질수록 안정화되기 어렵다.)
* 아래의 <그림 4> 또한 <그림 2>와 마찬가지로 수소 원자의 전자 구름들을 나타낸 것이다. 그런데 <그림 4>의 전자구름들이 앞선 <그림 2>와 비슷하면서도 조금 달리 보인다.
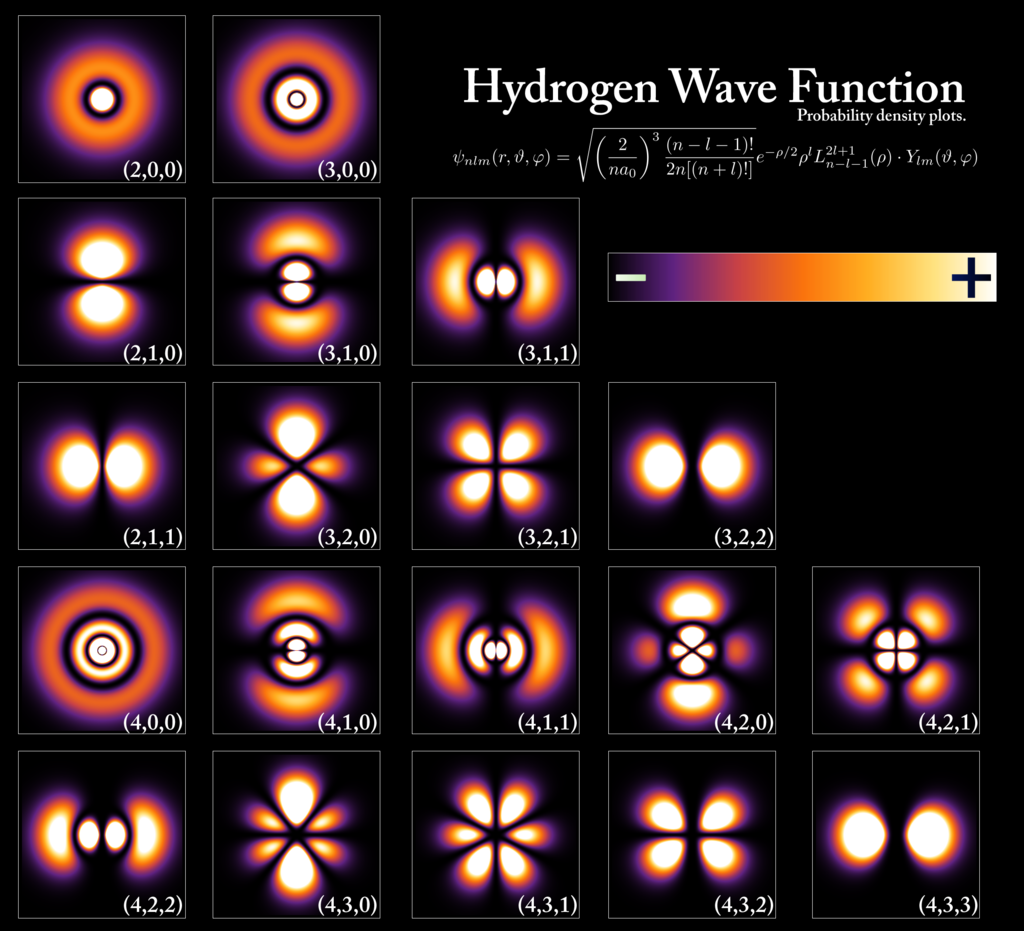
* 전자 구름의 모양(오비탈의 종류)을 찬찬히 살펴보니 괄호 안의 숫자(a,b,c) 조합에 따라 달라진다. 바꿔 말하면, (a, b, c)의 숫자 조합을 바꿔줌에 따라 오비탈의 종류(전자 확률 분포)를 표현할 수도 있다는 것이다. <그림 2>의 경우는 (1,0,0)이다. <그림 4>에서도 오비탈에 해당하는 숫자 조합을 확인할 수 있다.
* 이 괄호 안의 숫자 각각이 바로 양자수(qunatum number)이다.
다. 양자수를 통해 오비탈의 종류를 살펴보자
1) 주양자수 (principle quantum number, n) (a, b, c)
* 위에서 a로 표현한 괄호 안에 첫 번째 숫자는 주양자수이다. 기호는 n 으로 나타낸다.
* 주양자수는 오비탈(전자구름)의 크기를 결정한다. 즉, 전자가 핵으로부터 멀리 떨어진 위치까지 분포하고 있다는 의미이다. <그림 5>의 (2,0,0) 오비탈보다 (3,0,0) 오비탈이 더 크다. 달리 말해 전자구름이 더 넓게 퍼져있다는 것이다.
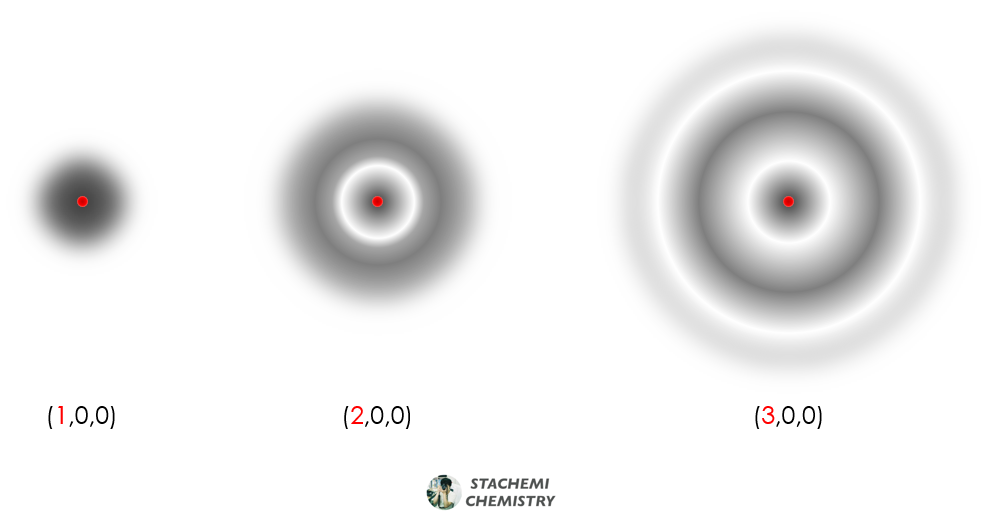
* 전자가 핵으로부터 멀리 위치한다는 것은 핵과 전자의 상호작용이 약하다는 것을 뜻한다. 즉, 주양자수(n)가 커질수록 오비탈의 크기가 커지고, 전자는 핵으로부터 멀리 떨어져 분포할 확률이 크다. 자연스레 전자는 높은 에너지로 인해 불안정해진다.
* 즉, 주양자수는 오비탈의 에너지를 결정한다. 주양자수가 클수록 오비탈의 에너지는 크다.
* 주양자수 n = 1, 2, 3 ... n 까지의 정수 값을 가질 수 있다.
2) 부양자수, 방위 양자수, 각운동량 양자수 (angular momentum quantum number, l ) (a, b, c)
* 위에서 b로 표현한 두 번째 숫자는 이름이 많다. 부양자수, 방위 양자수, 각운동량 양자수, 무엇이라 해도 상관없다. 기호는 l 로 나타낸다.
* 부양자수는 오비탈(전자구름)의 전체적인 모양을 결정한다. 전체적인 분포가 구 모양인지, 아령 모양인지, 클로버 모양인지를 결정한다.
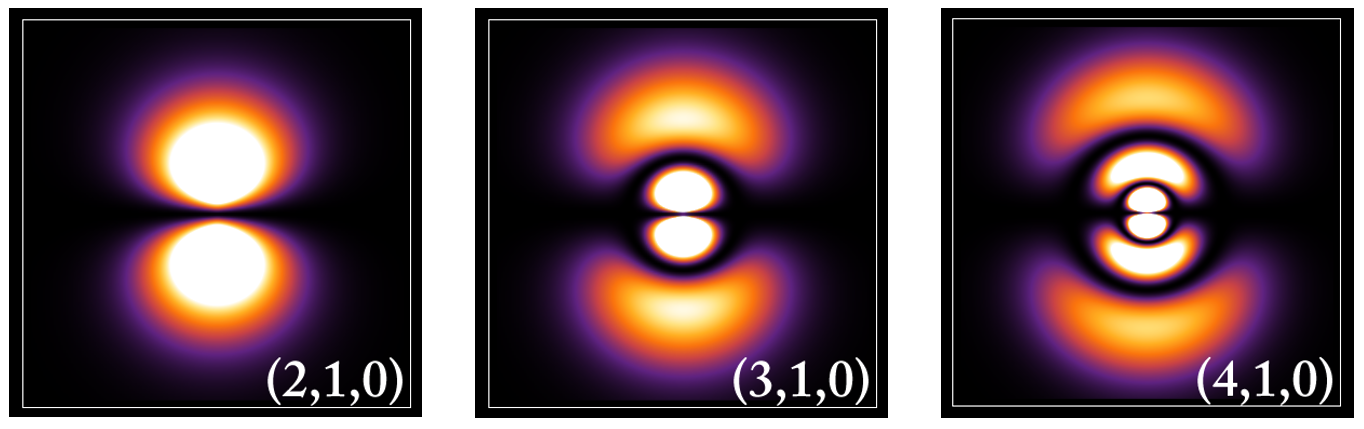
* <그림 6>는 왼쪽부터 (2,1,0), (3,1,0), (4,1,0)이다. 모두 부양자수가 1로 같다. 전체적으로 8자 형태의 아령 모양임을 알 수 있다. 주양자수가 2, 3, 4로 커지니 오비탈의 크기는 (4,1,0)이 제일 크겠다.
* 두 번째 숫자가 0이면, 구형, 1이면, 아령 모양, 2이면 클로버 모양을 갖는다. 부양자수는 오비탈의 모양을 결정하는데, 0번 모양, 1번 모양, 2번 모양으로 부르기보다 적절한 기호가 있으면 좋겠다. 숫자별로 기호를 가지고 있다. 0 = s, 1 = p, 2 = d, 3 = f 이다. 따라서 위의 <그림 6>은 왼쪽부터 2p, 3p, 4p 오비탈이다.
* 참고로, 기호의 알파벳은 sharp, principal, diffuse, fundamental의 첫 글자를 딴 것이며, 분광학에서 사용되는 스펙트럼 이름으로부터 결정되었다.
* 부양자수 l = 0, 1, 2, 3 ... n-1 까지의 정수 값까지 가질 수 있다. 가질 수 있는 부양자수(l) 값이 주양자수(n)에 의존함을 알 수 있다.
* 예를 들어 n=3 인 경우, 부양자수 l = 0, 1, 2 까지 가질 수 있으며, 총 3 종류의 오비탈(s, p d)를 가질 수 있다.
3) 자기양자수 (magnetic quantum number, m) (a, b, c)
* 마지막으로 c로 표현한 세 번째 숫자는 자기 양자수이다. 기호는 m으로 나타낸다.
* 자기 양자수는 오비탈(전자구름)의 분포 방향(배향)을 결정한다. 전자 구름이 x축 방향으로 향하는지, y축 방향으로 향하는지, xy평면 위에 놓이는지, xy 축 위에 놓이는지 등을 알려 준다.
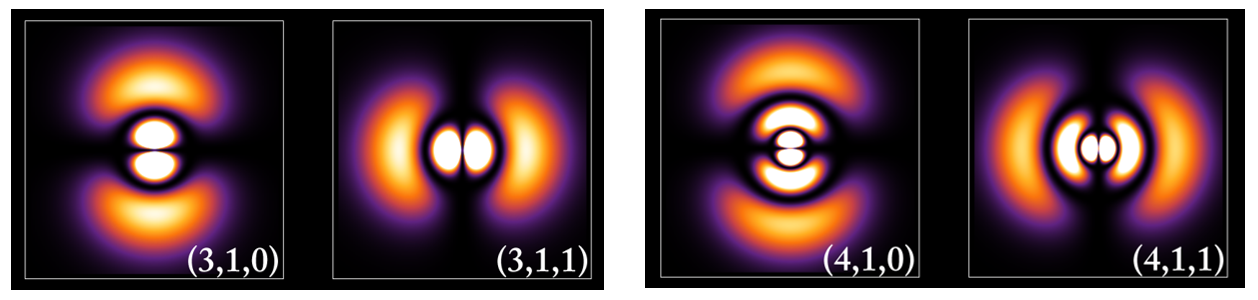
* 위의 <그림 7>을 살펴보면, 괄호 안의 마지막 숫자인 자기 양자수가 0인 경우는 확률 분포가 모두 위-아래 방향(z축 방향)을 향하는 반면, 1인 경우는 좌-우 방향(x 또는 y축 방향)을 향하고 있음을 알 수 있다.
* 자기 양자수 m = -l ~ +l 까지의 정수 값을 갖는다. 이로써 자기 양자수(m)는 부양자수(l )에 의존함을 알 수 있다. 부양자수 값에 따라 전자 구름의 분포가 놓일 수 있는 공간 배향의 개수(m의 수)가 결정된다.
* 예를 들어, l = 1인 경우, 즉, p-오비탈은 m = -1, 0, +1의 세 가지 값을 가질 수 있다. 이는 공간 상에서 세 방향으로 분포할 수 있다는 것을 뜻한다. 그 방향이 x, y, z 축이어서 우리는 p-오비탈을 px, py, pz로 구분한다.
* l = 2인 경우, d-오비탈은 m = -2, -1, 0, +1, +2 까지 가능하기에 총 다섯 방향으로 전자구름이 퍼질 수 있다.
* l = 0인 경우, 즉, s-오비탈의 경우에는 m = 0만을 가지며, 이는 공간상에 1 가지 분포 밖에 없다는 것을 말한다. s-오비탈은 구형이고, 방향성을 갖지 않으니 어찌 보면 당연한 것이다.
3. 정리해보자
* 우리가 이 단원을 통해 성취해야 할 목표는 다음과 같다.
"양자수와 오비탈을 이용하여 원자의 현대적 모형을 설명할 수 있다."
* 현대적 원자 모형에서는 전자의 위치와 운동을 확률로만 표현할 수 있다. 현대적 원자 모형은 오비탈 모형, 전자구름 모형이다.
"현대적 원자 모형" = "오비탈 모형" = "전자구름 모형" = "전자가 존재할 수 있는 확률(점)의 분포 모형"
* 전자구름의 형태(크기, 모양, 배향)는 양자수의 조합(n, l, m)에 따라 결정된다.
| * 주양자수 , n = 1, 2, 3, .... n 까지 (오비탈의 전체 크기 결정, 전자의 에너지 결정) |
| * 부양자수 , l = 0, 1, 2, .... n -1 까지 = s, p, d, f, .... (오비탈(=전자 존재 확률의 분포)의 전체적인 모양 결정) |
| * 자기 양자수 , m = - l ~ + l 까지 (오비탈의 배향 결정) |
* 결국, 양자수의 조합에 따라 다양한 전자 구름 분포를 가질 수 있는데, 전자가 1개만 있다면 이 중에서 가장 안정한 형태를 갖는 것이 에너지적으로 유리하다. 수소 원자의 경우 (1,0,0)의 양자수 조합인 1s가 유리하다.
- 끝 -
[추천] 고등학생을 위한 파동 방정식과 양자수의 의미 https://stachemi.tistory.com/309
고등학생을 위한 파동 방정식, 그리고 양자수의 의미
고등학생을 위한 파동 방정식, 그리고 양자수의 의미 0. 상상하기 쉽지 않은 오비탈 모형, 그리고 양자수 보어의 궤도 모형은 고등학교 교육과정상 물리와 화학에서 비슷한 시기에 다루고, 전자
stachemi.tistory.com
[심화] 각각의 양자수가 왜 그러한 조건을 갖는지에 대한 내용은 고등학교 수준을 넘어서는 내용입니다. 수소 원자에 대한 슈뢰딩거 방정식을 풀이해야 합니다. 관련된 내용은 아래의 링크에서 참고하시기 바랍니다.
* 수소 꼴 원자의 슈뢰딩거 방정식 풀이 (1) https://stachemi.tistory.com/73
수소꼴 원자의 슈뢰딩거 방정식 풀이 (1)
수소꼴 원자의 슈뢰딩거 방정식 풀이 (1) 양자물리학의 가장 큰 성공은 수학적으로 원자의 구조를 완전히 설명할 수 있다는 것이다. 하지만 모든 원자를 수학적으로 완전히 풀어낼 수 있는 것은
stachemi.tistory.com
* 수소꼴 원자의 슈뢰딩거 방정식 풀이 (2) https://stachemi.tistory.com/74
수소꼴 원자의 슈뢰딩거 방정식 풀이 (2)
수소꼴 원자의 슈뢰딩거 방정식 풀이 (2) [수소꼴 원자의 슈뢰딩거 방정식 풀이 (1) 링크] https://stachemi.tistory.com/73 지난 포스팅을 통해 1개의 전자만을 갖는 수소꼴 원자의 슈뢰딩거 방정식의 좌
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| 화학 반응식의 양적 관계 연습하기 (0) | 2020.06.16 |
|---|---|
| 2성분 혼합물의 증류 과정: 분별 증류의 원리 (21) | 2020.06.14 |
| 화학사 이야기 - 라부아지에의 산소 이론 (2) (2) | 2020.06.05 |
| 화학사 이야기 - 라부아지에의 산소 이론 (1) (0) | 2020.06.04 |
| 화학사 이야기 - 플로지스톤설 (phlogiston theory) (0) | 2020.05.26 |



