루이스 구조식과 옥텟 규칙
리튬, 베릴륨, 붕소, 탄소, 질소, 산소, 플루오린... 원자들은 모두 2주기 원소라는 점에서 비슷한 면이 있지만, 원소 각각의 성질은 매우 다르다. 이들 원소 알맹이들은 바깥 껍질에 각기 다른 수의 전자를 갖고, 원소 저마다의 독특한 성질들이 이러한 바깥 껍질 전자 수에 의해 결정된다는 생각이 들어도 이상하지 않다.
과거 화학자들 역시, 원자의 바깥 껍질 전자 수(원자가 전자)와 원소 성질의 연관성에 관심을 가졌으며, 이를 바탕으로 원자 간 반응과 결합 등을 설명하려 했다.
이렇게 원자의 바깥 껍질 전자만으로 결합을 설명하려 시도했던 이론들을, 원자가 결합 이론(valence bond theory, VBT)이라 한다. 그리고 이 이론의 시작점에 빠지지 않고 언급되는 화학자가 한 명 있는데, 바로 미국의 물리화학자 길버트 루이스(Gilbert N. Lewis, 1875-1946)이다.
[참고] 169. 원자가 결합 이론 (valence bond theory, VBT)
원자가 결합 이론 (Valence Bond Theory, VBT)
원자가 결합 이론 (Valence Bond Theory, VBT) "하이틀러-런던의 접근법을 바탕으로 설명하는 원자가 결합 이론" 1. 역사 미국의 화학자 길버트 루이스(Gilbert N. Lewis, 1875-1946)는 1916 년, 《The Atom and T..
stachemi.tistory.com
1. 루이스의 입방체 원자 모델
1904년, 리하르트 아베크(Richard Abegg, 1869-1910)는 원소들의 정상 원자가(normalvalence)와 반대 원자가(contravalence)의 차이가 8이라는 아베크 규칙(Abegg's rule)을 발표했다. 아베크는 원자들이 바깥 껍질 전자를 잃거나 얻어 자신의 원자가를 상쇄시키고, 이러한 과정을 통해 결합이 만들어진다고 설명했다. 결합 형성을 원자 사이의 전자-전달로 설명한 것이다.

반면, 미국의 길버트 루이스는 아베크와는 별개로 1902년부터 "원자가와 전자에 관한 이론(electron theory of valence)"에 몰두하고 있었다.
루이스는 원자 내 전자를 쉽게 표현할 수 있는 모형을 구상하는 중이었다. 결합을 설명하기 위한 모형이라기보다 J.J. 톰슨이나 어니스트 러더퍼드가 시도했던 (원자 구조를 설명하기 위한) 모형에 가까웠다. 루이스는 원자의 바깥 전자를 입방체 꼭짓점에 배치하는 표현법을 사용했고, 이를 입방체 원자 모델(cubical atom model)이라 했다.

루이스는 자신의 모형을 정교화하는 과정에서 두 가지 결론에 도달했는데, 하나는 주기적으로 반복되는 전자 껍질에 관한 것이었고, 나머지 하나는 비활성 기체와 같은 전자 배치(8개의 전자)를 가질 때의 안정성에 관한 것이었다. 후자의 경우, 아베크의 전자-전달 모델에서 원자들은 전자를 잃거나 얻어 자신의 원자가를 상쇄시키고, 비활성 기체와 같은 전자 배치를 가지려는 경향이 있다는 점에서 비슷한 면이 있었다.
그러나, 루이스는 전혀 다른 극성의 물질들을 모두 아베크 모델 하나로 설명한다는 것에 다소 회의적이었다. 아베크의 전자 전달 모델은 극성이 큰 이온성 염들을 설명하는 데는 분명 적합해 보였지만, 유기 화학 분야에서 주로 다루는 극성이 없는 물질들에도 그대로 적용될 수 있을지에 대한 의문이 있었다.
루이스는 무극성 물질들의 결합 형태 또한 비극성(nonpolar)에 가까운 모습을 가져야한다고 생각했기에, 이온성 염과는 구분되는 다른 설명 체계가 필요하다고 생각했다. 전자 전달을 통한 결합 형성은 결합의 비극성을 설명할 수 없었다.
이에, 그는 물질이 근본적으로 두 종류로 구별되어야 한다고 생각했으며, 이러한 자신의 믿음을 담은 논문 《 Valence and Tautomerism , 원자가와 토토머리즘 》을 1913년에 발표했다.

루이스는 이 논문을 통해 다수의 물질을 화학적 특성에 따라 극성(polar)과 비극성(nonpolar), 두 그룹으로 분류했다. 염화 칼륨(KCl)과 같은 이온성 염과 메테인(CH4)과 같은 탄화수소를 구분했으며, 구분 기준은 전자 이동 가능성(mobile & immobile)이었다.

이 논문에서의 한 가지 특징적인 점은 자신이 개발한 입방체 원자 모델에 대한 언급이 전혀 없다는 것인데, 자신의 입방체 모델이 물질의 결합까지 설명할 수 있는 충분한 체계를 갖추지 못했다고 생각했기 때문으로 보인다.
2. 무극성 물질들의 결합을 설명하는 방법
3년 뒤인 1916년에는 원자가 전자와 결합에 관한 중요한 논문 두 편이 연달아 발표되었다. 하나는 3월, 뮌헨 대학의 발터 코셀(Walter Kossel, 1888-1956)이 학술지 Annalen der Physik 에 발표한《Über Molekülbildung als Frage des Atombaus, 분자 형성에 관한 연구》이며, 나머지 하나는 이로부터 한 달 뒤, 길버트 루이스가 Journal of the American Chemical Society (JACS)에 발표한 《The Atom and The Molecule , 원자와 분자》이다.
루이스는 이 논문에서 자신의 입방체 모델(Fig. 2.)을 처음으로 소개했는데, 1913년부터 1916년 사이에 자신의 모델을 기반으로 결합을 설명하는 방법에 대해 생각 정리가 어느 정도 되었음을 짐작할 수 있다. 그는 '전자 공유' 개념을 통해 극성이 없는 물질들의 '비극성 결합' 문제를 설명한다.
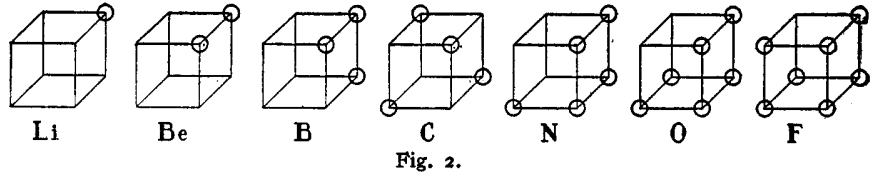
루이스는 중성 원자의 전자 껍질(궤도)을 입방체의 모서리로 나타내고, 전자를 각 꼭짓점에 위에 동그라미로 표현했다. 입방체 꼭짓점을 채운 전자 수가 원자의 화학적 행동(성질)에 대한 중요한 법칙으로 작용한다고 설명했다.
루이스는 안정한 분자들 대부분이 짝수 개의 전자를 갖는다는 공통점에 주목하여 전자쌍 아이디어를 떠올렸는데, 분자 내 전자들은 서로 짝을 이루어 존재하고, 원자 사이 만들어진 결합 또한 "두 원자가 서로 공유하는 한 쌍의 전자(a pair of electrons)에 지나지 않는다"는 주장이었다. 루이스는 이를 전자쌍 결합(electron pair bond)이라 표현했다.
여기서 "공유한(shared)"이라는 말은 결합 전자쌍이 두 원자의 전자 껍질을 동시에 차지할 수 있다는 것을 뜻했다. 이 새로운 방법을 적용하면, 원자의 원자가(valence)와 다양한 분자들이 갖는 구조를 간단하게 설명할 수 있었다.
[접은글, 참고] 전자 공유를 통해 결합을 설명하려는 시도를 한 것은 루이스가 유일했을까?
사실, 화학 결합이 원자들 사이의 전자 공유로 설명될 수 있다는 생각을 루이스만 유일하게 한 것은 아니었다. Alfred L. Parson(1915), William C. Arsem(1914), H. Kauffmann(1908), 유명 물리학자인 요하네스 슈타르크(J. Stark)나 J.J. 톰슨(J. J. Thomson)도 비슷한 아이디어를 제안했다. 하지만, 다른 여러 제안들이 좋은 평가를 받지 못했던 이유는, "결합 하나당 관여하는 전자 수(total electrons per bond)", "전자 공유에 동시에 참여하는 원자 수" 와 같은 궁금증에 대한 합리적인 범위를 제시해주지 못했기 때문이다. 쉽게 말해 너무 광범위하게 열려 있었기에 유용하게 사용되기 어려웠다. 반면, 루이스는 "하나의 결합을 형성하기 위해 필요한 전자 수는 2개", "하나의 결합에 관여하는 원자 수는 2개"로 제한했으며, 이에 적극적으로 활용 가능한 모델이 될 수 있었다.
[출처] William B. Jensen, "Abegg, Lewis, Langmuir, and the octet rule", J. Chem. Educ. (1984) 61(3), 195

루이스는 원자들이 전자를 공유하여 결합을 이루려는 경향 또한, 바깥 껍질에 8개 전자, 4개의 전자쌍(electron pair)을 만족하기 위한 것으로 설명했으며, 이를 8의 규칙(rule of eight)이라 불렀다. (하지만, 가까운 거리의 전자 사이에는 강한 반발력이 작용할 것이 분명함에도 서로 쌍을 이루어 결합이 형성되는 이유까지는 설명할 수는 없었다.)
[접은글, 참고] 루이스의 8의 규칙은 어떻게 옥텟 규칙으로 불리게 되었나?
사실, 우리에게 친숙한 옥텟 규칙은 루이스의 이론에 감명받은 어빙 랭뮤어가 루이스의 이론을 발전시켜나가는 과정에서 새로 제안한 용어이다. 현재 우리에게 친숙한 대부분의 결합 용어는 랭뮤어에 의한 것이 많다. 루이스의 "8의 규칙"은 "옥텟 규칙(Octet rule)"으로, "공유된 전자쌍 결합(shared electron pair bond)"은 "공유 결합(covalent bond)"으로, "반대 전하 이온 사이의 끌림 상호작용"은 "전자가 결합(electrovalent bond, 현재의 이온 결합)"으로 새롭게 명명했다. 루이스는 주변 동료들에게 날선 비판을 날리기로 유명했으며, 적대적인 관계에 놓인 과학자들도 많았다. 반면, 어빙 랭뮤어는 굉장히 사교적이고 뛰어난 언변을 가지고 있어 여러 과학자들과 두루두루 원만했으며, 평판도 괜찮았다. 루이스의 이론은 발표 초기에 거의 관심을 받지 못했으며, 오히려 랭뮤어가 다양한 강연에서 소개하는 덕분에 널리 알려진 면이 있다. 루이스 또한 초기에는 이러한 점을 기뻐했었으나, 이후 랭뮤어가 더욱 인정받게 되면서 둘의 사이도 급격하게 나빠졌다. 우리가 8의 규칙보다 옥텟 규칙이 익숙한 이유도, 랭뮤어의 표현이 보편적으로 사용되는 이유도 약간은 비슷한 이유에서 시작된 것은 아닐까 하는 생각이 든다.
루이스는 하나의 모서리를 공유하는 방식으로 원자들 간 단일 결합(Fig. 3. C)을 설명했으며, 두 모서리(하나의 면)를 동시에 공유하는 방식으로 이중 결합(Fig. 4. A)을 설명했다. 모서리와 면을 공유하는 방식을 통해 각각의 원자는 비활성 기체와 유사한 전자 배치를 가질 수 있으며, 이를 통해 분자의 형성 과정과 결합의 안정성을 설명하였다.
그러나 아세틸렌(HC≡CH)과 같은 분자의 삼중 결합과 자유로운 회전이 가능한 단일 결합의 성질까지 입방체 모델로 온전히 설명해내기는 어려움이 있었으며, 이러한 사실을 루이스 스스로도 알고 있었기에 끝까지 입방체 모델만을 고집할 수는 없었다.

3. 점으로 표현하는 분자 구조식
루이스는 이 논문을 통해 새로운 분자 표기법도 선보이는데, 이것이 고등학교 화학 교과서에서 한 번쯤 봤을법한 루이스 전자-점 식(Lewis electron-dot formula)이다. 보통의 경우, 원자 사이의 결합만 직선으로 나타내는 것이 일반적이었으나 루이스는 원자들의 바깥 전자들을 모두 전자 쌍의 형태로 표기하는 방식을 제안했다.
특히, 결합에 관여하는 전자쌍도 선이 아닌 점으로 나타내는 새로운 방식을 통해, 전자 치우침의 정도까지 표현할 수 있다고 생각했으며, 이는 앞서 자신이 주장한 물질의 극성 유무에 따른 구분과 관련된 것이었다.
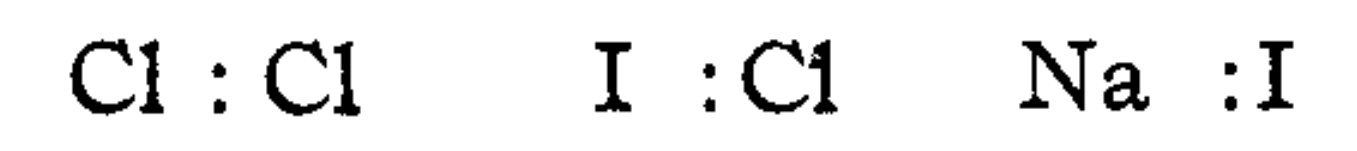
예를 들어 H2나 Cl2와 같이 어느 한 쪽 원자로의 전자 치우침이 없는 무극성 물질의 경우, H : H , Cl : Cl 과 같이 정중앙에 전자쌍을 콜론 형태( : )로 표기하고, 특정 원자에 전자 치우침이 발생하는 경우에는 가운데 전자쌍을 한쪽 원자에 치우친 형태로 나타내는 것이다.
따라서 'BrCl'의 경우 상대적인 전자 치우침에 따라 Br :Cl 의 형태로, 'ICl'의 경우 I :Cl 의 형태로 나타낼 수 있으며, 결합의 극성 정도를 자유롭게 표현할 수 있어 무극성 물질에서부터 Na :I와 같은 이온성 화합물까지 폭넓은 적용이 가능하다고 주장했다.
또한 분자를 구성하는 모든 원자들에 속한 바깥 전자들을 전자-점의 형태로 표시해 줌으로써 중심 원자와 각 주변 원자들의 전자 배치(8의 규칙)에 대한 완전한 표현이 가능하고, 각각의 원자들의 원자가와 실제 결합에 의한 전자수 차이(형식 전하)에 대해서도 알 수 있다고 말했다.
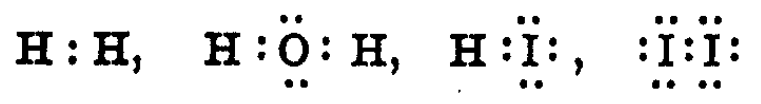
루이스 구조식(전자-점 식)은 원자들 간 결합에 관여하는 전자 수, 원소의 원자가와 옥텟 규칙(전자 배치) 등을 직관적으로 표현하고 있다는 점에서 현재까지 유용하게 사용되며, 원자가껍질 전자쌍 반발(VSEPR) 이론 등과 함께 다루어질 경우 분자의 대략적인 기하 구조까지 상상할 수 있도록 도와준다.
물론, 3주기 이상의 원소가 중심 원자로 포함된 경우 d-오비탈의 사용에 따른 옥텟 규칙의 확장 등으로, 옥텟 규칙만으로 단순하게 설명될 수 없는 부분도 일부 존재하지만, 너무나도 작은 단위의 눈으로 볼 수 없는 분자들의 생김새를 종이 위에 그려볼 수 있다는 점만으로도 충분히 의미가 있다고 생각한다.
[참고 문헌]
[1] William B. Jensen, "Abegg, Lewis, Langmuir, and the Octet Rule", J. Chem. Educ. (1984) 61(3)
[2] R.J. Gillespie, E.A. Robinson, "Gilbert N. Lewis and the Chemical Bond: The Electron Pair and the Octet Rule from 1916 to the Present Day", J. Comput. Chem. (2007) 28: 87-97
[3] Gilbert N. Lewis, "Valence and Tautomerism", J. Am. Chem. Soc. (1913) 35(10): 1448-1455
[4] Gilbert N. Lewis, "The Atom and The Molecule", J. Am. Chem. Soc. (1916) 38(4): 762–785
[5] Robert E. Kohler Jr, "The Origin of G N Lewis's Theory of the Shared Pair Bond." Historical studies in the physical sciences vol.3 (1971): 343-376.
루이스 구조식과 옥텟 규칙
-끝-
* 긴 글 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 약산의 pH 구하기 (3) | 2022.10.13 |
|---|---|
| 공명 구조와 관련된 대표적인 오개념들 (15) | 2022.10.08 |
| 플라스틱 종류별 적외선 스펙트럼 (9) | 2022.09.14 |
| 혼성 오비탈 : 분자의 결합과 구조를 설명하는 효과적인 방법 (0) | 2022.08.11 |
| 전자기파 (electromagnetic wave) (0) | 2022.08.01 |



