공명 구조와 관련된 대표적인 오개념들
1. 공명 구조 (resonance structure)
화학에서 공명(resonance)은 라이너스 폴링(Linus Pauling, 1901-1994)이 비편재화된 전자들을 루이스 구조식(편재화된 분자 모형)에 적용하기 위해 제안한 개념을 말하는 것이 일반적이다. 폴링은 공명을 통해 벤젠(C6H6)의 특별한 평면 구조를 설명했다.
종이 위에 표현된 루이스 구조식은 화합물의 구조를 2차원적으로 알려줄 뿐, 실제 구조를 대변하지는 못한다. 탄산 이온(CO32-)을 예로 들어보자.
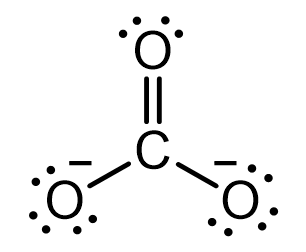
탄산 이온은 중심 탄소와 세 개의 산소 원자가 결합한 평면 구조이다. 루이스 구조 상으로는 하나의 C=O 이중 결합과 두 개의 C-O 단일 결합을 갖는 것처럼 보이는데, 만약 이 구조식이 실제 구조를 완벽하게 보여주고 있는 것이라면 분자 내 길이가 다른 두 종류의 결합이 동시에 존재한다는 사실을 확인할 수 있어야 한다. 이에 탄산 이온의 실제 C-O 결합 길이를 알아볼 필요가 있다.
탄산 이온의 C-O 결합 길이는 기대와 달리 모두 129 pm로 동일하다. 일반적인 C-O 단일 결합은 143 pm, C=O 이중 결합이 120 pm인 것을 감안하면, 탄산 이온의 모든 C-O 결합은 단일 결합과 이중 결합 사이의 애매한(?) 길이를 갖는다.
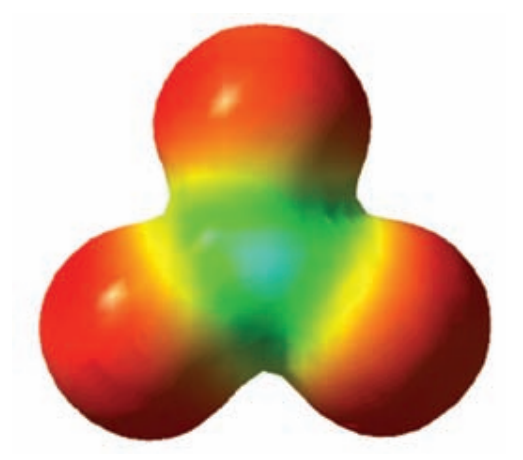
루이스 구조만으로 실제를 완벽하게 나타내기 어려운 이유는, 앞서 말했듯 루이스 구조 자체가 전자 편재화(localized)를 전제로 그려진 모형이기 때문이다. 전자가 편재화되었다는 것은 쉽게 말해, 전자들이 존재 가능한 영역이 제한적이라는 뜻이다.
고전적인 루이스 구조식에서는 전자쌍을 어딘가에 반드시 속하도록 위치를 지정해주어야 한다. 탄산 이온에서 이중 결합으로 표현된 전자쌍이 선택 가능한 위치는 '산소의 비공유 전자쌍'이나 'C-O 사이 공유 전자쌍' 외에는 없다. 애매하게 중간쯤 반만 걸치기는 선택지에 없으며, 여러 군데 동시에 걸치기도 안된다.
그러나 실제 탄산 이온의 전자쌍 하나는 탄소와 특정 산소 하나에만 치우쳐 존재하지 않고, 탄소와 세 산소 사이에 골고루 분포한다. 하나의 루이스 구조식만으로는 이렇게 여러 영역에 비편재화된 전자를 표현하기 어렵다.
따라서 루이스 구조식을 실제에 가깝게 나타내기 위해서는 특정 구조식 하나 만으로는 부족하며, 추가적인 구조들을 함께 고려해 주어야만 한다.
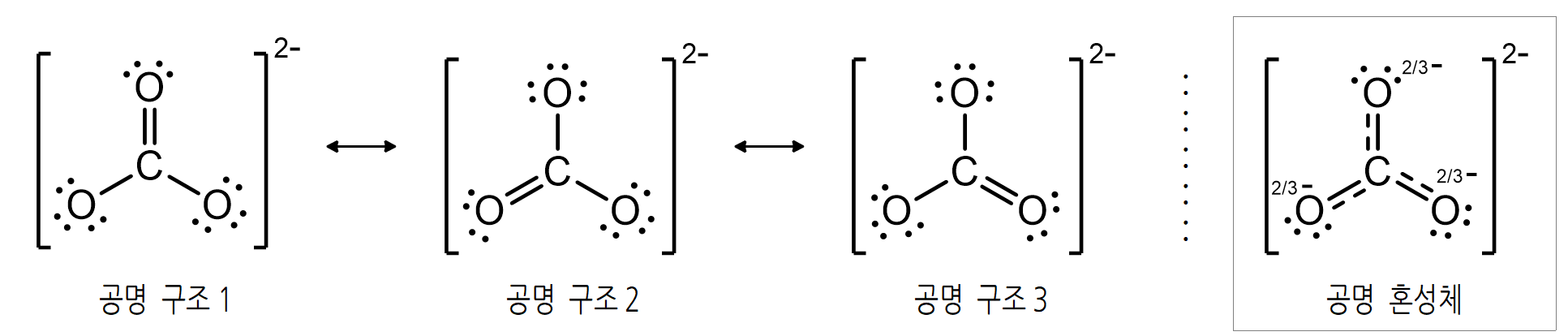
탄산 이온의 실제 구조는 위 <그림>에서의 공명 구조 1 ~ 3을 짬뽕하여 평균한 것에 가깝다. 그것이 <그림> 우측의 공명 혼성체(resonance hybrid)이다. 각각의 공명 구조가 1/3씩 적절하게 섞인 구조다.
분자의 구조를 종이 위에 표현하는 주된 이유가 실제 구조를 정확하게 묘사하기 위함이라면, 공명 혼성체와 같이 표현하는 것이 바람직하겠다. 하지만, 분자 내 전자 수나 결합 선 수 등을 파악하는데는 그다지 유용하지 않기 때문에 특정 공명 구조 하나를 대표하여 나타내는 경우가 일반적이다.
만약, 각각의 구조마다 공명 기여도가 다른 경우에는 비중이 달리 더해진 공명 혼성체가 된다. 물론, 공명 혼성체의 생김새는 기여도가 높은 구조의 모습과 닮아있다. 어찌되었건, 어떤 화합물이 공명 구조를 갖는다는 말은 실제 분자에 비편재화된 전자(셋 이상의 원자핵에 동시에 속박되어진 전자)가가 존재함을 의미한다.
2. 공명 구조 찾기
우선, 타당성 있는 루이스 구조식이 선행되어야 한다. 2주기 원소로 이루어진 화합물의 경우 옥텟 규칙을 만족하는 구조식을 바탕으로 함을 전제로 한다.
공명 구조는 다중 결합(π-결합)과 비공유 전자쌍의 위치만 변하게 할 뿐, 전체 구조의 기본 골격이 되는 단일 결합을 끊거나 위치를 바꾸지는 못한다. 핵의 위치가 고정되어 있으며, 전자의 분포만 달라질 수 있다고 생각하는 것이 편리하다. 따라서 아래 <그림>과 같이 각 원자 위치와 배열에는 변화 없이 전자쌍만 이리저리 이동한다.
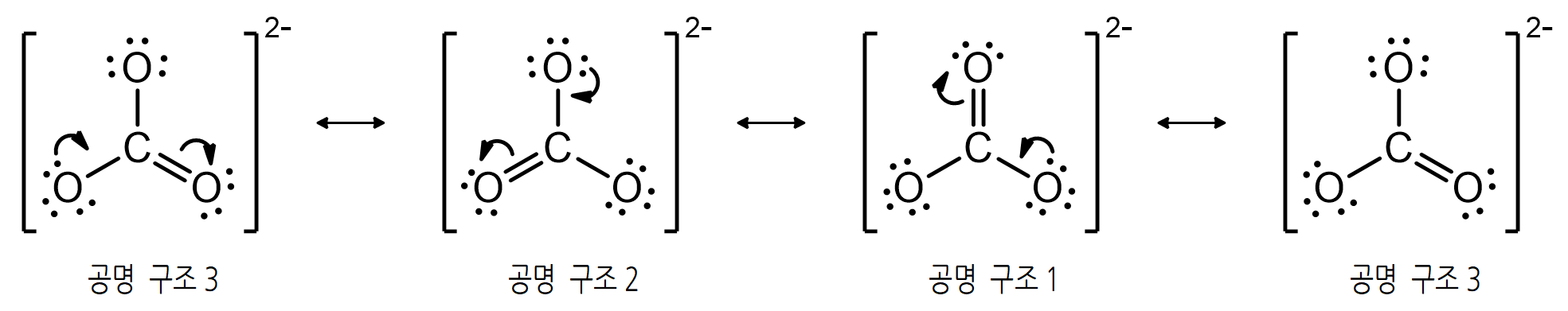
전자쌍 이동 과정에서도 분자 내 모든 원자들이 옥텟 규칙을 만족하는 상태가 유지되어야 하므로, 주변 산소의 비공유 전자쌍이 이중 결합 생성을 위해 안쪽으로 이동하는 과정에서 기존 이중 결합 전자는 밀려나며, 그 결합은 단일 결합으로 풀린다. 같은 과정을 몇 차례 반복하면, 초기 구조와 같아진다.
3. 공명 구조와 관련된 대표적인 오개념들
공명이라는 용어, 그리고 공명 구조 관계를 표현하기 위한 쌍방향 화살표(↔) 기호 때문에 마치 각각의 공명 구조가 서로 빠르게 왔다갔다하는 진동이 일어난다고 생각하는 경우가 있는데, 이는 '매우 잘못된 것'이다. 만약, 각각의 공명 구조를 빠르게 왔다갔다하는 것이라면, 결합 길이가 서로 다른 탄산 이온이 존재해야 하고, 관찰할 수 있어야 한다. 하지만 탄산 이온의 C-O 결합 길이는 모두 동등한 129 pm이다.
마찬가지로, 벤젠(Benzene, C6H6)이 두 가지 공명 구조를 빠르게 왔다 갔다 하는 것이라면, 특정 순간에 포착된 벤젠의 탄소-탄소 결합 길이는 133 pm의 C=C 이중 결합과 154 pm의 C-C 단일 결합 두 가지로 관찰되어야 할 것이다. 하지만 벤젠의 고리내 모든 탄소-탄소 결합 길이는 139 pm 뿐이다.
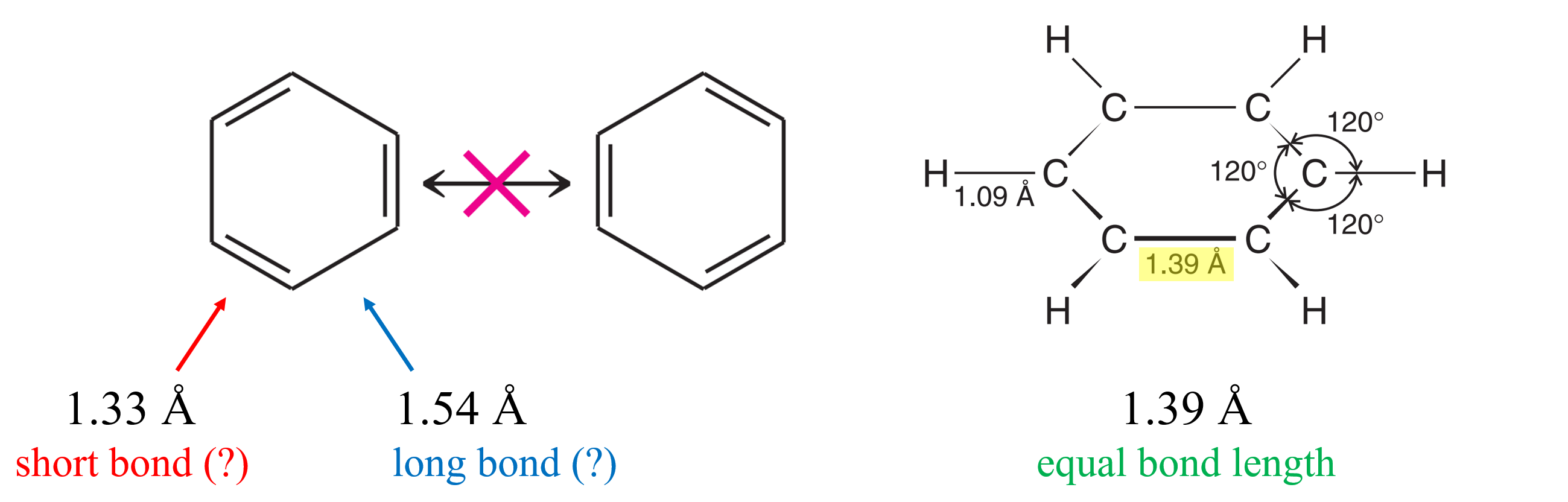
또한, 공명 개념을 분자를 회전시켰을 때, 동일한 구조가 나타나는 것들의 모임 등으로 이해하거나 각 구조 사이의 평형 상태로 이해하려는 경우가 있는데, 이 또한 잘못된 것이다. 공명 구조는 어떤 화합물의 실제에 가까운 구조를 표현하기 위해 고안된 이론적 개념일 뿐, 그러한 세부 구조가 실재하는 것이 아니다. 따라서 각각의 공명 구조를 구별하는 것은 의미가 없다.
[참고] Huheey 무기화학에는 다음과 같은 표현이 있다. "공명 혼성체는 가끔 노새(Mule)에 비유되기도 한다. 노새는 말과 당나귀 사이의 잡종이다. 노새는 노새이지, 말과 당나귀 사이를 공명하지 않는다. 마치 노새를 처음보는 사람에게 노새를 설명하기 위해서 수탕나귀 사진과 암말 사진을 동시에 보여준 것과 같다."
다만, 각각의 공명 구조 기여도가 다를 때는 어떤 구조가 실제 구조에 크게 기여할 것인지를 예측하고, 따져보는 행위에는 나름의 의미가 있다.
이제 정리해보자.
1) 표현된 각각의 공명 구조는 분자나 이온의 구조를 정확하게 대변하는 실제 구조가 아니다. 실제 구조에 가깝게 나타내기 위해서는 공명 혼성체 형태로 표현되어야 한다.
2) 공명 구조는 전자 이동에 의한 평형 구조(두 구조가 공존)가 아니다. 각 구조 사이 전자 이동을 화살표로 나타낸 것은 루이스 구조식 속에서의 전자 배치를 이해하기 위함일 뿐, 전자들이 실제로 이동하면서 두 구조를 진동한다는 뜻은 아니다.
3) 공명 구조는 전자의 배열만 달리 표현된 것이므로, 각각의 구조는 (당연히) 서로 이성질체 관계가 아니다.
공명 구조
-끝-
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 오스트발트 희석률 (Ostwald dilution law) (1) | 2022.10.23 |
|---|---|
| 약산의 pH 구하기 (3) | 2022.10.13 |
| 화학사 이야기 - 루이스 구조식과 옥텟 규칙 (2) | 2022.09.29 |
| 플라스틱 종류별 적외선 스펙트럼 (9) | 2022.09.14 |
| 혼성 오비탈 : 분자의 결합과 구조를 설명하는 효과적인 방법 (0) | 2022.08.11 |



