화학 결합과 거리에 따른 에너지 변화
0. 들어가기
<화학 결합 단원에 대한 개인적인 이야기>
2009 개정 교육과정 화학1의 세 번째 단원명은 "아름다운 분자 세계"이다. 새롭게 개정된 2015 교육과정에서는 "화학 결합과 분자의 세계"이다. 교육과정은 바뀌었지만 다루는 내용은 큰 차이가 없다. 결합의 형성과 그 결과물로 생성된 분자의 구조에 대해 주로 다룬다.
단원명만으로 학습 내용을 파악하기에는 이번 교육과정이 명확하지만, 해당 단원을 가르칠 때, 간접적으로 내 마음을 표현해준 것은 2009 개정 교육과정이다. 원자가 다른 어떤 원자에 이끌려 분자를 이룬다는 사실이 너무나 아름답다. 수업 시간에 이런 이야기를 하면, 아이들은 나를 이해할 수 없다는 듯이 웃는다. (벤젠 고리가 막~~ 연결되어 있는 복잡한 구조 보면 누구나 막~~ 설레고 그러지 않나?)
개인적으로 가장 좋아하는 단원이 화학 결합이다. 서로 무관했던 두 입자가 서로에게 끌려 점점 가까워지다가 적정 거리를 유지하며, 하나의 단위체를 구성한다는 것이 너무나도 아름답다. 청첩장에 이런 문구를 넣으려다가 너무 당사자들끼리만 신나서 '화학화학'거리는거 같아 뺐었다.
결합은 학문에서의 화학과 물리를 조금이나마 구분해준다. 산소 원자는 그 자체로는 양성자 8개와 전자 8개를 갖는 전기적으로 중성인 입자에 지나지 않지만, 두 개의 산소 원자가 결합하여 만들어진 산소 분자(O2)는 인간 호흡에 필수적인 물질이며, 비로소 물질을 대표할 수 있는 성질을 갖게 된다. 물질의 성질을 갖게 하는 최소 단위가 바로 분자이고, 분자는 대부분 결합을 통해 만들어진다. 화학은 분자 단위 학문이다.
그렇다면, 왜? 원자는 각각 존재하지 않고, 모여서 결합을 형성하는 것일까? 너무나 식상한 대답일 수 있지만 결합한 것이 더 안정하기 때문이다. (미혼 친구들이 유부남에게 하는 "결혼의 장점이 뭐냐?"라는 질문에도 대부분 위와 같은 대답을 하는 이유도... 이 것밖에..?)
1. 화학 결합의 형성
원자는 전하를 띠는 입자들로 구성된다. 원자 중심에는 양 전하(+)의 핵이 있고, 그 주위에 음 전하(-)의 전자가 있다. 따라서 원자는 필연적으로 다른 원자와 '전기적'인 상호작용을 한다. 핵과 전자 사이 끌림, 전자와 전자 사이의 밀어냄, 핵과 핵 사이의 밀어냄 등이다. 이런 상호작용의 결과로 두 원자는 가까워지기도, 멀어지기도 한다.

물론, 멀어지지도 가까워지지도 않은 채, 일정 거리를 유지할 수도 있다. 두 원자가 일정한 거리를 유지하고 있을 때, 우리는 원자들 사이 결합(chemical bond)이 형성되었다고 한다.
따라서, 우리가 결합을 이해하기 위해서는 입자 사이의 상호작용을 파악해야만 한다. 상호작용은 '입자 간 거리'에 의존하고, 상호작용 결과에 따라 전체 에너지가 변한다. 이에 입자 간 거리에 따른 에너지 변화를 이해하는 것은 결합 이해를 위해 중요한 일이다.
1. 결합이 형성되었다는 것은 두 입자가 일정 거리를 유지하고 있다는 뜻이다. (결합 길이)
2. 결합이 형성되었다는 것은 원자 각각으로 따로 존재할 때보다 에너지적으로 안정하다는 뜻이다. (결합 에너지)
2. 거리에 따른 퍼텐셜 에너지의 변화
그래프(graph)란, 변수(x )와 변수(y ) 사이의 관계를 보여주는 자료이다. 그래프를 통해 파악하고자 하는 것은 변수들 사이 경향성이다. 따라서 본격적인 그래프 해석에 앞서 반드시 확인해야 할 것은 "무엇(변수1, x )과 무엇(변수2, y )의 관계를 나타낸 그래프인가?"이다. 이를 간과하면, 해석 과정에서 오류가 발생할 수 있다.

위 그림은 입자 간 '거리(x )'에 따른 퍼텐셜 '에너지(y )' 변화 그래프이다. 변수는 '거리(r )'와 '퍼텐셜 에너지(V )'이다. 그래프를 통해 알 수 있는 사실들을 정리해보자.
1) 두 입자가 무한히 멀리 떨어져 있는 경우, 즉 r → ∞인 경우에는 두 입자 사이에 아무런 상호작용이 존재하지 않는다. 이때의 에너지 값을 0 (---)으로 기준 잡았다. 따라서 두 원자가 각각 따로따로 존재할 때보다 불안정해지면, 퍼텐셜 에너지는 (+) 값을 갖고, 안정해지면 (-) 값을 갖는다.
2) 원자들은 정전기적 상호작용을 한다. 인력 상호작용은 퍼텐셜 에너지를 낮춰 안정화시키며, 반발력 상호작용은 퍼텐셜 에너지를 높여 불안정하게 만든다. 이 상호작용은 동시, 복합적으로 이루어진다.
3) 원자 간 상호작용(인력, 반발력)은 거리에 의존한다. 거리가 가까울수록(작은 r 값을 가질수록) 상호작용이 크게 나타난다. 상호작용에 의한 에너지(=힘*거리) 역시 거리에 의존한다.
4) 그래프의 모양은 아래로 움푹 파인 우물(well) 형태이다. 이는 원자 간 상호작용의 복합적인 결과이다. 전체 에너지 그래프(━)를 상호작용 종류에 따라 인력에 의한 에너지 그래프(---)와 반발력에 의한 에너지 그래프(---)로 분리하면, 다음과 같다.

5) 인력에 의한 에너지 그래프(---)는 입자 간 거리가 가까워질수록(←) 급격하게 (-) 방향(↓)으로 증가(안정화)하며, 반발력에 의한 에너지 그래프(---)는 입자 간 거리가 가까워질수록(←) 급격하게 (+) 방향(↑)으로 증가(불안정화)하는 모습을 보인다. 거리에 더 민감하게 영향받는 것은 반발력에 의한 에너지 그래프이다. (반발력에 의한 에너지 그래프가 더 급격하게 증가한다.)
6) 인력에 의한 '안정화 에너지'와 반발력에 의한 '불안정화 에너지' 차이가 '알짜 에너지'로 남는다. 차이에 해당하는 값들을 연결하면, 전체 에너지 곡선(total energy curve)이 그려진다.

7) 그래프의 극소점은 인력에 의한 '안정화 에너지'와 반발력에 의한 '불안정화 에너지' 차이가 최대가 되는 지점이다. 이 위치에 두 입자가 놓이면, 퍼텐셜적으로 가장 안정하다. 따라서 서로 더 가까워지려고도, 더 멀어지려고도 하지 않는다. 일정 거리를 유지하려 한다. 이어 설명하겠지만, 이 지점에 위치한 입자들에 작용하는 인력과 반발력의 크기가 같기 때문이다.
3. 거리-퍼텐셜 에너지 그래프의 기울기
물리에서 에너지(E )는 일(W )을 할 수 있는 능력으로 정의된다. 일(W )은 힘(F )과 힘이 작용하는 거리(r )의 곱으로 표현할 수 있다. 따라서 에너지(일)을 거리에 대해 미분하면, 힘에 대해 알 수 있다. 거리에 따른 퍼텐셜 에너지 그래프의 기울기에 대해 알아보자.

입자 간 작용하는 전기적인 힘의 크기는 입자 전하량 곱(Q1*Q2)에 비례하고, 거리 제곱(r 2)에 반비례한다. 전하의 종류가 다른 경우 인력(F < 0), 전하의 종류가 같은 경우 반발력(F > 0)이 작용한다.
입자 사이 작용하는 전기적인 힘(F )에 힘이 작용하는 거리(r )를 곱하면, 해당 거리에서의 퍼텐셜 에너지(V (r ))를 알 수 있다. 퍼텐셜 에너지(V (r ))와 퍼텐셜 에너지의 기울기(도함수, dV /dr )는 다음과 같다.

(a) 그래프 기울기(dV / dr ) < 0 - F 알짜 < 0 ⇒ F 알짜 > 0 (해당 지점에서 작용하는 반발력이 인력보다 우세)
(b) 그래프 기울기(dV / dr ) = 0 - F 알짜 = 0 ⇒ F 알짜 = 0 (해당 지점에서 작용하는 인력과 반발력의 크기가 같음)
(c) 그래프 기울기(dV / dr ) > 0 - F 알짜 > 0 ⇒ F 알짜 < 0 (해당 지점에서 작용하는 인력이 반발력 보다 우세)
한 지점에서 반발력보다 인력(attractive force)이 우세하면, 서로 이끌려 거리를 좁힐(←) 것이며, 반발력(repulsive force)이 우세하면 서로 밀어내어 점점 멀어질(→) 것이다. 인력과 반발력이 균형을 이룰 때, 입자는 그 지점에 머무르며, 일정한 거리를 유지한다. (결합의 형성)
이와 같이 거리-퍼텐셜 에너지 그래프 기울기는 해당 지점에서 우세하게 작용하는 힘의 종류와 알짜힘의 크기에 대해 알려준다.

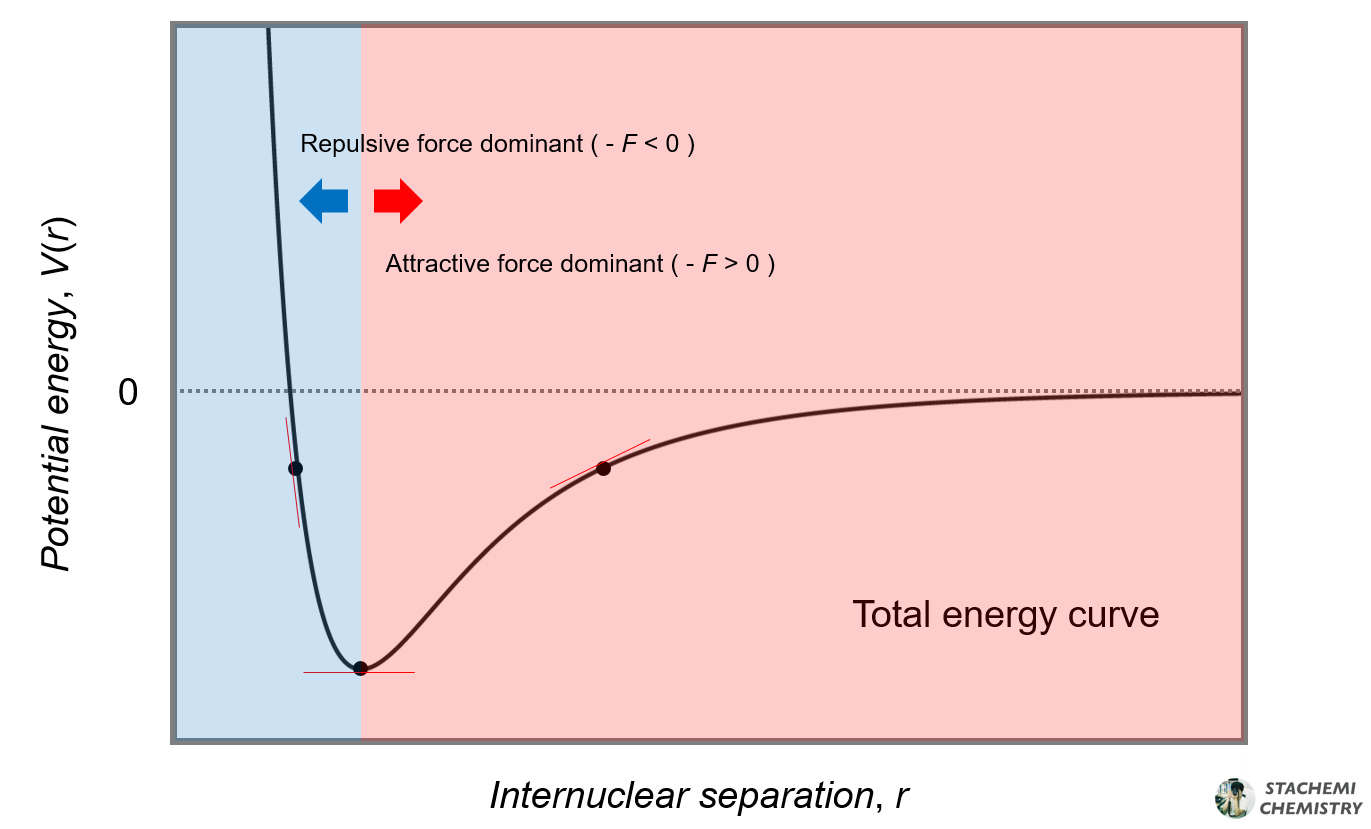
결합이 형성되는 그래프의 극소점(기울기 = 0)을 기준으로 우측 영역은 인력 지배적, 좌측 영역은 반발력 지배적이다. 두 입자에 작용하는 '힘'은 반드시 퍼텐셜 에너지 그래프의 '기울기'로 해석해야 한다. 정리하면,
1. 해당 지점에서 두 입자의 상호작용에 의한 퍼텐셜 에너지가 각각의 원자 상태일 때보다 안정한가? 불안정한가?를 판단할 때는 그래프의 y축 값이 0보다 작은가? 큰가?를 확인한다. y축 값이 0 보다 크면, 원자일 때보다 불안정, 0보다 작으면 안정하다.
2. 해당 지점에서 두 입자 사이에 작용하는 지배적인 힘이 인력인가? 반발력인가?를 판단할 때는 그래프의 기울기 값이 0보다 큰가? 작은가?로 판단한다. 기울기가 0보다 작으면 반발력, 기울기가 0보다 크면 인력이 우세하다.
3. 많이 헷갈려하는 부분이 <그림 4>의 (a) 지점이다. 이 지점에 강제로 두 입자를 놓아두면, 각각의 개별 원자 상태로 존재할 때보다 퍼텐셜 에너지적으로 안정하긴 하지만, 두 입자 사이에 알짜힘으로 반발력이 우세(기울기<0)하여 입자 간 거리가 멀어진다. 언제까지? 알짜힘이 0이 될 때까지, 기울기가 0이 될 때까지 멀어진다.
4. 결합 길이와 결합 에너지
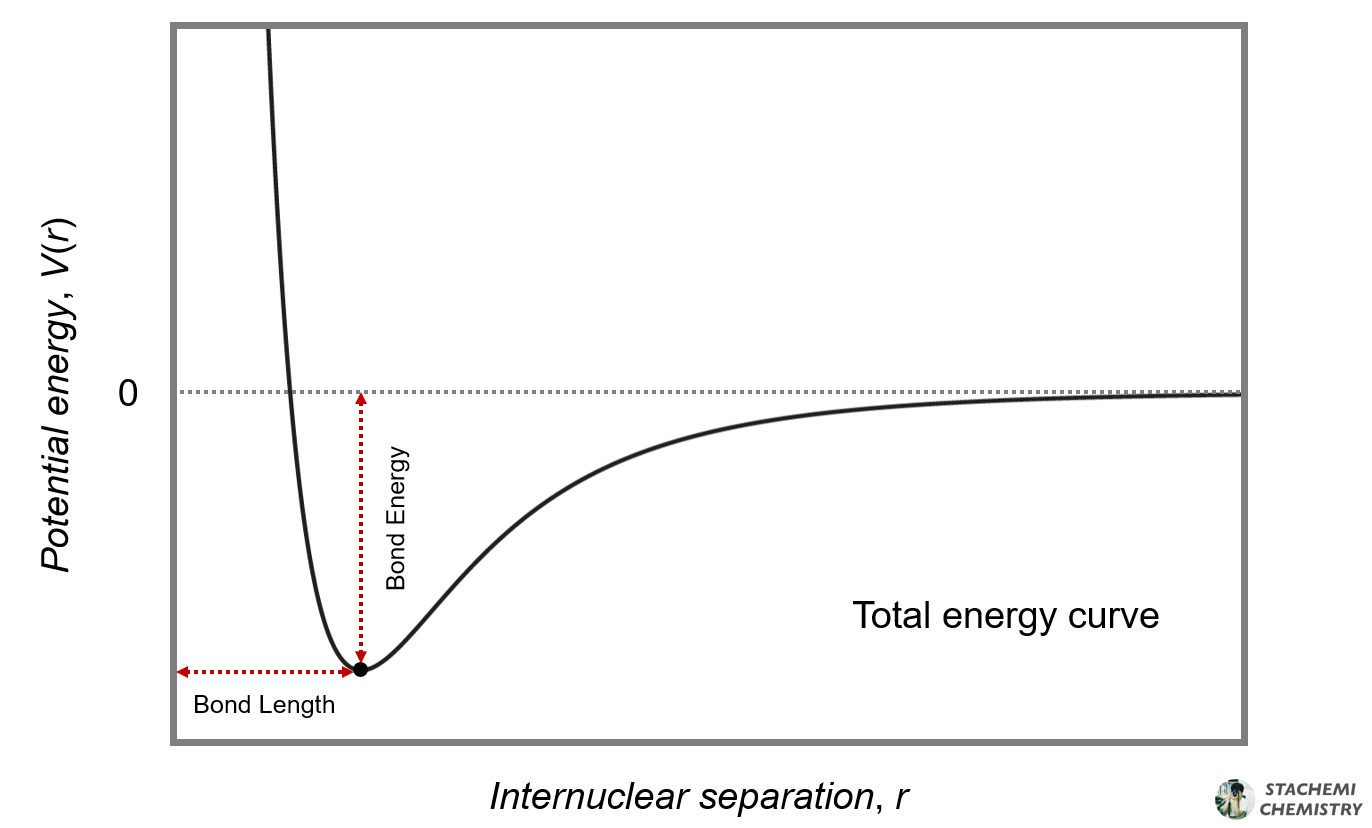
인력과 반발력이 균형을 이루는 지점에서 입자는 더 이상 가까워지지도, 멀어지지도 않으며, 일정 거리를 유지한다. 해당 지점은 상호작용을 통한 퍼텐셜 에너지 값이 극소가 되며, 안정화가 최대가 되는 지점이다.
이 지점에서의 입자 사이 거리를 결합 길이(bond length)라 하며, 안정화된 정도를 결합 에너지(bond energy)라 한다. 예를 들어 수소 분자(H2)의 결합 길이는 74 pm, 결합 에너지는 436 kJ/mol이다. 2 몰의 수소 원자로 각각 존재할 때보다 1 몰의 수소 분자를 형성했을 때, 436 kJ 만큼 안정해진다.
두 원자가 정전기적인 상호작용을 통해 결합을 형성한다. 마치 거리에 따른 에너지 그래프 위에 구슬을 올려놓았을 때, 그래프의 기울어진 정도에 따라 구슬이 자연스럽게 굴러가다가 최종적으로 머무는 곳에서 결합이 형성된다고 할 수 있다. 구슬의 출발 위치는 무관하게 결국 우물의 가장 낮은 지점에서 발견될 것이다.
* 화학 결합과 거리에 따른 에너지 변화
- 끝 -
* 긴 글 읽어주셔서 감사합니다. 내용 중 오타나, 설명 과정에서의 오류 등을 찾으신 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리도록 하겠습니다.
* 2020-10-20 : 문단 3의 그래프 기울기(a) 오타 수정, 문단 3의 결과 정리표 내용 추가
* 2022-09-04 : 사용 중인 학습지 링크를 첨부합니다. https://stachemi.tistory.com/273
고등학교 화학1 - 3-1-1. 화학 결합의 형성
현재 학교에서 사용하고 있는 학생용 학습지 일부입니다. 학교에서 사용하는 교과서는 천재교육(2015)이지만, 전체적인 단원 구성에는 출판사별 차이가 없기에 다른 교과서에도 활용 가능하리라
stachemi.tistory.com
* 2022-09-07 : 거리에 따른 입자 사이 알짜힘의 크기 변화와 퍼텐셜 에너지 변화 그래프 추가

'화학 > 화학이야기' 카테고리의 다른 글
| 프랭크-콘돈 원리 (Franck-Condon Principle) (24) | 2020.09.25 |
|---|---|
| 용액의 농도 : 원하는 농도의 용액 만들기 (12) | 2020.09.13 |
| 자유에너지와 화학 평형의 위치 (46) | 2020.08.22 |
| 아레니우스에 대한 모든 것 (4) | 2020.08.16 |
| 투광도와 흡광도 사이 로그 관계가 성립하는 이유 (0) | 2020.08.05 |



