원자가 껍질 전자쌍 반발 이론
Valence Shell Electron-Pair Repulsion Theory
0. 들어가기
칠판에 제목을 쓰는데 한참이다. "원자가 껍질 전자쌍 반발(VSEPR) 이론". 그리고 최대한 꼬불랑 거리며, 영어로 한번 읽어준다. 밸러~언스 쉐~엘 일렉트런 페얼 리퍼~얼젼 띠어리.
끊어지지 않는 긴 영단어에 학생들이 "오~~~~~"하며, 반응을 보이지만, 표정은 무언가 애매하다. 길고 복잡한 이름에서 오는 알 수 없는 거리감에 약간 겁을 먹은 것 같다. 교과서에는 간단하게 전자쌍 반발 이론이라고 쓰여있다.
VSEPR 이론은 원자가 결합 이론(VBT)에서 분자의 3차원 구조, 즉, 분자가 어떤 모양으로 공간을 차지하는지를 설명하기 위한 이론(모델)이다.
달리 말해, 루이스 구조식이 분자 구조를 종이 위에 2차원으로 나타낸 것이라면, VSEPR 이론은 종이 위에 표현된 2차원 구조로부터 3차원 구조를 상상하게끔 도와주는 이론이라 할 수 있다.
[참고] 루이스 구조식은 원자들이 갖는 원자가 전자 개수를 파악하고, 원자 간 연결 형태(결합)를 확인하는데 매우 효과적이지만, 3차원 구조에 대한 정보는 주지 못한다. VSEPR 이론은 이런 점을 보완해줄 수 있으며, 중심 원자의 전자쌍의 수와 종류로 기하구조 판단이 가능하다는 점에서 매우 유용하다.

1. 원자가 껍질 전자쌍 반발 이론 (VSEPR Theory)
VSEPR 이론은 영국의 화학자 네빌 시즈윅(Nevil Vincent Sidgwick, 1873-1952)과 허버트 파월(Herbert Marcus Powell, 1906-1991)이 제안하였으며, 캐나다의 화학자 로널드 길레스피(Ronald James Gillespie, 1924-2021)와 호주의 로널드 니홀름(Ronald Sydney Nyholm, 1917-1971)에 의해 발전되었다. 길레스피와 니홀름의 이름을 따서 Gillespie-Nyholm Theory라고 부르기도 한다.

기본적으로 음전하를 띠는 전자쌍들이 서로 강하게 반발할 것이기 때문에 전자쌍들이 최대한 멀리 떨어지게끔 공간 배열을 갖는 것이 가장 안정할 것이라는 생각에서 출발한다. 전자쌍들 사이의 반발이 최소화되는 구조가 안정한 공간 구조(배치)라는 뜻이다.
<생각의 배경>
중심 원자의 원자가전자 쌍들은 서로 반발하므로, 반발을 최소화하기 위해 최대한 서로가 멀리 떨어지는 배치를 가질 것이다.
따라서 VSEPR 이론에서는 중심 원자 주위에 존재하는 전자 쌍 개수에 따라서만 입체 구조가 결정된다고 믿으며, 주변 원자들의 작은 뒤틀림이나 결합각 등에는 영향을 줄 수 있을지언정, 전체 구조를 바꿀 수는 없다고 생각한다.
중심 원자가 갖는 전자쌍 개수를 입체수(steric number, SN )라 하며, 입체수에 따라 직선형(Linear, SN = 2), 삼각평면형(trigonal planar, SN = 3), 정사면체형(tetrahedral, SN = 4), 삼각쌍뿔형(trigonal bipyramidal, SN = 5), 정팔면체형(octahedral, SN = 6)로 구분된다.
고등학교 교육과정에서는 입체수 4, 대학교 일반화학 수준에서는 입체수 6까지 다루는 것이 일반적이며, <그림 2>와 같이 풍선을 통해 설명하면 쉽게 이해할 수 있다.

중심원자의 전자쌍 사이 반발은 여러 개의 풍선 주둥이를 한 곳에 묶어두려는 것에 비유할 수 있다. 풍선 2개를 묶으면, 서로 180도 각도로 반대 방향을 향하며, 직선 구조가 된다. 풍선을 3개, 4개 점점 많이 묶을수록 풍선 사이 거리는 가까워지고 모양도 삼각 평면형, 정사면체형으로 변하면서 풍선들이 만드는 각도도 좁아진다. 직선형 배치에서 180도였던 풍선 사이 각도가 삼각평면형에서 120도, 정사면체형에서는 109.5도로 변한다.
입체수 1 ~ 6에 따른 구조와 결합각은 <그림 3>와 같이 정리될 수 있다.

참고로 입체수 5와 6의 경우, 중심 원자 주위에 8개 이상의 전자쌍이 존재해야 하는데, 중심 원자가 2주기인 경우 최대 8개의 전자까지만 채워질 수 있기에(옥텟 규칙) 불가능한 구조이지만, 중심 원자가 3주기 이상인 경우에는 비어있는 d-오비탈을 활용하여 옥텟 규칙의 확장(최대 18전자까지)이 일어날 수 있기에 입체수 5, 6을 갖는 분자들도 가능한 것이다.
2. 전자쌍 종류에 따른 반발력 차이
아래 <그림 4>의 메테인(CH4)과 암모니아(NH3)의 중심 원자인 탄소와 질소 주위에는 4 쌍의 전자쌍이 있다. 따라서 입체수는 4로 같은데, 탄소와 질소가 완전 동일한 상황에 놓여있다고 보기는 조금 어렵다. 메테인의 탄소(C)는 전자쌍 4개가 모두 공유(결합) 전자쌍으로 구성되었지만, 암모니아의 질소(N)는 3개의 공유 전자쌍과 1개의 비공유 전자쌍을 갖기 때문이다. 공유 전자쌍과 비공유 전자쌍 차이에 따른 구조의 변화는 없을까?

만약, 공유 전자쌍과 비공유 전자쌍이 차지하는 공간과 반발 정도가 똑같다면, 우리가 입체수로 예측한 기하 구조에 전혀 영향을 주지 않을 것이다. (분자 내에서 공유 전자쌍과 비공유 전자쌍을 전혀 구분할 수 없다면,)
하지만, 다음 <그림 5>와 같이 공유 전자쌍과 비공유 전자쌍은 기본적으로 공간의 퍼짐 정도, 분포, 생김새가 확연히 다르다. 따라서 전자쌍끼리의 반발 정도에도 차이가 있을 수밖에 없다.
반발력 차이 발생의 근본적인 이유는 "전자쌍이 영향 받는 핵의 수"로부터 찾을 수 있다.
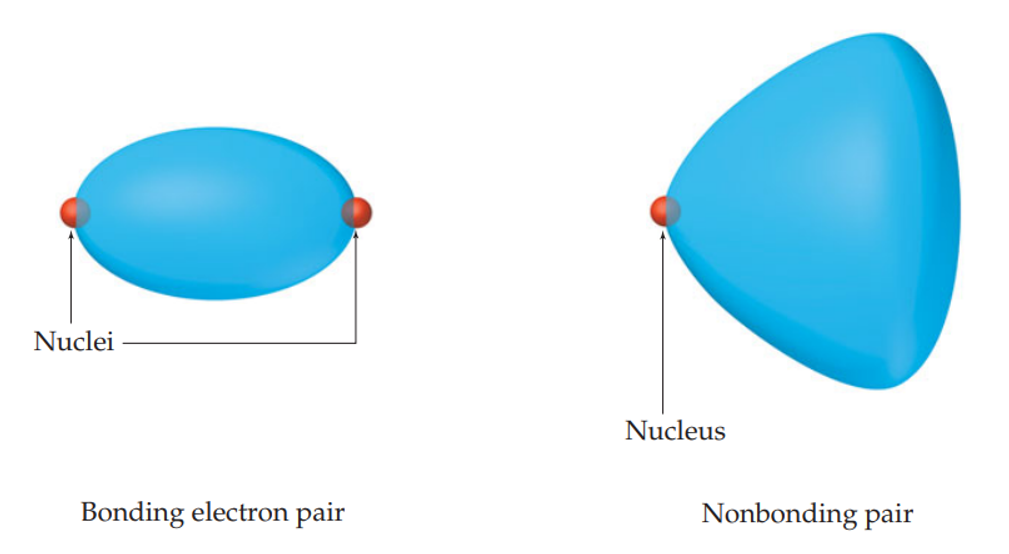
전자쌍은 핵과 상호작용하고 있으며, 핵에 전기적으로 묶여 자유롭지 못한 상태이다. 공유 전자쌍이 양쪽 핵 모두에게 영향받고 있다면, 비공유 전자쌍은 한쪽 핵에만 영향받고 있다고 할 수 있다. 아무래도 두 핵 모두에 영향받는 전자의 분포(퍼짐)가 제한적일 수밖에 없다.
이에, 공유 전자쌍(bonding pair, bp)은 양쪽 핵 사이 비교적 좁고 긴 형태로 분포하지만, 비공유 전자쌍(lone pair, lp)은 영향받는 핵과 멀어질수록 상대적으로 넓고 뚱뚱해지는 분포의 모양을 갖는다. 비공유 전자쌍이 차지하는 공간이 공유 전자쌍에 비해 넓다고 할 수 있다.
수업 시간에는 소풍이나 수학여행 자유시간에 학생들이 자유롭게 (미쳐 날뛸 수 있는) 활동할 수 있는 반경으로 비유하곤 한다. 학생들이 학교에서 가장 무서워하는 선생님 두 명의 이름을 예로 들어, 핵이라고 설명하면 감정이입을 제대로 하여 전자분포의 제한을 빨리 받아들이는 것 같다.
따라서 전자쌍 종류에 따른 반발 정도를 비교하면 다음과 같다. 차지하려는 공간이 큰 전자쌍끼리의 반발이 당연히 크다.
비공유(lp)-비공유 전자쌍(lp) 반발 > 비공유(lp)-공유 전자쌍(bp) 반발 > 공유(bp)-공유 전자쌍(bp) 반발
3. 결합각과 분자의 모양
결합각(bond angle)은 중심 원자핵과 주변 원자핵을 연결하여 만들어지는 사이각을 말한다. 결합각이 정의되기 위해서는 세 개의 원자핵과 두 개의 결합이 필요하다. 중심 원자 A와 2 개의 B 원자로 이루어진 AB2 형태의 분자에서의 결합각은 다음과 같이 표현된다.

<그림 6>의 첫번째 그림을 보면, 주변 원자 B와 중심 원자 A가 이루는 결합각 ∠BAB는 180도를 갖지만, 두 번째 그림은 180도 보다 작은 각도를 갖는다. 첫 번째 분자의 모양을 직선형 구조(linear)라 한다면, 두 번째 분자는 굽은 구조(bent)이다.
4. 다중 결합이 분자 구조에 미치는 영향
CO2의 루이스 구조식을 살펴보면, 탄소 주변에 전자쌍은 총 4 쌍이다. 중심 탄소는 두 개의 산소 원자와 결합하며, 각각의 산소 원자와 이중 결합을 하고 있다. 그렇다면, 이중 결합과 같은 다중 결합은 분자의 구조에 어떤 영향을 미칠까? CO2에서 중심 탄소의 입체수는 4일까?

결론부터 말하면, CO2의 중심 탄소 입체수는 2이며 "입체수를 바탕으로 분자 구조를 따져줄 때 다중 결합은 하나의 결합(단일 결합)으로 취급"한다. CO2는 직선형 구조이다.
폼알데하이드(HCHO) 구조를 살펴보자. 중심 원자인 탄소 주위에 총 4 쌍의 공유 전자쌍이 있지만, 카보닐(C=O) 그룹의 이중결합은 두 전자쌍이 반드시 같은 방향을 향하고 있으므로, 중심 원자의 전체 전자쌍은 세 방향만으로 배치되고 입체수는 3이라고 할 수 있다. 이렇게 예측된 HCHO의 구조는 평면 삼각형(Trigonal planar)이다.
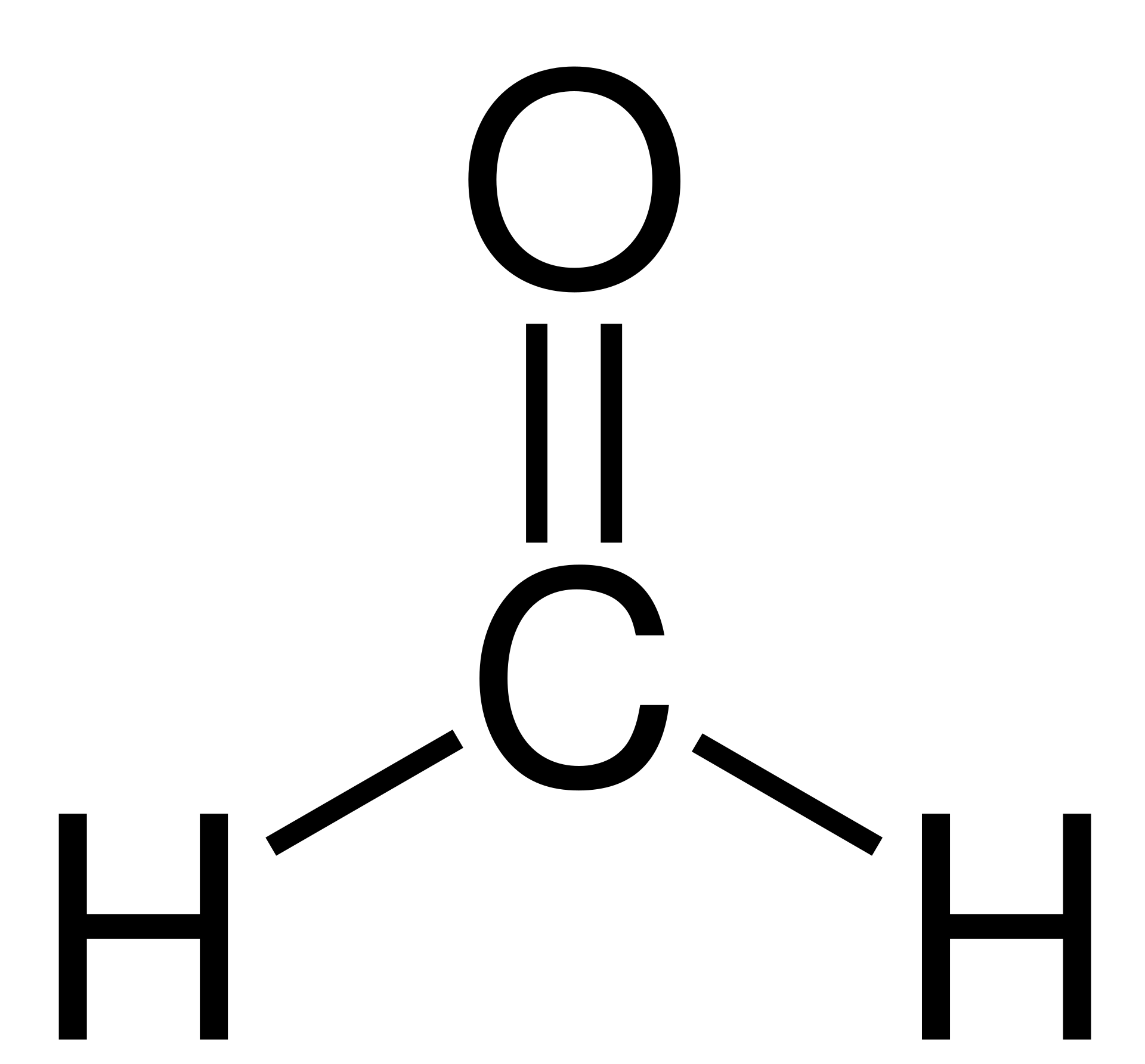
추가로 폼알데하이드의 결합각도 살펴보자.
수소-탄소-산소 사이 결합각(∠HCO)이 122 도인 반면, 수소-탄소-수소 사이 결합각(∠HCH)가 116도로 균일한 120도 각도를 갖지 않는다. 이는, 이중 결합이 단일 결합에 비해 비교적 짧고 많은 수의 전자가 분포하여 보통의 단일 결합 전자쌍보다 강하게 반발하고, 넓은 공간을 차지하기 때문이다.
5. AXE 표현으로 알아본 분자의 기하 구조
비공유 전자쌍과 공유 전자쌍이 서로 차지하는 공간이 다르고, 반발하는 정도도 다르기 때문에 중심 원자의 입체수가 같더라도, 기하 구조와 결합각에 차이를 가질 수 있다.
메테인(CH4), 암모니아(NH3), 물(H2O)의 중심원자는 모두 입체수 4로 같지만, 전자쌍의 종류와 조합을 따져주면 처한 환경이 다르다. 메테인의 탄소는 공유 전자쌍 4개, 암모니아의 질소는 공유 전자쌍 3개, 비공유 전자쌍 1개, 물의 산소는 공유 전자쌍 2개, 비공유 전자쌍 2개이다.


이를 간편하게 나타낼 수 있는 방법이 AXE 표현이다. (정식 명칭인지는 잘 모르겠지만, 대부분의 책에서 ABE 또는 AXE 형태로 분류하고 있다.) A는 중심 원자, X는 결합 전자쌍(공유 전자쌍), E는 비공유 전자쌍을 뜻하며, 아랫첨자로 개수를 나타낸다.
AXE 표현으로 메테인, 암모니아, 물을 나타내 보면, 다음과 같다.
CH4 = AX4 , NH3 = AX3E1 , H2O = AX2E2
AXE 표현은 얼핏 화학식과 비슷한 면이 있지만, 중심 원자 전자쌍 종류와 개수를 직관적으로 알 수 있다는 장점이 있다. X와 E의 아랫첨자 값을 더하면 중심 원자의 입체수가 되며, 같은 입체수에서 비공유 전자쌍 수(E)의 비율이 높아질수록 결합각이 줄어듦을 알 수 있다.
입체수, AXE 조합에 따른 입체수별 구조는 다음과 같다.

원자가 껍질 전자쌍 반발 이론 (VSEPR Theory)
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
[관련된 글] 입체수 5인 분자의 구조 선택성(291)
입체수 5인 분자의 구조 선택성
[관련 글] 282. 원자가껍질 전자쌍 이론 (VSEPR) 원자가 껍질 전자쌍 반발 이론 (VSEPR Theory) 원자가 껍질 전자쌍 반발 이론 Valence Shell Electron-Pair Repulsion Theory 0. 들어가기 칠판에 제목을 쓰는데 한참이
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| 고등학생을 위한 적외선 분광법 : (2) 작용기와 스펙트럼 기초 (2) | 2022.12.07 |
|---|---|
| 매우매우 묽은 강산 수용액의 pH 구하기 (2) | 2022.11.18 |
| 오스트발트 희석률 (Ostwald dilution law) (1) | 2022.10.23 |
| 약산의 pH 구하기 (3) | 2022.10.13 |
| 공명 구조와 관련된 대표적인 오개념들 (15) | 2022.10.08 |



