[관련 글]
233. 계와 내부 에너지 : stachemi.tistory.com/233
계와 내부 에너지 (System & Internal Energy)
계와 내부 에너지 System & Internal Energy 1. 계와 주위 열역학(Thermodynamics)에서는 에너지의 전환에 관심 갖는다. 화학에서는 물질 변화 과정에서 에너지는 어떻게 관여하고, 달라지는지에 대해 알고
stachemi.tistory.com
236. 엔탈피 : stachemi.tistory.com/236
엔탈피 (Enthalpy)
[이전 글] 233. 계와 내부 에너지 계와 내부 에너지 (System & Internal Energy) 계와 내부 에너지 System & Internal Energy 1. 계와 주위 열역학(Thermodynamics)에서는 에너지의 전환에 관심 갖는다. 화학에서..
stachemi.tistory.com
열용량 (Heat capacity)
1. 온도 변화와 열용량
반응을 진행시킨 후 온도 변화(ΔT )를 측정하면, 반응 과정에서 발생한 열량(Q )을 알 수 있다. 온도 변화를 통해 열량을 계산하기 위해서는 열용량이 필요하다. 열용량(heat capacity, C )이란, '특정 물질의 온도 1 K 을 상승시키기 위해 필요한 에너지의 양'으로, 단위는 [J/K]이다.
C = Q / ΔT
온도 변화를 위해 많은 에너지가 필요한 물질일수록 열용량이 큰 물질이다. 열용량이란, 물질이 공급받은 에너지를 품고 있는 능력이라 할 수 있다. 물(H2O)은 대표적인 열용량이 큰 물질이다. (어쩐지, 라면 먹고 싶어 현기증이 나는데, 물은 빨리 안 끓더라...)
"열용량이 크다는 것은, 가열해도 온도가 쉽게 변하지 않는다는 뜻이다."
같은 물질이라도 절대적인 양이 많아지면, 온도 상승을 위해 필요한 열량도 많아진다. 라면 끓일 때, 물 양이 많을수록 시간이 오래 걸리는 것도 같은 이유다. 열용량은 물질 양에 의존하는 물리량이다.
이렇게 양에 의존하는 성질을 크기 성질(extensive property)이라 한다. 물질 양을 1 g 또는 1 몰로 기준잡는다면, 그램당 열용량, 몰당 열용량으로 나타낼 수 있다. 이제 물질 양에 무관한 세기 성질(intensive property)이 되었다.
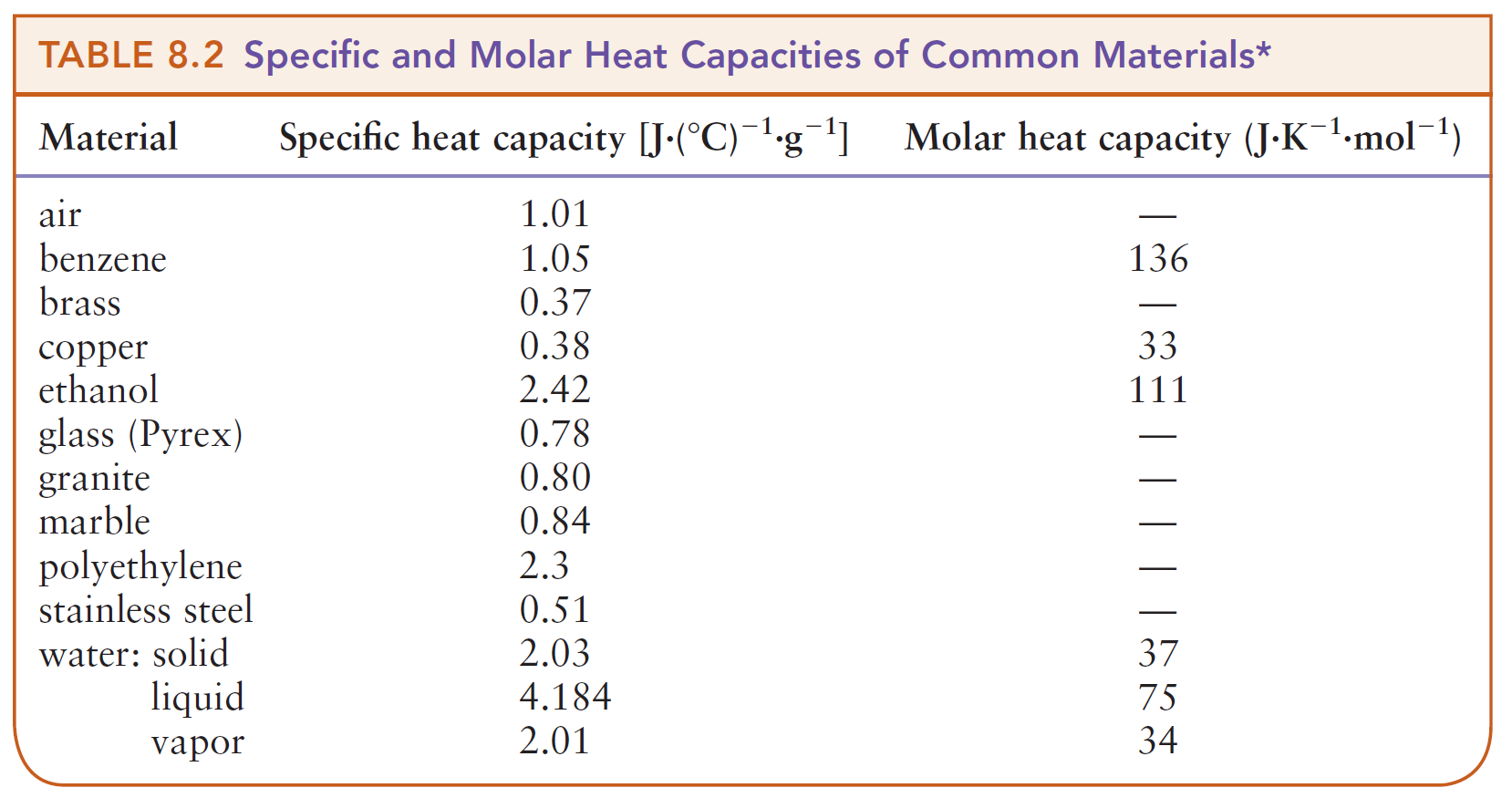
우리가 중학교 과학 시간에 접했던 개념인 비열(specific heat, c)이 바로, 물질 1 g 당 열용량 [J/g·K]이다. 물질 양을 1 몰 기준으로 했을 때의 열용량 [J/mol·K]은 이름 그대로, 몰 열용량(molar heat capacity, cm)이라 한다.
Q = c ×m ×ΔT = C ×ΔT = n ×cm ×ΔT
c = 비열 , cm = 몰열용량
2. 정적 열용량, 정압 열용량
그렇다면, 물질의 열용량은 언제나 일정한 값을 가질까? 그렇지 않다.
열용량은 물질의 온도(T )나 압력(P ) 등에 따라 달라진다. 10 ℃의 물과 90 ℃의 물의 온도를 1 ℃ 상승시키기 위해 필요한 에너지 양은 다르다. 목표 온도 변화(ΔT )는 1 ℃ 로 같지만, 해당 온도에서 물질이 갖는 열용량(C ) 값이 다르기 때문이다.
세부적으로 살펴보면, 물질이 가열되는 조건이 일정 부피 조건(ΔV = 0, 등적)인지, 일정 압력 조건(ΔP = 0, 등압)인지에 따라서도 열용량 값은 달라진다.
정리하자면, 10 ℃ 물을 일정-부피 조건에서 가열하는지, 일정-압력 조건에서 가열하는지, 90 ℃ 물을 일정-부피 조건에서 가열하는지, 일정-압력 조건에서 가열하는지에 따라 1 ℃ 상승시키는데 필요한 에너지 양이 모두 다르다는 뜻이다.
[참고] NIST Chemistry WebBook, SRD 69 : Isobaric properties for water


일정-부피 조건에서의 열용량을 정적 열용량(Cv), 일정-압력 조건에서의 열용량을 정압 열용량(Cp)이라 한다. 열용량 기호 C 옆에 아래 첨자로 나타낸 기호 v 와 p는 각각 부피(volume, v )와 압력(pressure, p )이 일정함을 뜻한다.
Qv = Cv × ΔT = n × cv,m × ΔT
Qp = Cp × ΔT = n × cp,m × ΔT
3. 정적 열용량과 내부 에너지
부피가 일정하다는 것은 무엇을 의미할까? 이상 기체가 채워진 강철 용기를 가열하는 장면을 상상해보자.
외부로부터 열에너지가 지속적으로 공급되고 있으므로, 강철 용기 내부의 기체 에너지는 점차 증가한다. 하지만, 강철 용기는 내부의 기체가 부피 팽창의 형태로 일하는 것을 허용하지 않는다. 다시 말해 공급 받은 에너지는 일(work)의 형태로 전환될 수 없다. 오직, 기체의 운동 상태만 활발하게 만들 뿐이다. 기체 운동 상태가 점차 활발해진다는 것은 계의 온도가 점차 상승한다는 뜻이다. 계의 내부 에너지 변화가 곧 온도 변화로 나타난다.
외부로부터 공급된 에너지(Qv ) = 계의 내부 에너지 변화(ΔU ) → 계의 온도 변화 (ΔT = Qv / Cv)
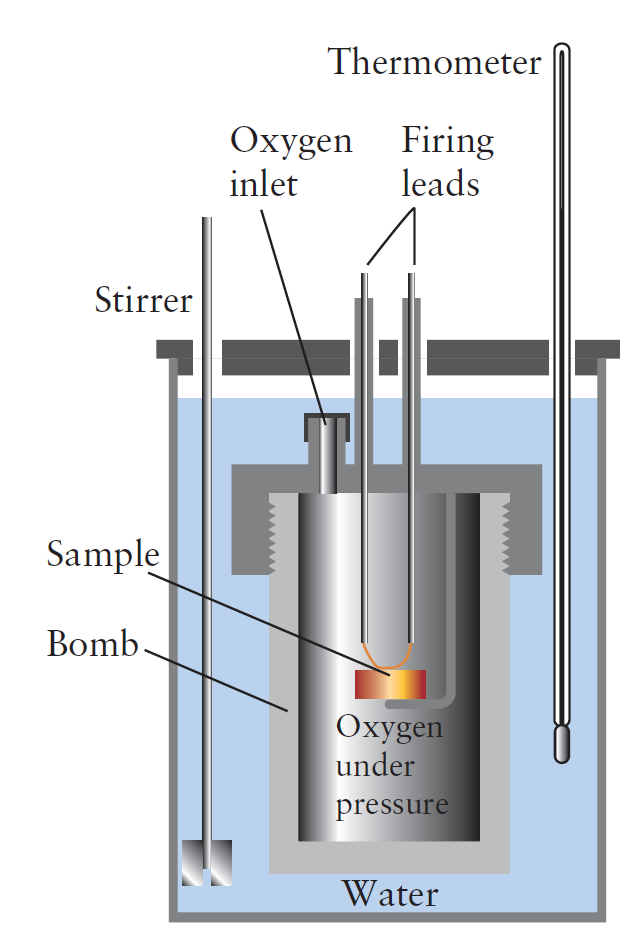
하지만, 물질마다 열용량이 다르기 때문에 모든 물질에 같은 에너지를 공급한다고 해서 같은 온도 변화가 나타나는 것은 아니다. 물질이 갖는 열용량의 차이에 따라 온도 변화의 정도가 다르다. 어쨌든, 일정 부피 조건에서는 공급된 에너지 전부가 온도 변화에만 사용되므로, 온도 변화를 통해 내부 에너지 변화를 알 수 있게 된다. 이것이 통 열량계(봄베 열량계)의 원리이다.
Qv = ΔU = Cv ΔT = n cv,m ΔT
4. 이상 기체의 등적 / 등압 열용량
이상 기체(ideal gas)는 입자 간 상호작용이 없는 기체를 말한다. 입자 간 상호작용이 없는 이상 기체로 구성된 계(system)의 에너지는 기체 운동에 의한 에너지만을 고려하면 되기 때문에 비교적 단순한 접근이 가능하다.
U = Etotal = Etrs + Erot + Evib (이상 기체 조건)
만약, 이상 기체를 이루는 물질 입자가 '단원자' 기체라면, 분자 내 결합에 의해 나타나는 회전 운동(Erot)이나 진동 운동(Evib)에 의한 에너지를 고려할 필요가 없다. 그저 기체의 병진 운동에 의한 에너지(Etrs)가 그 계의 고유한 전체 에너지, 내부 에너지(internal energy, U )가 된다.
단원자 이상 기체 하나의 병진 운동 에너지는 기체 분자 운동론의 에너지 등분배 법칙에 의해 다음과 같이 나타낼 수 있다.
U = Etotal = Etrs = 3/2 kBT (단원자 이상 기체 입자 1개, kB = 볼츠만 상수)
단원자 이상 기체 '1 mol'의 전체 에너지(병진 운동 에너지)는 '아보가드로 수(NA)'를 적용하여 나타낼 수 있으며, 이 과정에서 우리에게 친숙한 '기체 상수(gas constant)' 개념이 등장한다.
U = Etotal = 3/2 NAkB T = 3/2 RT (R = NA×kB)
따라서, 1 mol 단원자 이상 기체의 온도를 T1 → T2로 변화시키는 과정에서의 내부 에너지 변화는 다음과 같이 나타낼 수 있다.
ΔU = 3/2 RΔT = 3/2 R(T2 - T1)
계를 구성하는 기체 입자가 n mol 이라면, 온도 변화에 의한 내부 에너지 변화는 다음과 같다. 이를 달리 말하면, 해당 내부 에너지 변화만큼의 에너지가 외부에서 공급되어야 계의 온도가 T1에서 T2로 변한다는 뜻이다.
ΔU = 3/2 nRΔT
그런데, 우리는 앞선 파트에서 일정-부피 조건(ΔV = 0)에서 계에 공급된 에너지(Qv)는 내부 에너지 변화(ΔU )와 같다는 사실과, 공급된 에너지 모두 온도 변화(ΔT )로 나타난다는 사실을 확인했다. 따라서 다음과 같은 관계를 알 수 있다.
ΔU = Qv = Cv ΔT = n ×cv,m ×ΔT
3/2 nRΔT = n cv,m ΔT , ∴ cv,m = 3/2 R
일정-압력 조건(ΔP = 0)에서는 조금 다르다.
압력이 일정하다는 것은 계의 압력이 항상 외부압과 평형을 이루려 한다는 뜻이며, 피스톤에 의해 압축되기도 팽창하기도 한다. 내부 압력이 외부압보다 커지면, 기체는 팽창일(W = - P ΔV )을 통해 부피를 넓혀 내부 압력을 낮춘다. 기체가 일을 하면서 공급 받은 에너지 일부를 사용하기 때문에 일정-부피 과정에 비해 온도 변화가 적게 일어날 수 밖에 없다.
따라서 앞선, 일정-부피 과정과 같은 온도 변화(ΔT )를 일으키기 위해서는 일정-부피 조건에서보다 더 큰 에너지가 공급되어야만 한다. (Qp ≠ ΔU , Qp > ΔU , Qp > Qv)
기체의 내부에너지 변화(ΔU = Qv) = 계의 온도 변화(Qp) + 팽창 일(W )
수식으로 표현하면 다음과 같다.
ΔU = Qv = n×cv,m×ΔT = Qp + W = n×cp,m×ΔT - P ΔV
그리고 이상 기체 상태 방정식 PV = nRT 로부터, 외부 압력 P 에 대한 팽창일(W )을 P ΔV = nR ΔT 로 바꾸어 정리할 수 있다.
n×cv,m×ΔT = n×cp,m×ΔT - nRΔT
공통항인 n ΔT 로 나누어 정리하면, 일정-부피 몰 열용량과 일정-압력 몰 열용량 사이의 관계를 알 수 있다.
cv,m = cp,m - R , ∴ cp,m = 5/2 R
열용량 (heat capacity)
-끝-
* 긴 글 읽어주셔서 감사합니다. 본문 내용 중 오타나 잘못된 표현 등이 있는 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리도록 하겠습니다. 감사합니다.
* 2024-10-20: 몰열용량 기호 표현 수정
'화학 > 화학이야기' 카테고리의 다른 글
| 금속-아세틸 아세토네이트 착물의 합성 (2) | 2022.01.17 |
|---|---|
| 황산 구리 수용액은 왜 푸른색일까? (20) | 2022.01.06 |
| 청사진 만들기 (Cyanotype) (2) | 2021.10.12 |
| 주기율표의 역사 (2) 멘델레예프의 주기율 법칙 (0) | 2021.08.28 |
| 주기율표의 역사 (1) 원소의 규칙성 (0) | 2021.08.11 |



