계와 내부 에너지
System & Internal Energy
1. 계와 주위
열역학(Thermodynamics)에서는 에너지 전환에 관심 갖는다. 화학에서는 물질 변화 과정에서 에너지가 어떻게 관여하고, 달라지는지를 알고싶다.
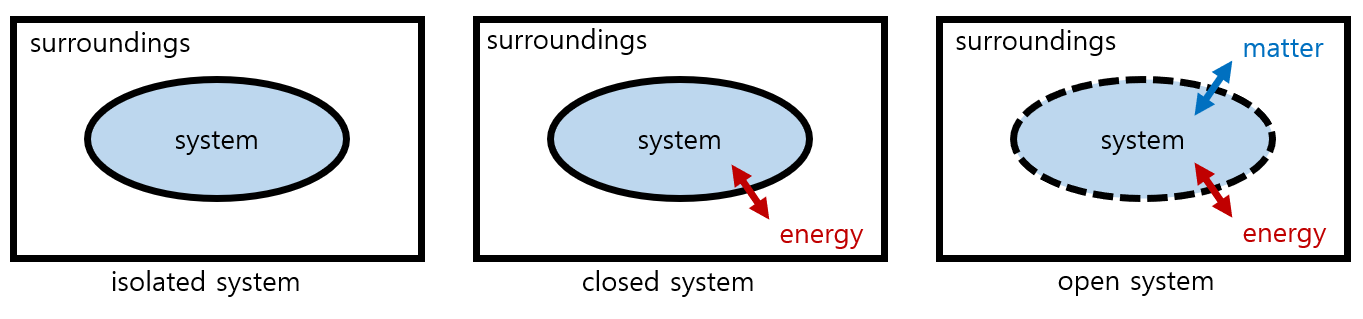
에너지 변화를 추정하기 위해서는 전체 영역을 둘로 구분하는 것이 일반적이다. 관찰자가 관심을 두고 있는 영역과 나머지다. 관심을 두고 있는 대상 또는 영역을 '계(system)'라 하며, 나머지 영역을 '주위(surrounding)'라 한다. 계와 주위는 경계(boundary)를 기준으로 구분되며, 계와 주위를 합하면 우주(universe)가 된다.
계와 주위의 상호작용 유무에 따라 세 가지로 구분될 수 있다. 열린계(open system)는 물질과 에너지가 모두 교환 가능하다. 반면, 닫힌계(closed system)는 주위와 에너지 교환은 가능하지만, 물질 교환은 이루어지지 않는다. 고립계(isolated system)는 물질과 에너지 모두 교환할 수 없다.
2. 내부 에너지 (internal energy, U)
가. 내부 에너지
에너지란, 일을 할 수 있는 능력을 말한다. 어떤 계가 가진 에너지가 많다면, 많은 일을 할 수 있을 것이라 기대할 수 있다. 압축된 뜨거운 기체는 차가운 기체보다 많은 일을 할 수 있을 것이라 기대되며, 더 많은 에너지를 갖는다 말할 수 있다.
열역학에서는 관심을 두고 있는 계의 전체 에너지를 내부 에너지(U )라 한다. 화학에서는 주로 반응 전후 물질 변화를 다루기 때문에 주된 관심 대상이 물질이다. 만약, 어떤 물질 하나에 관심을 두고 있다면, 그 물질이 갖는 고유 에너지를 내부 에너지라 할 수도 있겠다.
그렇다면, 우리는 계(관심 물질)가 갖는 내부 에너지를 알 수 있을까? 안타깝게도 내부 에너지 절대량은 결코 측정할 수 없다. 외부에서 측정을 위해 계와 상호 작용을 시도하면, 계의 고유한 에너지 값이 이전과 달라지기 때문이다.
생각해보자. 우리가 "무언가를 눈으로 본다, 또는 무언가를 관찰한다는 것" 또한 물질과 상호작용힌 뒤 돌아온 빛에 의한 것이다. 우리는 물질적, 에너지적 상호작용 없이 대상을 측정할 수 없다. 우리가 측정을 통해 알아낼 수 있는 유일한 것은 에너지의 변화량(ΔU )이다.
만약, 반응물 A가 모두 생성물 B로 변하는 반응에서 외부로 100 J 만큼의 에너지를 주위에 내놓았다면(주위 = +100 J), 우리는 계와의 별도 상호작용 없이 반응물과 생성물의 내부 에너지 차이(ΔU )가 100 J이라는 사실을 알 수 있다.
ΔU = U나중 - U초기 = UB - UA = -100 J (계)
물질 변화 과정에서 주위에 에너지를 100 J만큼 내놓았다는 것은 반응물 A 에너지가 B 보다 100 J 높았다는 것을 뜻한다. 불안정한 A가 안정한 B로 변하면서, 남는 여분의 에너지가 주위로 전달되었고, 그것이 측정된 것이다.
반대로 주위에서 계로 100 J의 에너지가 공급되어야만(주위 = -100 J) A → B 반응이 일어난다면, 반응물 A 에너지가 생성물 B 보다 100 J 낮다는 것을 뜻한다.
ΔU = U나중 - U초기 = UB - UA = +100 J (계)
계가 주위로 내놓는 여분의 에너지는 계의 부피를 늘리는 팽창 일(work, w = - pΔV )이나 열(heat, q ) 형태로 나타난다. (물론, 반대로 일과 열의 형태로 에너지를 공급해 줄수도 있다.) 어쨌든 내부 에너지의 변화(ΔU )는 일(w )과 열(q )의 합으로 표현할 수 있다. 이를 열역학 제 1법칙이라 한다.
ΔU = q + w = q - pΔV
일(w )과 열(q )은 주위로 표출된 내부 에너지의 외형같은 것이라고 할 수 있다. 따라서 일과 열은 내부 에너지 변화 경로가 어떤가에 따라 그 비율이 달라질 수 있다. 열(q )로 손실되는 비율이 높을 수도 있고, 최대 일(wmax)을 얻어낼 수도 있다. 경로에 의존한다는 뜻이다.
하지만, 그 합인 내부 에너지 변화량(ΔU = q + w )은 온도가 일정하다면, 경로에 무관하게 일정하다. 일과 열은 경로 함수(path function), 내부 에너지는 반응 전후 상태에만 의존하는 상태 함수(state function)이다.
우리가 내부 에너지의 변화량(ΔU )을 측정하기 위해서는 발생한 열과 일을 모두 측정해야 한다. 열(q )은 온도 변화(ΔT )를 통해 비교적 간단하게 측정할 수 있지만, 계의 부피 변화를 살펴야 하는 일(w )을 다소 번거롭다.

* 대부분의 공학용 책에서는 계가 한 일을 (+) 값(w = + pΔV)으로 정의한다. 이유는 대부분 열기관이 한 일에 초점이 맞춰져 있기 때문이다. 이 경우 열역학 제 1법칙은 ΔU = q - w 로 표현된다. 결국 차이는 없다.
나. 부피가 일정한 조건에서 측정한 열 = 내부 에너지 변화
내부 에너지 변화량을 쉽게 측정하고 싶다면, 계의 부피 변화(ΔV )를 제한하면 된다. 부피가 일정한 조건(등적 과정)에서는 내부 에너지의 변화가 팽창일로 나타나지 않으며(w = 0), 모두 열(q )의 형태로 나타나게 될 것이다.
ΔU = w + q = 0 + q = qv (부피가 일정한 조건, ΔV = 0)
부피가 일정한 강철 용기에서 변화를 일으킨 다음, 해당 과정에서의 온도 변화(ΔT )를 측정한다. 일정 부피(ΔV = 0)에서의 물질의 열용량(Cv)을 알면 발생한 열(qv)을 알 수 있다.
* 열용량(Heat Capacity, C )은 어떤 물질 온도를 1 [K] 상승시키는데 필요한 열량 [J]을 뜻한다. 열용량이 크다는 것은 온도 상승을 위해 공급되어야 할 열량이 많다는 뜻이다. 우리가 알고 있는 비열용량(specific heat capacity, c )은 물질의 양을 1 [g]으로 기준했을 때, 열용량 [J/K]이며, 몰열용량(molar heat capacity, c )은 1 [몰]을 기준으로 했을 때의 열용량 [J/molK] 이다.
ΔU = qv = Cv ΔT (Cv = 정적 열용량)
결과적으로, 주위의 온도 변화만을 측정하여 계의 내부 에너지 변화(ΔU )를 측정한 것이다.

* 통 열량계(봄베 열량계) 물질을 steel bomb 라고 불리는 작은 반응 용기에 물질을 넣고 밀봉한 다음, 그 용기를 봄베 열량계 안에 넣는다. 반응 용기와 열량계 사이는 물이 채워진다. 반응은 통 내부의 가열된 도선(wire)에 의해 시작되며, 반응 결과에 따라 열을 흡수하거나 방출한다. 그리고, 열에 의한 물의 온도 변화를 측정한다. 반응 용기는 단단히 밀봉되었고, 강철 용기이므로 부피 변화는 없다. 반응에 따른 팽창 일은 없다. 따라서 반응 용기 내부의 에너지 변화는 모두 열량으로만 나타난다.
계와 내부 에너지
-끝-
* 끝까지 읽어주셔서 감사합니다. 본문의 내용 중 잘못된 부분이나 오타 등이 있는 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리도록 하겠습니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 유효 숫자 (significant figure) (0) | 2021.07.30 |
|---|---|
| 엔탈피 (Enthalpy) (0) | 2021.07.04 |
| 용액의 증기압은 왜 용매보다 낮아지는가? (4) | 2021.05.26 |
| [스크랩] 원자의 구조 읽기 자료 (0) | 2021.05.10 |
| 원자가와 원자가 전자 (valence & valence electron) (2) | 2021.04.30 |



