본문은 이전 글(242) 주기율표의 역사 (1) 원소의 규칙성 과 이어집니다.
주기율표의 역사 (1) 원소의 규칙성
주기율표의 역사 (1) 원소의 규칙성 0. 들어가기 독일의 조셉 폰 프라운호퍼(Joseph von Fraunhofer, 1787-1826)는 군용 망원경을 통해 햇빛 스펙트럼을 관찰하고, 무지개 빛 스펙트럼 속에 다양한 선들이
stachemi.tistory.com
4. 멘델레예프의 주기율 법칙
독일의 화학자 로타르 마이어(Julius Lothar Meyer, 1830-1895)는 1864년 출간된 《화학에 대한 근대 이론, Die modernen Theorien der Chemie》에서 원자량에 따라 원소들을 분류한 표를 실었다. 표의 세로줄에는 비슷한 화학적 성질을 갖는 원소들이 나열되어 있었다. 그는 1868년, 개정된 원자량이 사용된 새로운 주기율표를 만들지만, 발표는 하지 않았다.

원소들 사이 규칙성에 대한 명확한 설명은 1869년 드미트리 멘델레예프(Dmitri Mendeleev, 1834-1907)에 의해 이루어진다. 멘델레예프는 뛰어난 교육자임과 동시에 원소 성질에 대한 풍부한 지식을 갖춘 화학자였다.
그는 1866년 32세의 나이로, 세인트페테스부르크 대학에 교수로 임명되었다. 그리고 자신의 강의를 바탕으로 한 《화학의 원리, Principles of Chemistry》라는 교과서를 쓰기 시작했다. (이 교과서는 다양한 언어로 번역되어 널리 활용되었다.)

멘델레예프는 교과서를 쓰면서, 당시 알려진 원소들을 체계적으로 분류하는 방법에 대해 설명해야 할 필요성을 느꼈다. 자연스레 원소마다 갖는 고유한 값인 원자량과 화학적 성질 사이의 연관성에 관심 갖게 되었다. 그도 당시의 다른 화학자들과 마찬가지로 둘 사이에 어떤 관계가 존재한다고 믿었다.
그는 원소 성질과 원자량을 적은 카드를 직접 만들어 다양한 방식으로 배열해보며, 규칙성을 찾았다. 그리고 원소의 원자량과 화학적 성질 사이 주기성(반복되는 규칙성)이 있음을 알아냈다.
그는 1869년 3월, 《원소의 성질과 원자량 사이의 상관관계, "The Correlation of the Properties and Atomic Weights of the elements"》라는 제목의 논문을 발표[1]했다. 여기서 그의 첫 번째 주기율표가 공개되었다.

멘델레예프는 원자량이 증가하는 순서에 따라 원소를 나열했다. 이전 여러 과학자들도 원소들의 규칙성을 찾으려는 시도를 했던 것은 분명하지만 멘델레예프는 원소들의 성질이 주기적으로 반복된다는 '주기성(periodicity)'에 특별히 주목했다. 그는 표와 함께 여덟 가지 설명을 덧붙였다.
1. The elements, if arranged according to their atomic weight, exhibit an apparent periodicity of properties.
- 원소들을 원자량 순서대로 배열하면, 원소 성질의 주기적 경향이 분명하게 나타난다.
2. Elements which are similar regarding their chemical properties either have similar atomic weights (e.g., Pt, Ir, Os) or have their atomic weights increasing regularly (e.g., K, Rb, Cs).
- 화학적 성질이 비슷한 원소들은 비슷한 원자량을 갖거나(백금, 이리듐, 오스뮴) 원자량이 규칙적으로 증가(칼륨, 루비듐, 세슘)한다.
3. The arrangement of the elements in groups of elements in the order of their atomic weights corresponds to their so-called valencies, as well as, to some extent, to their distinctive chemical properties
- 원소들을 원자량 순서로 나열했을 때, 만들어지는 그룹 순서(배열)는 그것들의 원자가*와 일치한다. (* 원자가는, Li ~ F를 순서대로 나열했을 때, 각 원소들이 갖는 독특한 성질을 결정하는 요인(값)으로 알려져 있었다.)
4. The elements which are the most widely diffused have small atomic weights.
- 자연에 가장 광범위하게 분포한 원소들은 작은 원자량을 갖는다.
5. The magnitude of the atomic weight determines the character of the element, just as the magnitude of the molecule determines the character of a compound body.
- 분자의 크기가 화합물의 특성을 결정하는 것처럼, 원자량의 크기가 원소의 특성을 결정한다.
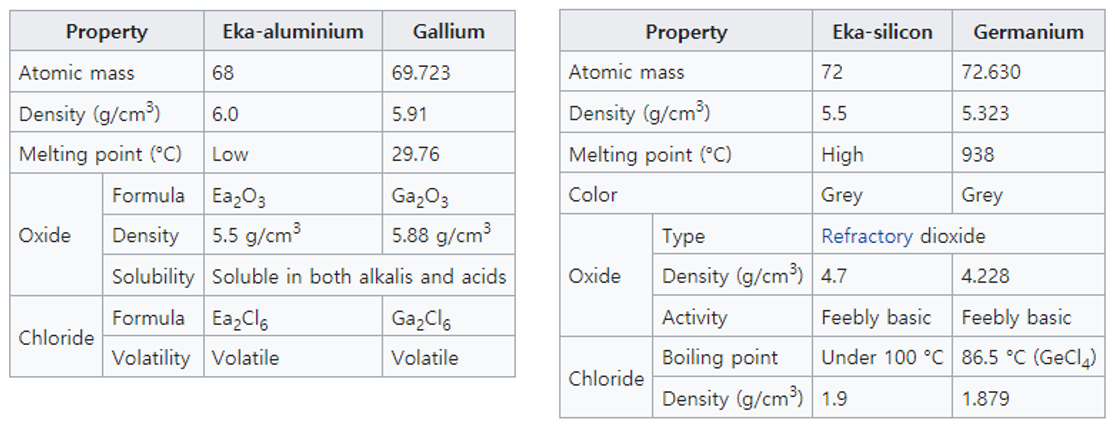
6. We must expect the discovery of many yet unknown elements – for example, two elements, analogous to aluminium and silicon, whose atomic weights would be between 65 and 75.
- 아직 발견되지 않은 많은 원소들이 있음을 예상할 수 있다. 예를 들어 알루미늄, 실리콘과 성질이 유사한 두 원소의 원자량은 65에서 75 사이일 것이다. (후에 발견된 갈륨(Ga)의 원자량은 69.7, 저마늄(Ge)의 원자량은 72.6이다.)
7. The atomic weight of an element may sometimes be amended by a knowledge of those of its contiguous elements. Thus the atomic weight of tellurium must lie between 123 and 126, and cannot be 128.
- 몇몇 원소의 원자량은 원소들의 연속성에 의해 나타나는 정보(성질의 주기성)를 근거로 수정되어야 할 것이다. 텔루륨(Te)의 원자량은 128이 될 수 없으며, 123에서 126 사이의 값을 가져야 한다. (실제 텔루륨의 원자량은 127.6이다. 이는 빗나간 예측이다.)
8. Certain characteristic properties of elements can be foretold from their atomic weights.
- 원소의 독특한 성질은 그 원소의 원자량으로부터 예측 가능하다.
[출처] Wikipedia.org [멘델레예프]
그리고 몇 번의 수정을 마친 뒤, 1871년 7월 주기율 법칙에 관한 두 번째 논문 《화학 원소의 주기적 규칙성, The Periodic Law of the Chemical Elements》을 발표[2]한다.
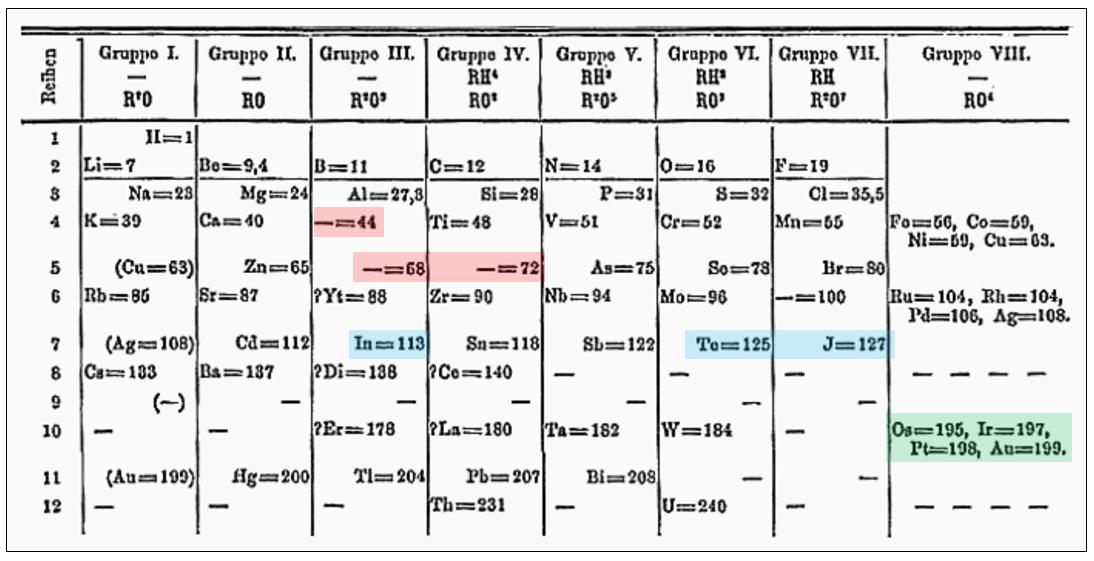
멘델레예프는 아직 발견되지 않았지만, 주기율 법칙에 따라 존재할 것으로 예상되는 원소들에 대한 생각을 과감하게 밝혔다. 그는 미발견 원소에 에카 붕소(Eb = 44), 에카 알루미늄(El = 68), 에카 규소(Es = 72) 등의 이름을 붙였으며, 단순히 존재 여부를 판단하는데만 그치지 않고 물리적, 화학적 성질까지도 예측했다.
또한, 주기적 성질을 바탕으로 몇몇 원소들의 원자량이 수정되어야 한다고 주장했다.
당시 인듐(In)의 원자량은 76, 텔루륨(Te)의 원자량은 128로 알려져 있었다. 인듐의 화학적 성질에 따르면, 알루미늄과 같은 그룹에 속하면서 동시에, 114에 가까운 원자량을 가져야 한다고 했다. 텔루륨은 아이오딘 원자량 127 보다 클 수 없으며, 123~126의 값을 가져야 한다고 생각했다. 이에 멘델레예프는 인듐(In) = 113, 텔루륨(Te) = 125으로 수정하여 표에 나타냈다.
* 실제 원자량은 인듐(In) = 114.8, 텔루륨(Te) = 127.6이다. 인듐에 대한 예측은 정확했지만, 텔루륨은 빗나갔다. 텔루륨(127.6)과 아이오딘(126.9) 사이 원자량 역전은 주기율표에서 나타나는 예외 중 하나이다.
그 외에도 오스뮴(Os, 199 → 195), 이리듐(Ir, 198 → 197), 백금(Pt, 197 → 198), 금(Au, 197? → 199)의 원자량 값을 주기성을 근거로 수정한 뒤, 순서를 새로 맞췄다. (실제 원자량은 Os = 190.23, Ir = 192.22, Pt = 195.08, Au = 196.97 이다.)
멘델레예프의 주기율 법칙 또한, 발표 즉시 학계의 인정을 받은 것은 아니다. 그러나 그가 예측했던 미발견 원소들이 하나둘씩 발견되고, 그 성질 또한 예상에 맞아 들어가면서 인정받기 시작한다. 1875년에 발견된 갈륨(Ga)은 에카-알루미늄과, 1879년, 1886년에 각각 발견된 스칸듐(Sc)과 저마늄(Ge)은 에카-붕소, 에카 규소와 성질이 일치하였다. 영국 왕립화학회는 1882년, 멘델레예프에게 데이비 메달(Davy Medal)을 수여했다.
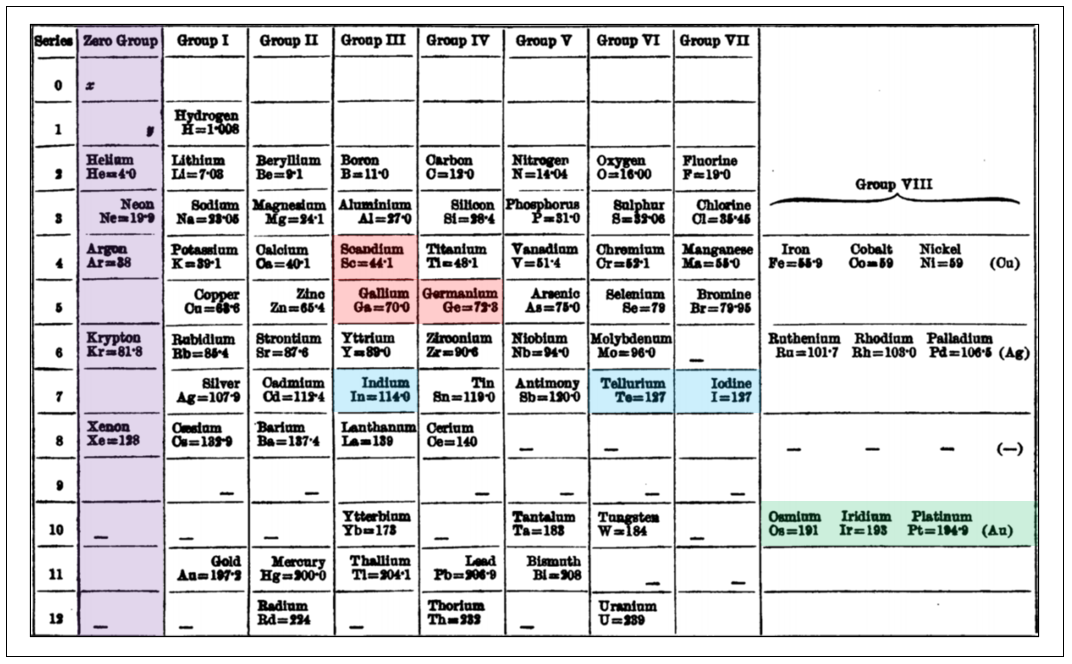
멘델레예프의 주기율표가 큰 의미를 갖는 것은 화학적 성질과 원자량 사이에 어떤 연관이 존재한다는 것에 대한 흥미를 다시 한번 불러일으켰다는 사실이다. 이후 기존의 원소와 다른 성질의 비활성 기체가 여럿 발견되었음에도, 기존 멘델레예프 주기율표에 세로줄 하나만을 추가함으로써 전체 시스템을 깨지 않고 간단히 해결할 수 있었다.
주기율표의 역사 (2) 멘델레예프의 주기율 법칙
- 끝 -
* 2022.6.17. 추가 : [다음글] 267. 모즐리가 밝혀낸 원자 구조의 비밀 https://stachemi.tistory.com/267
주기율표의 역사 (3) 모즐리가 밝혀낸 원자 구조의 비밀
[관련 글] 243. 멘델레예프의 주기율표 : https://stachemi.tistory.com/243 주기율표의 역사 (2) 멘델레예프의 주기율 법칙 본문은 이전 글(242) 주기율표의 역사 (1) 원소의 규칙성 과 이어집니다. 주기율표
stachemi.tistory.com
[참고자료]
[1] D. Mendeleev, “Sootnoshenie svoistv s atomnym vesom elementov” [“The Correlation of the Properties and Atomic Weights of the Elements”], Zh. Russ. Khim. Obshch., 1869, 1, No. 2/3, 60-77 (65).
[2] D. Mendelejeff, “Die periodische Gesetzmässigkeit der chemischen Elemente,” [The Periodic Law of the Chemical Elements] Ann. Chem. Pharm., 1871, Supplementband, 8, 133-229.
[3] Kaji, M. “DI Mendeleev’s concept of chemical elements and the principles of chemistry”. Bulletin for the History of Chemistry, 27(1), 4-16. [pdf]
[4] 존 허드슨(고문주 옮김), 화학의 역사, 북스힐
'화학 > 화학이야기' 카테고리의 다른 글
| 열용량 (Heat capacity) (8) | 2021.11.14 |
|---|---|
| 청사진 만들기 (Cyanotype) (2) | 2021.10.12 |
| 주기율표의 역사 (1) 원소의 규칙성 (0) | 2021.08.11 |
| 유효 숫자 (significant figure) (2) | 2021.07.30 |
| 엔탈피 (Enthalpy) (6) | 2021.07.04 |



