유효 숫자 | significant figure
0. 들어가기
학교마다 차이는 있겠지만, 대학교 1학년 교과목 일반화학은 고등학교 시절 화학1, 2와 다른 점이 하나 있다. 바로 '일반화학실험'이라는 과목이 1+1으로 딸려있다는 것이다. 일종의 부록 과목인데, 대학원생 조교가 담당하는 경우가 많다. 이름에서 알 수 있듯 화학 관련 기초 실험을 하고 예비 및 결과 레포트를 작성하는데, 그 결과는 고등학교 수행 평가처럼 학점에 일정 비율 반영된다. (물론, 학교마다 커리큘럼마다 다르기에 별도 과목으로 편성되기도 한다.)
지금은 어떨지 모르겠지만 내 과거를 돌이켜보면, 학기 초에 실험실 안전과 규칙, 기초적인 도구 사용법, 레포트 작성법, 유리 세공 등을 했었다. 그리고 측정 도구의 불확실성과 측정값의 처리, 유효 숫자 개념을 처음 접했는데, 당시 나는 뭔 소리인지 이해하기는 커녕 관심조차 없었기에 기억이 선명하지는 않다. (나는 생각보다 훠어어얼씬 아무 생각 없었고, 고민도 없었고, 뭐가 맞는지 틀린지도 잘 몰랐다. 물론, 과거의 내가 부끄럽지 않다. 정말로 그렇다.)
측정(measurement)이란, 눈으로 보고, 값을 읽고, 이를 정확하게 기록하는 행위이지만 "레포트에 반드시 측정값의 불확실성과 유효 숫자 고려해서 결과처리 하세요!"라는 조교 선생님의 한마디가 곁들여진다면, 내가 본 것을 그대로 믿지 못하고, 내가 쓴 것을 한없이 의심한 채 레포트를 제출하고, 결과가 나오기 전까지 초조하기 마련이다.
현재를 살고 있는 수많은 과거의 나에게 조금이나마 도움이 되었으면 좋겠다.
1. 측정값의 불확실성
정확한 실험을 위해서는 정확한 측정이 선행되어야 한다.
예를 들어 농도를 정확하게 아는 용액을 만들기 위해서는 용질과 용매의 양을 정확하게 측정하는 것이 무엇보다 중요하다. 이는 용액 농도를 묽히는 과정, 두 용액을 일정 비율로 섞는 과정에서도 마찬가지다.
우리는 용액 부피를 측정하고, 원하는 양을 채취하기 위해 다양한 도구를 사용한다. 비커와 삼각 플라스크, 뷰렛(burette), 부피 피펫(pipette)과 눈금 피펫, 부피 실린더 등등...

그런데, 각각의 도구들은 저마다 크고 작은 불확실성(uncertainty)을 갖는다. 비커나 삼각플라스크 눈금은 비교적 큰 오차를 갖기 때문에 측정 도구로 사용되지 않는다.
따라서 비커 눈금으로 측정한 100 mL와 부피 실린더 또는 눈금 피펫으로 측정한 100 mL는 부피가 서로 다를 수 있다. 보통 10 mL 부피 피펫의 불확실성은 ± 0.02 mL 인데 반해, 비커는 ±5% 정도이다. 이러한 차이는 실험 결과에도 적잖은 영향(오차)을 미친다. 측정 도구의 선택이 중요한 이유다. (물론, 도구 자체가 갖는 불확실성은 실험자가 해결할 수 없는 오차 요인이다.)
불확실성이 ± 0.02 mL인 10 mL 부피 피펫을 통해 정확하게 10.00 mL의 용액을 측정했다고 하자. 겉보기 부피는 10.00 mL이다. 하지만 측정 도구 자체가 ±0.02 mL 오차를 갖기에, 실제 부피는 9.98 mL ≤ 실제 부피 ≤ 10.02 mL 이다.
[참고] 부피 피펫(pipette)은 한 가지 단일 부피(용량) 값만 표시되어 있으며, 눈금 피펫(graduated pipette)은 세부 눈금이 있다. 참고로 눈금 피펫의 정확도가 부피 피펫의 정확도에 비해 떨어진다.
불확실성은 부피 측정 과정에서만 있는 것이 아니다. 무게를 잴 때도 마찬가지다. 우리는 화학 저울(chemical balance)을 통해 시료 무게를 측정하는데, 실험실 정밀 저울은 보통 소수점 이하 네 자리까지 잴 수 있다.
부피 피펫으로 측정한 10.00 mL 용액 무게를 화학 저울로 측정했다고 해보자. 처음 측정값은 10.0109 g 이었고, 이후 3회 더 측정하여 10.0108 g, 10.0107 g, 10.0108 g 값을 얻었다. 이 경우 용액 무게는 10.0108 g (평균값, 대푯값)이고, ±0.0001 g 의 불확실성을 갖는다고 할 수 있다.
이렇게 측정한 부피(10.00 ±0.02 mL)와 무게(10.0108 ±0.0001 g)를 이용하여 용액 밀도(density, g/mL)를 구한다면 어떨까?
밀도는 단위 부피당 차지하는 물질의 무게(질량)로 나타낸다.
10.0108 [g] ÷ 10.00 [mL] = 1.00108 [g/mL]
이 밀도값 1.00108 [g/mL] 은 부피와 무게 대푯값(평균값)으로 계산되었다. 그렇다면, 밀도 불확실성은 어떻게 되는 것일까? 밀도를 이루는 분자항(무게), 분모항(부피)의 불확실성에 따라 그 결괏값(밀도)도 달리 계산될 것이다.
10.0109 [g] ÷ 9.98 [mL] = 1.003096 … [g/mL]
10.0107 [g] ÷ 10.02 [gmL] = 0.99907 … [g/mL]
:
당연히 무게, 부피 대푯값만으로 계산된 밀도값과도 차이가 난다. 즉, 각기 측정된 값들(무게, 부피)의 불확실성을 포함하여 계산된 결괏값(밀도)도 또 다른 불확실성을 갖게 되며, 일련의 과정을 거쳐 처리해주어야 한다. 이때 반드시 고려되어야 할 것이 유효 숫자이다.
2. 유효 숫자
유효 숫자(significant figure, sf)란, 측정값을 구성하는 숫자들 중 의미가 있는 숫자들을 말한다. 우리는 유효 숫자와 과학적 표기법을 통해 측정값의 불확실성을 일관되게 처리한다. 다음 예를 살펴보자.
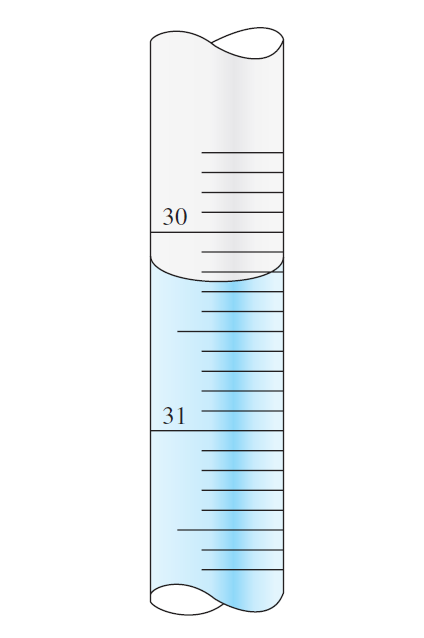
뷰렛에 담긴 용액 메니스커스면이 30.2 mL와 30.3 mL 눈금 사이에 있었다. 이 뷰렛은 최소 눈금은 0.1 mL 단위였고, 대략적으로 .2와 .3 중간 정도에 위치하는 것처럼 보였지만, 사이 값이 얼마인지 정확히 알 수는 없었다. 관찰자는 눈금 사이 값을 30.24 mL라 읽었다.
관찰자가 읽은 30.24 mL 의 숫자 3, 0, 2, 4 중 확실한 값이라고 말할 수 있는 숫자는 몇 개일까?
30.24의 십의 자리 3, 일의 자리 0, 소수점 아래 첫째 자리 2는 확실한 숫자이며, 불확실성을 갖지 않는다. 왜냐하면, 관찰된 용액 메니스커스 면이 30.2와 30.3 사이에 있었을 것이기 때문이다.
그러나 관찰자가 읽은 소수점 아래 둘째 자리 4는 불확실하다. .2과 .3 사이에 있었을 뿐, 마지막 자리 값은 0 ~ 9 중 하나가 될 수 있다. 관찰자가 4를 택했을 뿐이다. 다른 누군가는 30.25, 30.22로 읽었을 수도 있다. 이 경우, 마지막 숫자의 불확실함은 측정도구로부터 온 것이 아니며, 관찰하는 이에 따라 달라질 수 있다.
따라서 30.24 mL 값은 확실한 세 개의 숫자(3, 0, 2)와 불확실한 숫자(4)로 구성되어 있다. 유효 숫자 개념에 따르면, 마지막 숫자(불확실함을 갖는 첫 번째 숫자) 4까지 포함된다. 위 경우 네 개의 유효 숫자(sf=4)를 갖는다.
유효 숫자는 '눈금을 통해 얻은 확실한 숫자 모두'와 '불확실한 첫 번째 자리 숫자'를 포함한다.
2.1. 과학적 표기법 (scientific notation, a x 10b)
학생 B는 최소 눈금이 1 cm 인 자를 이용하여 친구 A의 키를 측정했다. 그리고 169.5 cm 라고 적었다. 아마도 169 와 170 cm를 가리키는 눈금 사이에 A 머리가 위치했나 보다.
반면, 학생 C는 최소 눈금이 10 cm 인 자를 이용하여 친구 A의 키를 측정했다. 그리고 170 cm 라고 적었다. 최소 눈금 단위가 10 cm 였으므로, 일의 단위 숫자인 0이 불확실성을 갖는 첫 번째 숫자이다. 학생 C가 측정한 값인 170 cm의 1, 7, 0은 모두 유효 숫자가 된다.
그런데 만약, 학생 C가 사용한 자 눈금이 100 cm, 200 cm 간격이었다면? 다시 말해 최소 눈금이 100 cm 였다면, 유효 숫자는 어떻게 달라질까? 측정 단위가 백 단위이므로, 170 cm의 1을 제외한 7과 0은 모두 불확실한 숫자다. 유효 숫자는 불확실함을 갖는 첫 번째 숫자 7 까지만 포함하므로, 유효 숫자는 1과 7 뿐이다.
똑같은 170 cm 라는 숫자이지만, 최소 눈금 단위에 따라 의미를 갖는 유효 숫자 개수가 다르다는 뜻이다. 따라서 측정 도구 스케일 정보가 없으면, 마지막 일의 자리 숫자 0이 유효한지 그렇지 않은지를 판단할 수 없다.
이에, 측정값의 유효 숫자 전달을 명확하게 하기 위해서는 과학적 표기법(scientific notation)을 사용하는 것이 바람직하다. 같은 170 이라는 측정값이라도 유효 숫자가 세 개인 경우(170 cm)에는 1.70 × 102 cm, 유효 숫자가 두 개인 경우(170 cm)에는 1.7 × 102 cm 로 달리 표기한다.
참고로, 여러 값을 비교해야 하는 특별한 경우를 제외하고는 과학적 표기법의 앞 숫자 부분은 1 이상 ~ 10 미만 값으로 나타낸다. 1.70×102 을 17.0×101 또는 0.170×103 형태로 나타내지 않는다.
유효 숫자 2 개 : 1.7 × 102
유효 숫자 3 개 : 1.70 × 102
2.2. 유효 숫자를 정하는 몇 가지 규칙
1) 소수점 앞 정수 부분 숫자 중, 영(0)이 아닌 모든 수는 유효 숫자이다. 예를 들어, 123.45 에서 소수점 앞 정수 부분 1, 2, 3은 모두 유효 숫자이다.
2) 영(0)이 아닌 숫자 사이에 끼어있는 0은 유효 숫자이다. 예를 들어, 1023.405 에서 0이 아닌 숫자 사이의 끼어있는 0은 모두 유효 숫자이다. (1과 2 사이 십의 자리 0, 소수점 첫째 자리 4와 셋째 자리 5 사이 0, 모두 유효 숫자이다.)
3) 영(0)이 아닌 숫자 뒤에 오는 0은 그 자체로 유효 숫자인지, 아닌지 알 수 없다. 따라서 섣불리 불확실한 0을 유효 숫자 취급하지 않는 것이 일반적이다. 해당 0이 유효 숫자인지 아닌지는 과학적 표기법으로 표기해야 알 수 있다. 예를 들어 1230 에서 끝의 0은 유효 숫자인지 아닌지 확정 지을 수 없지만, 1.23 × 103 또는 1.230 × 103의 명확한 표현을 통해서는 구분할 수 있다.
4) 1보다 작은 값(0.xxx)의 '소수점 앞 0.과 소수점 뒤 영(0)이 아닌 숫자 앞의 0들'은 유효 숫자가 아니다. 예를 들어 0.00012 에서 소수점 앞의 0. 과 소수점 뒤의 0이 아닌 숫자 1 앞에 있는 .000은 유효 숫자가 아니다.
5) 물건 개수를 세는 것처럼 딱 떨어지는 수(1 개, 2 개 … 등)나 단위 변환을 위한 단순 비례 관계(1 배, 1.5 배, 2 배 … 등)에서는 유효 숫자를 고려하지 않는다. 단위 변환 전후에도 유효 숫자 수는 변하지 않아야 한다.
3. 측정값 계산
앞의 내용처럼 부피와 질량을 이용해 밀도를 계산하는 경우, 우리는 각 측정값의 유효 숫자를 어떻게 처리해야 할까? 측정값을 유효 숫자를 고려하여 정확히 표현하는 것이 중요한 만큼, 측정값들의 계산에서도 유효 숫자는 중요하게 다루어져야 한다.
3.1. 덧셈과 뺄셈
측정값들 간의 덧셈과 뺄셈 계산에서는 덜 정확한 값의 유효 숫자 자릿수에 맞추어 계산해야 한다. 다시 말해 측정값 중 유효 숫자의 자릿수가 가장 큰 값에 맞추어 계산한다.
예제) 고등학교 심화화학 31p 본문
염산(HCl) 15 mL 와 수산화나트륨(NaOH) 수용액 15 mL를 혼합해서 눈금실린더로 부피를 측정했다. 용액의 부피는 28.6 mL였다. 혼합 전후의 부피 차이는 얼마일까? (15 + 15 - 28.6 = ?)
정답)
1.4 mL(X) 1 mL (O)
설명)
혼합 전 염산과 수산화나트륨 수용액 15 mL의 일의 단위 숫자 5는 이미 불확실성을 포함하고 있기에 소수점 아래의 값을 알 수가 없다. 쉽게 말해 15 mL의 일의 자리 5가 14.5 mL ~ 15.4 mL 값의 반올림한 결괏값일 수 있다. 따라서 소수점 아래의 값을 더하고 빼는 것은 의미가 없다. 오히려 혼합 후의 부피가 소수점 첫째 자리까지 더 정확하게 측정되었지만, 초기 15 mL + 15 mL 일의 자리에서 불확실성을 갖고 있기 때문에 계산 결과는 일의 자리까지만 나타내는 것이 바람직하다.
부피 차이 = (15 + 15) mL - 28.6 mL = 1.4mL = 1 mL (∵불확실성을 갖는 첫 번째 숫자는 일의 자리이므로)
3.2. 곱셈과 나눗셈
측정값들의 곱셈과 나눗셈 계산에서는 유효 숫자의 '개수가 적은 쪽'에 맞추어 결괏값을 나타낸다. 예를 들어 유효 숫자 네 개짜리 값과 유효 숫자 여섯 개짜리 값의 곱셈(또는 나눗셈)의 결괏값은 유효숫자 네 개로 나타낸다. 본문 위의 부피 평균값(10.00 mL, sf=4)과 무게 평균값(10.0108 g, sf=6)으로 밀도(g/mL)를 계산해보자.
밀도 = 10.0108 g ÷ 10.00 mL = 유효 숫자 6개 ÷ 유효 숫자 4개
= 1.00108 [g] (×, 유효숫자 6개) 1.001 [g] (○, 유효 숫자 4개)
예제) 고등학교 심화화학 32p 본문
1.5 M 염산 수용액 10.00 mL가 있다. 이 용액 속에 포함된 HCl은 몇 mol인가? (1.5 x 10.00 = ?)
정답)
15 mmol = 1.5 x 10^-2 mol (유효숫자 2개)
설명)
농도의 불확실성을 갖는 첫 번째 숫자는 소수점 이하 첫째 자리 5이므로, 농도 = 1.5 + α (불확실성: 0 < α < 0.1)
부피의 불확실성을 갖는 첫 번째 숫자는 소수점 이하 둘째 자리 0이므로, 부피 = 10.00 + β (불확실성: 0 < β < 0.01)
이 둘을 곱하면, 농도 x 부피 = (1.5 + α) x (10.00 + β) = 15 + 10α + 1.5β + αβ
불확실성을 포함한 10α, 1.5β, αβ 값의 범위를 살펴보면, 0 < 10α < 1 , 0 < 1.5β < 0.015 , 0 < αβ < 0.001 이다.
즉, 10α의 오차 범위가 가장 큰데, 이 값이 0 에서 1 사이의 값이다. 즉, 불확실한 숫자 중에 가장 큰 값이 소수점 이하 첫째 자리라는 뜻이다. 이는 두 측정치를 곱한 결괏값이 유효 숫자 개수가 적은 측정치의 개수를 따라가는 것과 같다.
4. 참고한 책
* Skoog, Fundamentals of Analytical Chemistry 9th
* 이진승 외, 고등학교 심화화학(2009), 한국과학창의재단
* 황훈, 분석화학의 기본개념, 자유아카데미
* 긴 글 읽어주셔서 감사합니다. 본문의 내용 중 오타나 오류가 있는 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리겠습니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 주기율표의 역사 (2) 멘델레예프의 주기율 법칙 (0) | 2021.08.28 |
|---|---|
| 주기율표의 역사 (1) 원소의 규칙성 (0) | 2021.08.11 |
| 엔탈피 (Enthalpy) (6) | 2021.07.04 |
| 계와 내부 에너지 (System & Internal Energy) (2) | 2021.06.14 |
| 용액의 증기압은 왜 용매보다 낮아지는가? (6) | 2021.05.26 |



