1. 황산 구리 수용액은 왜 푸른색일까?
중학교 또는 고등학교에서 '금속 착물(metal complex)'을 언급할 일은 없다. 주기율표는 배우지만 전이금속은 소개에 그치고, 배위결합 또한 현재 교육과정에는 포함되지 않는다. 전이금속과 배위결합이 중심이 되는 착물 개념을 학교 현장에서 생소해하는 것은 어찌보면 당연하다.
수업 중 '금속 착물'이라는 용어가 직접 사용될 일은 없지만, 은연 중에 다뤄지고는 있다. 대표적인 것이 색을 갖는 금속 이온 수용액이다. 우리는 황산 구리 수용액이 푸른색을 띤다는 사실을 알고 있으며, 이를 자연스럽게 받아들인다. 전기 화학 단원에서 구리 이온의 환원으로 인해 용액 내 구리 이온 수가 줄면, 수용액의 푸른색이 점차 옅어진다는 지문 또한 흔하게 볼 수 있다. 구리 이온이 왜 푸른색을 나타내는지에 대해 설명하지 않지만 말이다.

무수 황산구리는 흰색 결정이다. 그런데 무수 황산구리가 물과 만나면, 위의 <그림 1>처럼 푸른색으로 변한다. 이유는 황산구리의 구리 양이온(Cu2+) 주위를 물이 둘러싸고, 황산구리 수화물을 만들기 때문이다. 황산구리 수화물의 색이 푸른색이다.
그런데 이상하다. 칼륨(K)과 칼슘(Ca)도 구리(Cu)와 같은 4주기 금속 원소지만, 물에 녹아도 별다른 색을 띠지 않는다. 지금과 달리 과거에는 구리와 같은 몇몇 금속 이온들이 물 속에서 독특한 색을 갖는 이유와 어떻게 복잡한 구조의 화합물을 만들 수 있는지 설명하지 못했다. 그저, 설명하기에 복잡한 물질(complex)이라 부르고, 평범하지 않은 금속들로 구분했을 뿐이다.
2. 구리는 칼륨, 칼슘과 무엇이 다른 걸까?
구리와 칼륨, 칼슘은 모두 4주기 금속 원소이다. 칼륨은 19번, 칼슘은 20번, 구리는 29번이다. 하지만, 물에서 안정한 이온이 색을 나타내는 것은 구리 뿐이다. 어떤 차이가 있을까? 구리가 나머지 두 원소(칼륨, 칼슘)와 다른 점은 d-오비탈에 전자가 채워진다는 것이다. 구리와 같이 d-오비탈에 전자가 채워지는 금속을 전이 금속(transition metal)이라 한다.

구리와 같은 전이 금속들은 전자가 풍부한 화합물(또는 이온) 등을 만나 착물을 만든다. 그리고 이 과정에서 금속의 d-오비탈 에너지 갈라짐이 생긴다.<그림 3> 금속에 전자를 일방적으로 제공하여 결합을 형성할 수 있는 화합물(또는 이온)들을 리간드(ligand)라 부른다.

물(H2O)은 대표적인 리간드 중 하나이다. 물은 두 쌍의 비공유전자쌍을 갖고, 이를 금속 이온에게 제공하여 리간드로 작용한다. 금속 이온과 리간드가 결합하여 착물(수화물)을 만들고, 이 과정에서 금속의 d-오비탈 에너지는 갈라짐이 발생한다. 구리 이온의 경우 이 간격에 해당하는 빛의 파장 영역이 가시광선 600 ~ 800 nm에 해당하며, 황산구리 수화물은 색을 나타내게 된다.

3. 같은 수화물이어도 금속 종류에 따라 색이 다르다?
전이 금속이 리간드와 결합해 만든 착물들은 저마다의 색을 갖는 것이 특징이다. 보통, 금속 이온의 종류나 전하, 리간드의 종류와 개수 등에 따라 색이 달라진다. 예를 들어 같은 물(H2O)을 리간드로 만들어진 착물(수화물)일지라도 색깔은 금속 종류와 전하에 따라 <그림 5>와 같이 다양하다.

앞서 언급했듯, 다가오는 리간드의 영향으로 금속의 d-오비탈은 에너지 갈라짐이 발생한다. 그리고 그 갈라짐의 크기(간격)에 따라 전자 전이 시 흡수하는 빛의 파장 영역대가 달라진다. 에너지 갈라짐이 크면 단파장(고에너지)의 빛을, 에너지 갈라짐이 작으면 장파장(저에너지)의 빛을 흡수한다.
금속의 d-오비탈 갈라짐에 의한 d-d 전이는 보통 가시광선 영역에 해당하며, 우리는 물질이 흡수하는 빛의 보색을 관찰하게 된다. 이를 보색 원리라 한다.
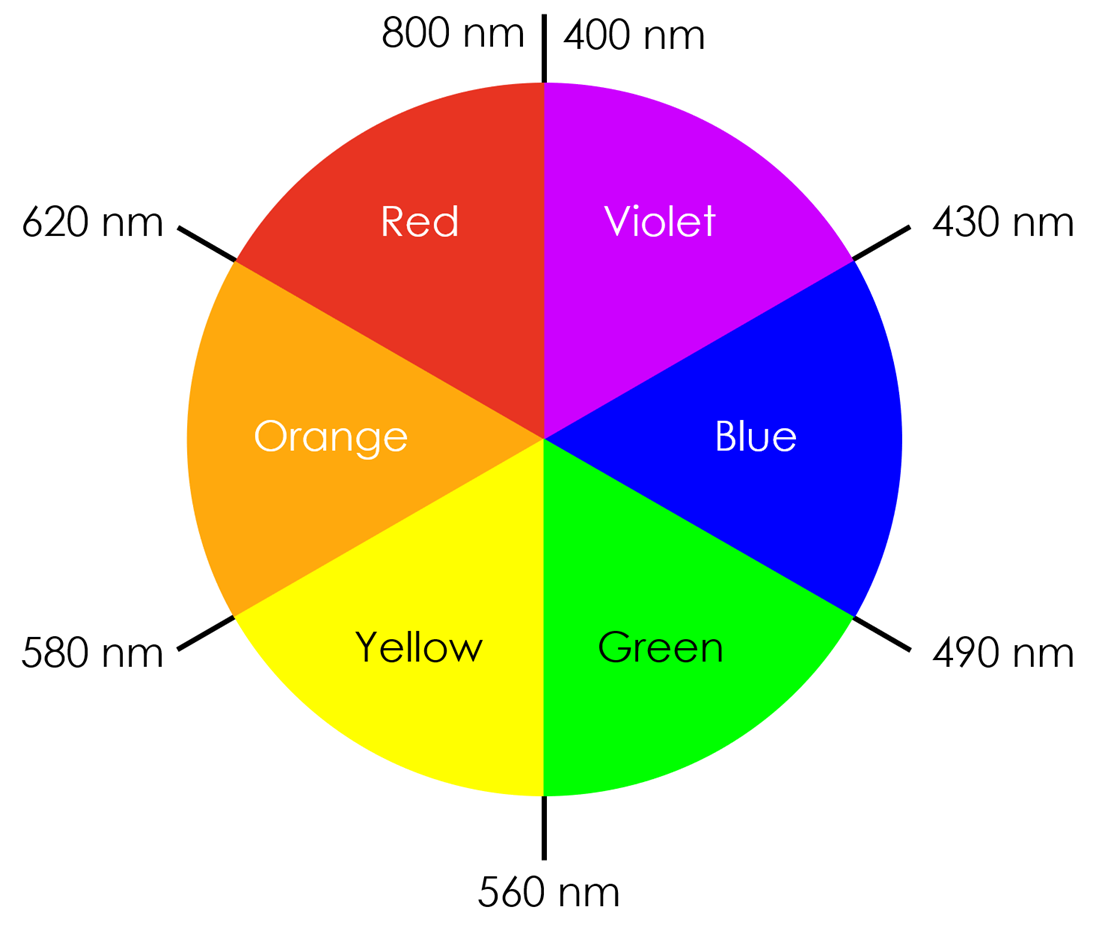
<그림 4>의 흡수 스펙트럼을 통해 구리 이온은 수용액 상태에서 주로 600 ~ 800 nm 부근의 빛을 흡수하는 것을 알 수 있으며, <그림 6>의 보색 관계에 따라 구리 수용액은 푸르게 관찰될 것이라는 것을 예상할 수 있다.
황산 구리 수용액은 왜 푸른색일까? - 끝 -
* 본문의 내용은 2022 과학교사 실험직무연수를 위해 작성된 연수 자료 일부를 옮겨놓은 것입니다.
* 2022-04-22 그림2 Cu 전자 배치 정정
'화학 > 화학이야기' 카테고리의 다른 글
| 기체의 성질과 기체에 관한 실험 법칙 (3) | 2022.03.15 |
|---|---|
| 금속-아세틸 아세토네이트 착물의 합성 (2) | 2022.01.17 |
| 열용량 (Heat capacity) (8) | 2021.11.14 |
| 청사진 만들기 (Cyanotype) (2) | 2021.10.12 |
| 주기율표의 역사 (2) 멘델레예프의 주기율 법칙 (0) | 2021.08.28 |



