2성분 혼합물의 상평형 그림 : 지레 규칙 (Lever Rule)
이전 글(122)을 통해 휘발성 액체로 구성된 2성분 혼합물의 경우 용액과 증기가 평형 상태에 있을지라도 두 상의 조성은 같지 않다는 사실을 알아보았다. 조성 차이가 발생하는 이유는 휘발성이 큰 성분이 나머지 성분에 비해 빨리 증발하기 때문이다. 이 때의 용액 조성선과 증기 조성선을 하나의 상평형 그림에 나타내면, <그림 1>과 같다.

<그림 1>의 용액 조성선(직선)과 증기 조성선(곡선)에 의해 가둬진 영역(F =1)에서 용액과 혼합 증기가 평형을 이루고 있으며, 두 상이 공존한다.

용액과 증기가 공존하는 영역에 위치한 점 들(●)은 우리에게 두 가지 정보를 제공한다.
첫 번째, 평형을 이루는 용액상의 조성(X)과 증기상의 조성(Y)
두 번째, 평형을 이루는 용액상과 증기상의 상대적인 양(몰)
1. 용액과 증기의 조성
평형을 이루고 있는 두 상의 조성에 대해 알려준다. 해당 영역 안에 위치한 점 들(●)을 포함하는 수평 맺음선(----)을 긋는다. 수평 맺음선과 조성선이 만나는 지점이 해당 상의 조성을 나타낸다. 아래 <그림 3>은 평형을 이루는 증기와 용액 조성의 구체적인 수치를 보여주고 있다.


해당 영역 내의 점이 갖는 의미는 다음과 같다. 해당 점 자체의 조성값(ZA, x축 수치)은 전체 물질 중 차지하는 A의 분율로, 값 자체는 큰 의미가 없다.
용액상 (XA=0.09, XB=0.91)과 증기상 (YA=0.27, YB=0.79)이 평형을 이루고 있다.
용액상 (XA=0.35, XB=0.65)과 증기상 (YA=0.65, YB=0.35)이 평형을 이루고 있다. <그림 4>
용액상 (XA=0.60, XB=0.40)과 증기상 (YA=0.83, YB=0.17)이 평형을 이루고 있다.
따라서 용액과 증기가 공존하는 영역 내에서, 임의의 증기압(y축 값)을 선택하면 평형 상태의 용액과 증기의 조성은 자동으로 결정된다.
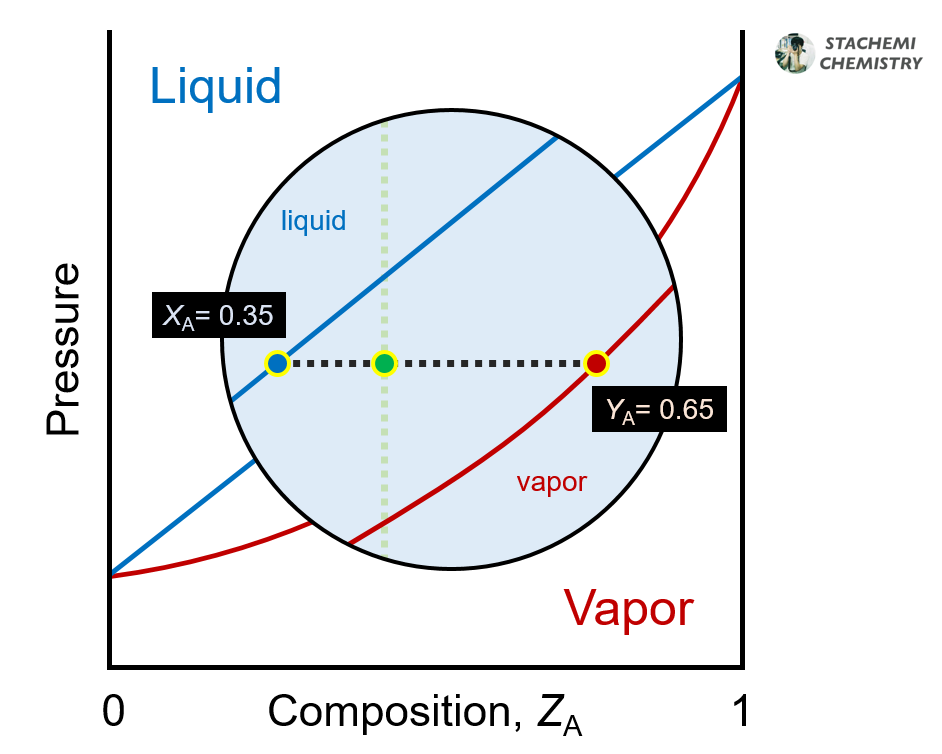
<그림 4>의 한 점은 XA=0.35, XB=0.65인 용액과 YA=0.65, YB=0.35인 혼합 증기가 평형을 이루고 있음을 보여주고 있다.
2. 용액과 증기의 양
용액과 증기가 공존하는 영역 내 점은 용액과 증기의 양을 정량적으로 보여주기도 한다. 용액과 증기의 상대적 양을 구하기 위해서는 지레 규칙(lever rule)을 사용한다. 지레 규칙은 상평형 그림의 점으로부터 각 상(용액, 증기 조성선)까지의 거리(ℓ liquid, ℓ vapor)를 측정하여 적용할 수 있다.
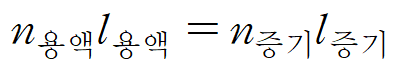
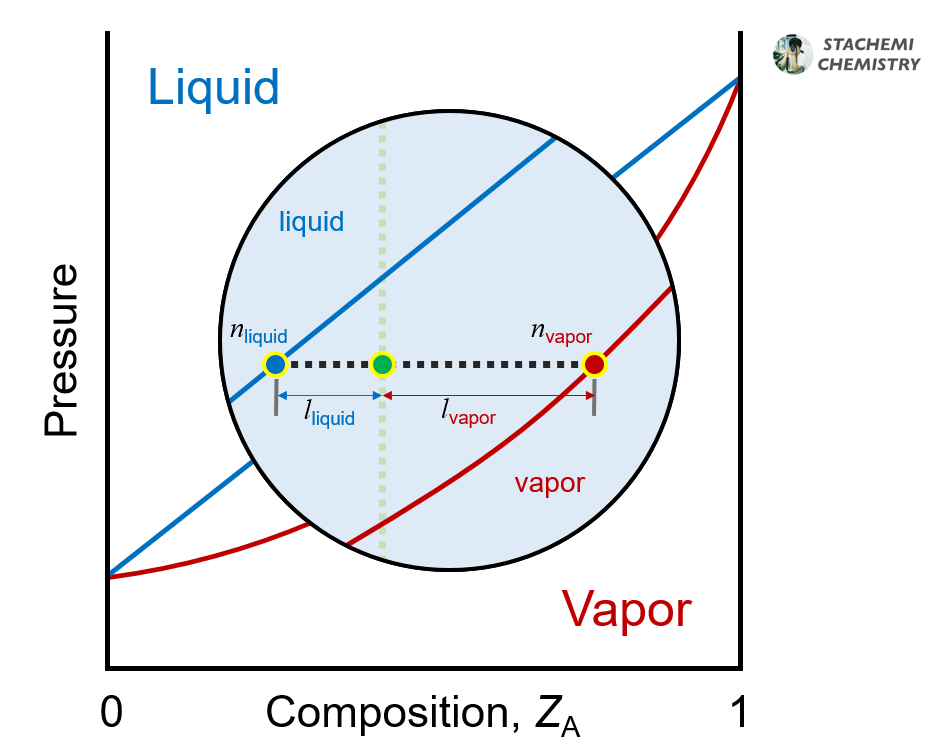
이 때 영역 내 한 점과 조성선까지의 거리가 가까울수록 해당 상의 물질량이 많다. 위 <그림 5>의 경우, 점과 용액 조성선 사이의 거리(ℓ liquid)가 점과 증기 조성선의 거리(ℓ vapor)에 약 두 배 이다. 따라서 용액의 양이 증기의 두 배가 된다.
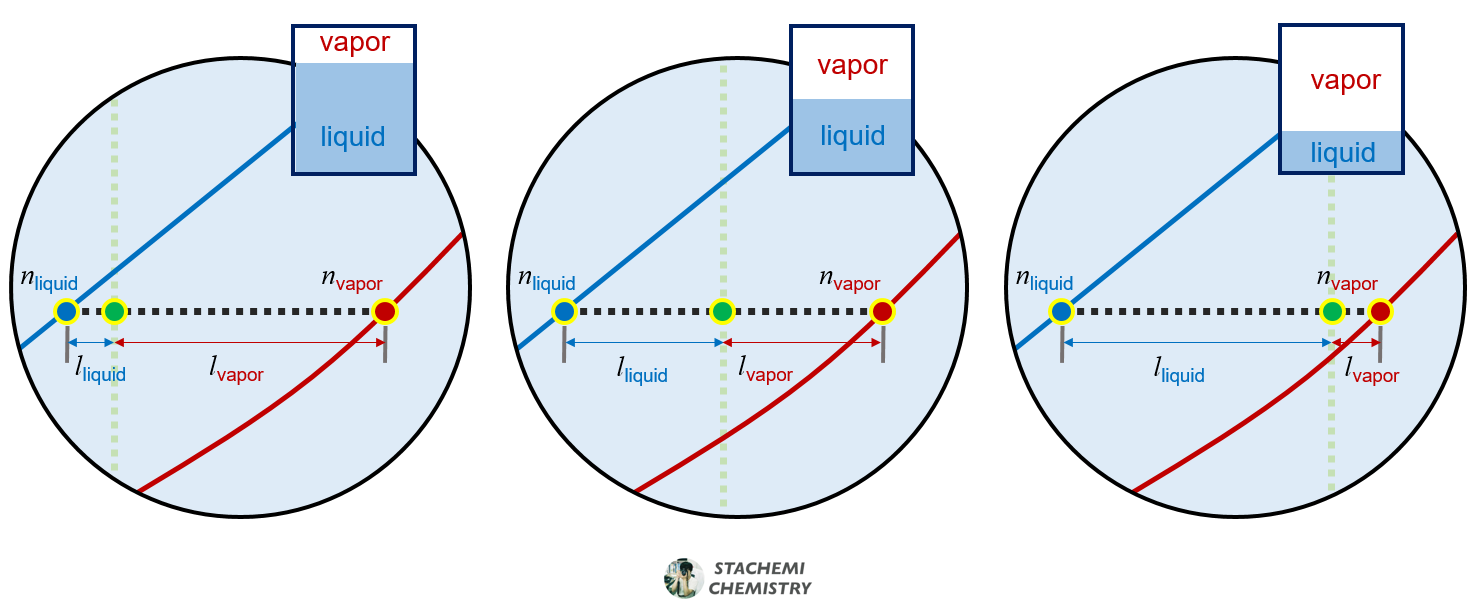
<그림 6>에 제시된 세 가지 상태는 동일한 증기압력(y축 값) 하의 평형이라는 점에 모두 동일하지만, 상평형 그림 내의 점 위치(x축 값, ZA)에 따라 용액과 증기의 물질량은 차이가 있음을 보여준다.
3. 지레 규칙의 증명
* 용액과 증기가 평형을 이루고 있는 상태를 가정하자. 이 때, 용액의 양은 n 용액, 증기의 양은 n증기라 표현했을 때, 해당 평형계 안에 전체 물질의 양은 n전체로 나타낼 수 있다. (1)
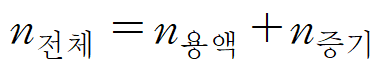
* 상을 고려하지 않은 전체 물질(n전체) 중에 포함된 A의 양(nA)만을 알고 싶다면, 용액에서의 A의 분율(xA), 증기에서의 A의 분율(yA)을 고려하여 더해주면 된다. 용액 중 포함된 A의 양은 n용액*xA이며, 증기 중 포함된 A의 양은 n증기*yA이다. (2)
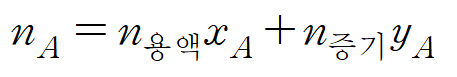
* 전체 물질(n전체)의 양과 포함된 A의 양(nA)을 통해 전체 물질 중 A가 차지하는 분율(zA)을 정의할 수 있다. (3)
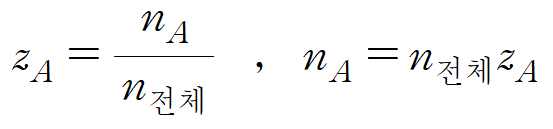
* 위의 (2)와 (3)의 nA에 관한 식을 조합하면, 다음의 관계식이 나온다. (4)
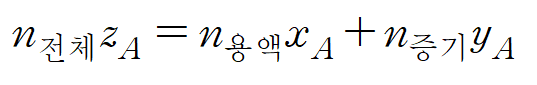
* 위의 결과 (4)에 의 n전체에 관한 관계식(1)을 대입하면 용액과 증기의 몰수에 대한 식을 얻을 수 있다. (5)
* (5)의 식을 정리하면, 우리가 증명하려던 관계식(지레 규칙)을 얻을 수 있다.
끝까지 읽어주셔서 감사합니다.
지레 규칙 - 끝 -
'화학 > 화학이야기' 카테고리의 다른 글
| 투광도와 흡광도 사이 로그 관계가 성립하는 이유 (0) | 2020.08.05 |
|---|---|
| 원자 모형의 변천 (2) 원자핵의 발견 (4) | 2020.07.28 |
| 고등학생을 위한 분광광도법 : (3) 정량분석 (8) | 2020.07.17 |
| 화학사 이야기 - 방사능(Radioactivity) (0) | 2020.07.15 |
| 원자 모형의 변천 (1) 원자 내부가 왜 궁금해진 걸까? (0) | 2020.07.12 |



