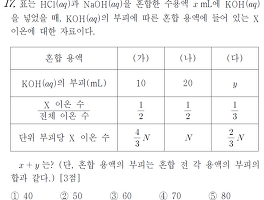
 2017학년도 10월(10.17.) 고3 전국연합학력평가 화학1 풀이 [17번]
2017학년도 10월(10.17.) 고3 전국연합학력평가 화학1 풀이 [17번] 정답: ③ 60 풀이: 이전 교육과정 문제이지만, 최근 산-염기 중화반응 문제에서 킬러 유형을 배제하면, 연습하기에는 나쁘지 않다. 물론, 그렇다고 좋아하는 유형은 아니다. 산-염기 중화적정은 미지 산 또는 염기의 농도를 밝히거나, 중화적정 그래프 및 적정 과정에서의 pH와 연계되어야 의미가 있다고 생각하는 편이다. 그래도 학생 질문에 답할 겸, 풀이를 남겨둔다. HCl + NaOH 혼합 용액 x mL에 KOH 수용액을 첨가했다. 초기 혼합 용액의 액성도, 혼합 이후의 (가), (나), (다) 용액의 액성도 현재로써는 알 수가 없다. 초기에 HCl, NaOH의 초기 농도와 혼합 비율을 모르고, 이후 첨가한 KOH 수용액의 농..
2017학년도 10월(10.17.) 고3 전국연합학력평가 화학1 풀이 [17번]
2017학년도 10월(10.17.) 고3 전국연합학력평가 화학1 풀이 [17번] 정답: ③ 60 풀이: 이전 교육과정 문제이지만, 최근 산-염기 중화반응 문제에서 킬러 유형을 배제하면, 연습하기에는 나쁘지 않다. 물론, 그렇다고 좋아하는 유형은 아니다. 산-염기 중화적정은 미지 산 또는 염기의 농도를 밝히거나, 중화적정 그래프 및 적정 과정에서의 pH와 연계되어야 의미가 있다고 생각하는 편이다. 그래도 학생 질문에 답할 겸, 풀이를 남겨둔다. HCl + NaOH 혼합 용액 x mL에 KOH 수용액을 첨가했다. 초기 혼합 용액의 액성도, 혼합 이후의 (가), (나), (다) 용액의 액성도 현재로써는 알 수가 없다. 초기에 HCl, NaOH의 초기 농도와 혼합 비율을 모르고, 이후 첨가한 KOH 수용액의 농..
 고등학생을 위한 파동 방정식, 그리고 양자수의 의미
고등학생을 위한 파동 방정식, 그리고 양자수의 의미 0. 상상하기 쉽지 않은 오비탈 모형, 그리고 양자수 보어의 궤도 모형은 고등학교 교육과정상 물리와 화학에서 비슷한 시기에 다루고, 전자가 핵 주위를 회전하는 모습이 마치, 태양계 행성들을 떠올리게끔 하여 비교적 쉽게 받아들이는 편이다. 하지만, 바로 다음에 등장하는 현대 오비탈 모형은 좀 모호하고 어렵다. 오비탈이라는 단어부터 생소하다. 영단어 orbital만 떼놓고 보면, 보어 모형에서의 orbit(궤도)와 비슷하여 뜻도 비슷하게 생각하면 될 것 같은데, 자꾸 둘은 엄연히 다르다고 하니 미칠 노릇이다. 따라서, 수업을 준비하는 교사 입장에서는 오비탈을 처음 접하는 학생들이 이마를 탁! 칠만한 적절한 비유가 간절하다. 물론, 비유물은 실제 대상을 완벽..
고등학생을 위한 파동 방정식, 그리고 양자수의 의미
고등학생을 위한 파동 방정식, 그리고 양자수의 의미 0. 상상하기 쉽지 않은 오비탈 모형, 그리고 양자수 보어의 궤도 모형은 고등학교 교육과정상 물리와 화학에서 비슷한 시기에 다루고, 전자가 핵 주위를 회전하는 모습이 마치, 태양계 행성들을 떠올리게끔 하여 비교적 쉽게 받아들이는 편이다. 하지만, 바로 다음에 등장하는 현대 오비탈 모형은 좀 모호하고 어렵다. 오비탈이라는 단어부터 생소하다. 영단어 orbital만 떼놓고 보면, 보어 모형에서의 orbit(궤도)와 비슷하여 뜻도 비슷하게 생각하면 될 것 같은데, 자꾸 둘은 엄연히 다르다고 하니 미칠 노릇이다. 따라서, 수업을 준비하는 교사 입장에서는 오비탈을 처음 접하는 학생들이 이마를 탁! 칠만한 적절한 비유가 간절하다. 물론, 비유물은 실제 대상을 완벽..
 2022학년도 10월(10.12.) 고3 전국연합학력평가 화학1 3점 문항 풀이
2022학년도 10월 고3 전국연합학력평가 화학1 3점 문항 풀이 9, 10, 12, 14, 15, 16, 17, 18, 19, 20번 한동안 바쁘다는 핑계로 문제 풀이 업로드를 하지 않았다. 매번 문제를 찾아 풀어보기는 하지만, "이게 과연 화학 문제인가?"하는 의문을 갖게하여 풀이를 업로드해야할 의욕이 생기지 않았다. 사실, 맨 뒷 장의 킬러 문항들은 나도 빠르게 풀어내지도 못하고, 풀어내도 기쁘지 않고, 아직도 문제를 통해 전달하고자 하는 화학적 의미도 못찾겠다. ... 9. 정답: ② ㄴ 더보기 그저 시간을 끌기 위한 이런 문제 싫다. 원소별로 전자배치를 해보고, 하나씩 따져주면 되기에 어려운 문제라고 말할 수는 없지만, 전자가 2개 들어있는 오비탈 수와 p-오비탈에 들어있는 전자수의 비율이 무슨..
2022학년도 10월(10.12.) 고3 전국연합학력평가 화학1 3점 문항 풀이
2022학년도 10월 고3 전국연합학력평가 화학1 3점 문항 풀이 9, 10, 12, 14, 15, 16, 17, 18, 19, 20번 한동안 바쁘다는 핑계로 문제 풀이 업로드를 하지 않았다. 매번 문제를 찾아 풀어보기는 하지만, "이게 과연 화학 문제인가?"하는 의문을 갖게하여 풀이를 업로드해야할 의욕이 생기지 않았다. 사실, 맨 뒷 장의 킬러 문항들은 나도 빠르게 풀어내지도 못하고, 풀어내도 기쁘지 않고, 아직도 문제를 통해 전달하고자 하는 화학적 의미도 못찾겠다. ... 9. 정답: ② ㄴ 더보기 그저 시간을 끌기 위한 이런 문제 싫다. 원소별로 전자배치를 해보고, 하나씩 따져주면 되기에 어려운 문제라고 말할 수는 없지만, 전자가 2개 들어있는 오비탈 수와 p-오비탈에 들어있는 전자수의 비율이 무슨..
 2022학년도 10월(10.12.) 고3 전국연합학력평가 화학1 풀이 [20번]
2022학년도 10월 전국연합학력평가 화학1 풀이 [20번] 20. 정답: ④ 50 3점 문항 풀이를 작성하던 중에 너무 부가적인 설명들이 길어져서, 별도의 글로 뺐다. 역시나 2가 산-염기를 혼합하는 문제이다. 벌써부터 쉽지 않을 예정이다. 그런데, 이번 문제는 더더욱 처음에 어떤 선택을 했느냐에 따라 풀이 시간이 매우 차이가 날 수 있기에, 그다지 좋아 보이지는 않는다. (물론, 산-염기 중화 반응을 이와 같은 유형으로 출제하는 것 자체가 마음에 들지 않는다...힘들...) 각설하고, 일단, 혼합 용액 I, II, III 모두 염기의 양은 일정하다. 넣어준 산의 몰수 따라 혼합 용액의 액성이 산성, 중성 또는 염기성이 될 수 있다. 혼합 용액이 산성이라면, H+, X2+, (Y- 또는 Z2-) 이 존..
2022학년도 10월(10.12.) 고3 전국연합학력평가 화학1 풀이 [20번]
2022학년도 10월 전국연합학력평가 화학1 풀이 [20번] 20. 정답: ④ 50 3점 문항 풀이를 작성하던 중에 너무 부가적인 설명들이 길어져서, 별도의 글로 뺐다. 역시나 2가 산-염기를 혼합하는 문제이다. 벌써부터 쉽지 않을 예정이다. 그런데, 이번 문제는 더더욱 처음에 어떤 선택을 했느냐에 따라 풀이 시간이 매우 차이가 날 수 있기에, 그다지 좋아 보이지는 않는다. (물론, 산-염기 중화 반응을 이와 같은 유형으로 출제하는 것 자체가 마음에 들지 않는다...힘들...) 각설하고, 일단, 혼합 용액 I, II, III 모두 염기의 양은 일정하다. 넣어준 산의 몰수 따라 혼합 용액의 액성이 산성, 중성 또는 염기성이 될 수 있다. 혼합 용액이 산성이라면, H+, X2+, (Y- 또는 Z2-) 이 존..