여름방학 방과후학교 수업을 준비하면서 몰래 정리해 둔 것을 블로그에 옮겨둔다.
문제를 풀어내는 것과 말로 잘 설명하는 것은 어려움의 정도가 다르고, 말로 설명한 것을 글로 옮기는 것은 또 다른 영역의 일이다. 문제를 풀고 이를 말로 설명하는 것은 직접 특성상 크게 어려움을 느끼지 않는 편이지만, 글로 옮기는 것은 매번 많이 어렵다고 느낀다.
방학 중에 14번까지만 임시 저장해놓고, 공개를 계속계속 미루었는데, 결국 2학기가 시작되어 버렸다. 마지막 문제까지 마무리지어 공개하고 싶었는데, 막상 마무리 지으려니 시간적으로 여유가 나지 않을 것 같아 일단 작성한 부분까지만 먼저 포스팅한다.
2023학년도 대학수학능력시험 화학1 풀이 [1번 ~ 14번]

정답 : ③ ㄱ, ㄴ
풀이 :
ㄱ. 에탄올은 의료용 소독제로 이용된다. (참)
ㄴ. 염화 칼슘(CaCl2)이 물에 녹는 과정은 열이 발생하는 발열 반응이다. (참)
ㄷ. 염화칼슘(CaCl2)과 메테인(CH4) 중 메테인만 탄소화합물이다. (거짓)

정답 : ④ ㄱ, ㄷ
풀이 :
(가)는 CO2, (나)는 COF2 이다.
ㄱ. X는 산소이다. (참)
ㄴ. (나)는 2 개의 C-F 결합과 1 개의 C=O 결합으로 이루어졌다. (거짓)
ㄷ. 비공유 전자쌍의 수는 (가) = 4쌍(2쌍* O 2개), (나) = 8쌍(3쌍* F 2개 + 2쌍* O 1개)이다. (참)

정답 : ⑤ ㄱ, ㄴ, ㄷ
풀이 :
A는 나트륨(Na), B는 산소(O), C는 수소(H), D는 염소(Cl)이다. A_2B는 Na2O, CBD는 HOCl 이다.
ㄱ. 금속 나트륨은 전성(펴짐성)이 있다. (참)
ㄴ. 나트륨(Na)과 염소(Cl)의 안정한 화합물은 NaCl이다. (참)
ㄷ. H2O는 공유 결합 물질이다. (참)

정답 : ④ NH3, NF3
풀이 :
분자를 구성하는 어떤 원자의 부분적인 전하의 부호는 변하지 않는다는 [가설]을 세웠으나, [탐구 결과]를 바탕으로 해당 가설이 잘못되었음으로 [결론] 지었다. 따라서 탐구 결과에서 가설을 반박하는 결과에서는 화합물에 따라 원자의 부분 전하가 변하는 사례가 제시되어야 한다.
NH3에서 질소는 부분적인 음전하를 갖지만, NF3에서는 전기음성도가 큰 플루오린에 의해 전기적으로 양성이 되고, 부분적인 양전하를 띤다. 따라서 가설을 부정하는 사례가 된다.

정답 : ② ㄴ
풀이 :
과정 (가)의 A2+ 이온 3N mol이 모두 반응하여 Bm+ 이온 2N 몰이 생성되었으므로, 반응에 관여한 전자는 6N mol이고, 생성된 B이온의 전하 m = +3이다. (ㄱ, 거짓)
2*3N = m*2N
과정 (나)의 B3+ 이온 2N mol이 금속 C와 모두 반응하여 C2+ 이온 xN 몰을 생성했으므로, 생성된 C 이온 x = 3 이다. (ㄴ, 참)
여기서 금속 C는 C2+ 이온이 되면서 스스로 산화되었고, 환원제이다. (ㄷ, 거짓)

정답 : ④ ㄱ, ㄷ
풀이 :
8번 ~ 14번 원소 중, 홀전자를 갖는 원소는 O, F, Na, Al, Si 이다. 그리고, 이 원소들의 전기음성도 순서를 비교하면, F > O > Si > Al > Na 이다. 따라서 W = F 또는 O 이고, X = Al 또는 Na 이다.
전자가 2개 들어있는 오비탈 수는 다음과 같고, Z = O , X = Al , Y = Si 이다. 전기음성도가 가장 작은 원소 X = Al 이므로, W = F 이다.
O = 1s, 2s, 2p = 3개, F = 1s, 2s, 2p*2 = 4개,
Na = 1s, 2s, 2p*3 = 5개, Al = 1s, 2s, 2p*3, 3s = 6개, Si = 1s, 2s, 2p*3, 3s = 6개
ㄱ. Z는 산소(O)이며, 2주기 원소이다. (참)
ㄴ. Ne 전자배치를 갖는 이온의 반지름은 Al3+ < F- 이다. (거짓)
ㄷ. 원자가 전자가 느끼는 유효 핵전하는 Si > Al 이다. (참)

정답 : ① ㄱ
풀이 :
(가)는 t2에서 평형에 도달했다. 평형에 도달하면, 증발 속도와 응축 속도가 같아지며, 더 이상 수증기와 물의 양에 변화가 없어진다.
평형에 도달하기까지 물의 양(액체)은 점점 감소하며, 수증기의 양(기체)은 점점 증가한다. 즉 y축 값의 분자항은 점점 감소하고, 분모항은 점점 증가하며, 막대그래프가 점점 낮아진다. 평형에 도달하면, 막대그래프의 감소가 멈춘다. (가)는 t2에서 그래프 감소가 멈추고 평형에 도달한 반면, (나)는 t3까지 계속 감소하고 있으므로 평형에 도달하지 못했다.
ㄱ. (가)에서 수증기의 양은 t2까지 점차 증가한다. 따라서 t2에서의 수증기 양 > t1에서의 수증기 양이다. (참)
ㄴ. 수증기가 물로 액화되는 반응과 물이 수증기가 되는 반응은 끊임없이 일어난다. (거짓)
ㄷ. t2일 때, (가)는 평형에 도달했으며, 증발 속도와 응축 속도가 같다. 따라서 (가)의 값을 1로 두면, (나)는 아직 평형 도달 전이기에 증발속도(분자) > 응축속도(분모)이다. 따라서 (나)는 1보다 큰 값을 갖는다. (거짓)
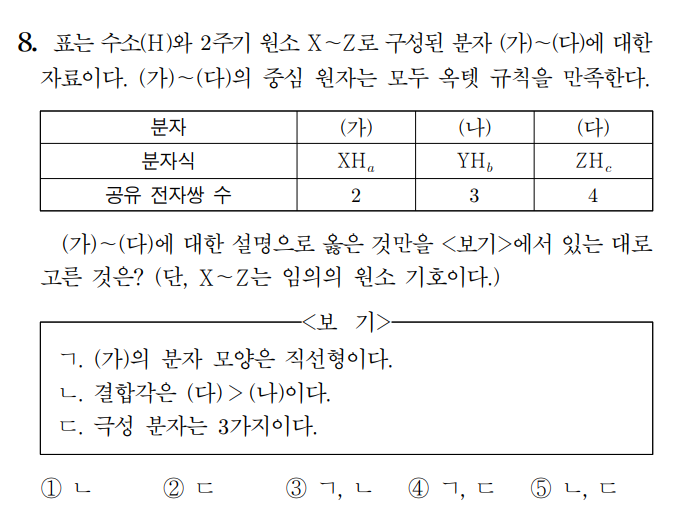
정답 : ① ㄴ
풀이 :
(가)는 H2O, (나)는 NH3, (다)는 CH4 이다. 자연스레 a=2, b=3, c=4 이다.
ㄱ. H2O의 분자 모형은 굽은형이다. (거짓)
ㄴ. 결합각은 CH4 = 109.5도, NH3 = 107도 이다. (참)
ㄷ. 극성 분자는 H2O, NH3로 2가지이다. (거짓)

정답 : ③ d2
풀이 :
(나)에서 A 수용액 10 mL에 포함된 A의 질량은 10d1 g 이다.(1 mL = d1 g 이므로...) A의 분자량이 a이므로, 포함된 용질 몰수는 10d1/a [mol]이다. 전체 용액의 부피는 100 [mL]이다.
(다)에서 A의 질량은 마찬가지로 10d1 g이며, 몰수도 (나) 같은 10d1/a 이다. 전체 용액의 질량은 100 g이며, 용액의 밀도가 d2 이므로, 용액 부피는 100 g * (1 mL/d2 g) = 100/d2 [mL] 이다.
(나)와 (다)의 용질 몰수는 같으므로, 굳이 몰농도를 구하지 않고, 용액 부피만으로도 y/x 값을 알 수 있다. 몰농도와 용액 부피는 반비례하므로, y/x = (나) 부피 / (다) 부피와 같다.
(나) 용액 부피 = 100 [mL] , (다) 용액 부피 = 100/d2 [mL] 이므로, y/x = 100 / (100/d2) = d2 이다.

정답 : ⑤ ㄴ, ㄷ
풀이 :
1) 2주기, 3주기 13, 14, 15족 원소에 해당하므로, W ~ Z 원소는 B , C , N , Al , Si , P 중 하나이다.
| 13 | 14 | 15 | |
| 2주기 | B | C | N |
| 3주기 | Al | Si | P |
2) W와 X는 다른 주기 원소이고, 원자가 전자수는 X > Y이므로, X = C, N, Si, P 중 하나이다.
3) W와 X의 (홀전자수/전자가 들어있는 오비탈 수)가 같다고 했으므로, W와 X = B 또는 P 중 하나이다.
| 13 | 14 | 15 | |
| 2주기 | 1/3 | 2/4 | 3/5 |
| 3주기 | 1/7 | 2/8 | 3/9 |
위에서 X = C, N, Si, P 중 하나였으므로, X = P , W = B 이다.
4) (s 오비탈에 들어있는 전자수/홀전자 수) 비를 살펴보면, 2주기 원소들은 분자항이 모두 4이며, 3주기 원소들은 분자항이 모두 6이다. 또한 각 원소의 홀전자수는 13족 = 1, 14족 = 2, 15족 = 3이므로, Y = C, Z = Al 이다.
| 13 | 14 | 15 | |
| 2주기 | W = 4/1 | 4/2 = 2 | 4/3 |
| 3주기 | 6/1 = 6 | 6/2 | X = 6/3 = 2 |
ㄱ. Y는 탄소로 2주기 원소이다. (거짓)
ㄴ. 홀전자 수는 붕소(W) = 1 개, 알루미늄(Z) = 1개로 같다. (참)
ㄷ. s 오비탈에 들어있는 전자 수는 인(X) = 6 , 탄소(Y) =4 이므로 3:2 이다. (참)

정답 : ⑤ ㄴ, ㄷ
풀이 :
n+l 값이 2, 3, 4에 해당하는 조건(n, l, m)은 각각 다음과 같다.
n+l = 2 = (2, 0, 0) = (가) = 2s 오비탈
n+l = 3 = (3, 0, 0) (2, 1, 0) (2, 1, +1) (2, 1, -1)
n+l = 4 = (4, 0, 0) (3, 1, 0) (3, 1, +1) (3, 1, -1)
(2, 0, 0)에 해당하는 오비탈의 (n+l+m)/n 을 구해보면, (2+0+0)/2 = 1 로, 문제에서 주어진 y축 값을 모두 6으로 나누면, 실제 값이 나온다. (라) = 8/6 = 4/3, (다) = 9/6 = 3/2, (나) = 12/6 = 4/2 로 바꾸어 쓸 수 있다.
(라) = (3, 1, 0) = 3p 오비탈 , (다) = (2, 1, 0) = 2p 오비탈 , (나) = (2, 1, +1) = 2p 오비탈이다.
ㄱ. (나)는 2p+1 오비탈이다. (거짓)
ㄴ. 수소 원자의 에너지 준위는 2s와 2p0가 같다. (참)
ㄷ. m 값은 (가)2s 와 (라)3p0가 같다. (참)

정답 : ④ ㄱ, ㄷ
풀이 :
W ~ Z는 14족 ~ 16족 원소인 C, O, Si, P 중 하나이다. 제4 이온화 에너지와 제5 이온화 에너지 사이의 차이가 크게 나타나는 W, X가 14족임을 짐작할 수 있으며, 제5 이온화 에너지가 더 큰 W = C , 작은 X = Si 임을 알 수 있다.
X = Si 이므로, 원자반지름 경향성에 따라 Y = P , Z = O 임을 알 수 있다.
ㄱ. X = Si 이다. (참)
ㄴ. 탄소(W)는 인(Y)과 같은 주기 원소가 아니다. (거짓)
ㄷ. 산소(Z)와 인(Y)의 제2 이온화 에너지를 비교하는 것은 전자배치상 질소(Z)와 규소(Y)의 제1 이온화 에너지를 비교하는 것과 같으므로, Z > Y 이다. (참)

정답 : ② 24w
풀이 :
초기 반응물의 질량은 w, 생성된 XZ의 질량은 0.56w 이므로, 생성된 YZ2의 질량은 0.44w 이다.
일정 온도, 압력 조건에서 120 mL YZ2 기체가 발생했으므로 몰수로 변환하면, 0.12 [L] * (1 mol/24 L) = 1/200 mol 이다.
YZ2의 분자량은 0.44w*200 = 88w [g/mol]이 된다.
반응물, 생성물 모두 계수비가 1 : 1 : 1 이므로, 0.56w [g]의 XZ 몰수도 1/200 [mol] 이다.
질량과 몰수 관계에 따라 XZ의 분자량 = 0.56w*200 = 112w [g/mol]이고, 원자량 비가 5 : 2 이므로 X = 80w , Z = 32w 이 된다.
따라서 Y의 원자량 a = 88w - (32*2w) = 24w

정답 : ③ 7 + 3 = 10
풀이 :
산화-환원 반응에서 관여한 총 전자수는 같아야 한다. 반응식에서 산화종은 Y이며, 환원종은 X이다. Y는 +(n-1)에서 +n으로 산화수가 원자당(몰당) 1씩 증가한다.
제시문에서 Y 3 mol이 반응할 때, X가 1 mol이 반응한다고 했으므로, 총 관여하는 전자수는 1*3 = 3 mol이다. 즉 X는 원자당 산화수가 3만큼 감소한다. 생성물에서의 X 산화수가 +n 이므로, 반응물 X의 산화수는 +(n+3) 이다.
반응물에서 X의 산화수 = (n+3) , Y의 산화수 = (n-1) 이며, 비율이 3 : 1이라고 주어져 있으므로,
3(n-1) = n+ 3 이고, 2n = 6 , n = 3 이다.
또한, X2Om2- 이온의 산화수를 바탕으로 m 값을 구하면,
2(n+3) + (-2*m) = -2, n=3을 대입하면, 2m = 14 이므로, m = 7 이다.
15번부터 ~ 20번까지 이후 계속 ....
* 위 문제의 출처는 한국교육과정평가원이며, 정답 및 해설 강의는 EBSi 사이트에서도 확인하실 수 있습니다. 풀이에 오류가 있는 경우 댓글로 알려주시면, 수정하여 반영하겠습니다. 감사합니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2024학년도 대학수학능력시험(2023.11.16.) 화학1 풀이 [1~20번] (0) | 2023.11.19 |
|---|---|
| 2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (1번~10번) (3) | 2023.10.22 |
| 2023학년도 대학수학능력시험(2022.11.17.) 화학2 풀이 [13번 ~ 20번] (0) | 2023.08.21 |
| 2023학년도 대학수학능력시험(2022.11.17.) 화학2 풀이 [1번 ~ 12번] (0) | 2023.07.15 |
| 2024학년도 수능 6월 모의평가(2023.6.1.) 화학1 3점 문항 풀이 (0) | 2023.06.07 |



