[이전 글] 1~12번 풀이 https://stachemi.tistory.com/305
2023학년도 대학수학능력시험(2022.11.17.) 화학2 풀이 [1번 ~ 12번]
0. 들어가기 서울대에서 과탐2 필수 응시 조건을 풀어버린 스노우볼이 올해 어떻게 굴러갈지 궁금하다. 물화생지2는 안그래도 응시자수가 얼마 없었는데, 앞으로의 학생들은 2과목을 응시할 이
stachemi.tistory.com

[정답] ④ - 2x + 1220
[풀이]
1몰 메탄올의 생성 반응을 작성해보자. 생성 반응은 가장 안정한 홑원소 물질로부터 생성물 1몰이 만들어지는 변화로 나타낸다. 다음 반응의 엔탈피 변화가 - 201 kJ 이다.

메탄올의 생성 반응을 결합엔탈피 관점으로 보기 위해서는 모든 결합을 깨어 기체 상태의 원자로 만든 뒤, 새로운 결합을 만들어 생성물에 도달하게끔 하면 된다.
(단계 1) 모든 결합을 깨어 기체 상태 원자로 만드는 과정은 다음과 같으며, 이 과정에서의 엔탈피 변화는 - x + (2*436) + (0.5c) kJ 이다. - x 는 흑연의 승화 과정, +(2*436)은 H_2의 원자화 과정, +0.5c는 O_2의 원자화 과정이다.

(단계 2) 다음은 기체 원자들이 재조합되어 새로운 결합을 형성하는 과정이다. 이 과정에서의 엔탈피 변화는 C-H 결합의 형성 - 3a, C-O 결합의 형성 - b, O-H 결합의 형성 - 463 이다. 따라서 - 4a - b - 463 kJ 이다.

단계 1과 단계 2가 연속으로 일어나면, 그 크기는 생성 엔탈피 변화와 같다. 즉,
- x + (2*436) + (0.5c) - 3a - b -463 = - 201 이며,
(정리하면,) 3a + b - 0.5c = - x + (2*436) - 463 + 201 이며,
(양변을 2배 해주면,) 6a + 2b - c = - 2x + 2(610) = - 2x + 1220

[정답] ④ 3/2
[풀이]
온도가 일정하므로, 압력과 부피의 곱은 몰수에 비례한다. 계산 편의를 위해 그냥 몰수라 여기자. (PV = n )
피스톤에 의해 외부압력 1기압과 평형을 이루고 있는 A의 몰수는 1 atm * 3L = 3 mol, 강철용기 내 B의 몰수는 1 atm * 2 L = 2 mol, 반응에 참여하지 않는 비활성기체 He의 몰수는 x atm * 2 L = 2x mol이다.
화학반응식의 계수가 모두 완성되었고, 반응이 완결되어있다고 주어졌으므로, 반응 후의 기체 몰수 관계를 쉽게 알 수 있다. 한계반응물은 양이 적은 2 mol의 B이며 모두 반응하여 소진된다.
완결 후 남아있는 A는 3 - 2 = 1 mol, 반응식 계수 비에 따라 생성된 C는 1 mol, 생성된 D는 2 mol이다.
ICE
반응이 끝난 뒤 남아있는 전체 기체는 1 mol의 A, 1 mol의 C, 2 mol의 D, 2x mol의 He 이다. 반응 후 C의 몰분율이 1/5라고 주어져 있으므로, 전체 기체 몰수는 5 mol이어야 하고, He의 몰수는 1 mol이다.
즉, x = 1/2 이다.
반응 후 전체 기체의 압력은 피스톤 외부 1 atm과 평형을 이루어야 하고, 전체 기체 몰수가 5 mol이기 때문에 PV = n 에 따라 전체 부피 V는 5 L가 되어야 한다. 따라서 실린더 내부 부피 y = 3 으로 변화가 없다.
문제가 요구하는 값인 xy = 3/2 이다.

[정답] ⑤ ㄴ, ㄷ
[풀이]
초기에 A와 C가 존재하고, 속도식을 통해 1차 반응임을 알 수 있다. 1차 반응은 반감기가 일정하다. 반감기가 일정하다는 것은 초기 농도와 무관하게 어떤 시점을 시작점으로 잡아도 농도가 절반으로 감소하는데 걸리는 시간이 일정하다는 뜻이다.
C의 질량 백분율과 전체 질량이 100 g이어야 하므로, 초기 C = 10 g, A = 90 g 있었다고 생각할 수 있다.
0-3분 동안 생성된 C는 30 g 이며, 3-6분 사이에는 7.5 g 이 만들어졌다. 0-3분 사이 늘어난 C의 양(30 g)에 비해 3-6분 사이 늘어난 C의 양(7.5 g)은 1/4밖에 되지 않는다. 증가율이 기존 증가율의 1/4이라는 뜻은 반감기를 두 번 거쳤다는 뜻이다. 3분 동안 반감기를 2회 거쳤으니, 0에서 6분 사이에는 총 4번의 반감기를 거쳤다.
0-3분 까지 생성된 C의 질량 전체 질량을 계산해보면, (초기 질량) + (1차 반감기 생성량) + (2차 반감기 생성량) = 10 g + k + (k/2) = 40 이다. k = 20이며, 반감기 1회당 C 는 20 g, 10 g, 5 g, 2.5 g 순차적으로 생성되어 6 분이 되었을 때는 표에 주어진 것처럼 47.5 g이 된다.
1.5 분 경과(반감기 1 회) 시점에서의 반응물 생성물 질량과 몰수 관계를 살펴보면, A는 90 g의 절반인 45 g이 반응하여 사라지며, C는 20 g이 생성된다. A 45 g = 2 mol이라면, C 20 g = 1 mol이다. 전체 질량은 100 g을 언제나 유지해야 하고, A + B + C = 45 + B + 30 = 100 g 이다. 생성된 B는 25 g 이며, B 25 g = 2 mol 이다.
(분자량) A = (45/2) g/mol , B = (25/2) g/mol , C = 20 g/mol
ㄱ. 초기 A와 C의 몰 수를 비교하면, x = 8y 이다. (거짓)
A = x mol = 90 g * (2/45 mol/g) = 4 mol
C = y mol = 10 g * (1/20 mol/g) = 0.5 mol
ㄴ. 6 분일 때, 남아있는 A의 몰수는 초기 몰수의 1/16이므로,
A 몰수 =4 mol * (1/16) = 1/4 mol 이며,
B는 2 mol + (2/2) + (2/4) + (2/8) = (16 + 8 + 4 + 2)/8 = 30/8 mol
C는 47.5 g * (1/20 mol/g) = 95/40 = 19/8 mol 이다.
B는 전체 (2 + 30 + 19) 중 30 을 차지하므로, 몰분율 = 30/51 = 10/17 이다. (참)
ㄷ. 1차 반응의 순간 반응 속도는 각 해당 시점에서의 반응물 농도에 비례하므로, 3 분일 때의 반응 속도가 6 분에서의 반응 속도의 4 배이다. (참)

[정답] ① 6
[풀이]
반응 전후, 온도는 T 로 일정하다. 압력과 부피의 곱은 기체 몰수에 비례한다. 계산 편의상 PV = n 이라 하자.
30 L 용기와 20 L 용기 각각에 반응물 A, B가 있으며, 각각 평형에 도달한다. 평형을 구성하는 세부적인 몰수는 차이가 있겠지만, 결국 평형 상수는 a로 같다. 30 L 강철 용기를 먼저 살펴보자.

용기의 부피가 30 L 이므로, 평형 상수는 다음과 같다.

20 L 강철 용기도 같은 방법으로 계산하면,

이 반응의 평형 상수 또한 나타내보면,

두 강철 용기의 평형 상수는 같아야 하므로,

생성된 C는 각각 2 mol , 1 mol이다. 계산한 x 값을 바탕으로 평형상수를 구하면, K = a = 5 이다.
평형 상태 I 에서 30 L 강철 용기에는 A = 3 mol , B = 4 mol , C = 2 mol 총 9 mol 존재하며, PV = n 이라 했을 때, P2 = 9/30 = 3/10 atm 이다.
평형 상태 Ⅱ 에서는 전체 용기가 60 L로 늘어나며, A = 3 + 2 + 1 = 6 mol , B = 4 + 2 = 6 mol , C = 3 mol 이 존재하며, 해당 몰수를 이용하여 반응지수 Q 를 구하면, Q = K = 5 로 평형 상태임을 알 수 있다.
앞선 평형 상태 I 과 마찬가지로 PV = n 을 통해 P1을 구하면, P1 = 15/60 = 1/4 atm 이다.
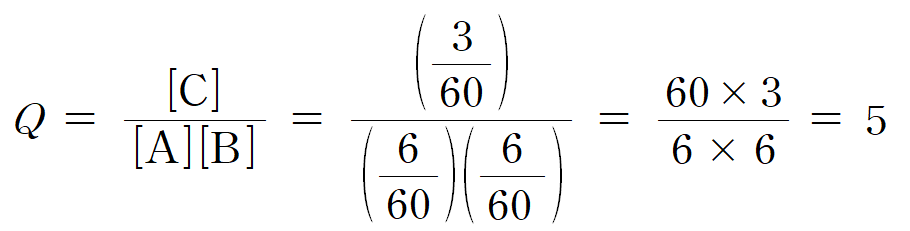
문제에서 요구하는 값은 a * (P2 / P1) = 5 * (12/10) = 6 이다.

[정답] ② 1/5
[풀이]
문제에서 주어진 농도 분율은 [X] / ([X]+[XH+]) 형태로, [짝염기]/[전체 화학종]이다. 달리 말하면, 짝염기 X가 4만큼 존재할 때, 전체 화학종은 5에 해당하며, 짝산인 XH+은 1만큼 존재한다는 뜻이다.
수용액 (가)의 혼합전 0.1 M의 X 100 mL 조건이므로, X로 이루어진 모든 화학종(짝산+짝염기)의 초기 몰수는 10 mmol 이며, 2x M의 HCl 20 mL를 첨가한 뒤에는 짝염기 X로 8 mmol이, 짝산 XH+로 2 mmol이 존재한다.
즉 첨가된 HCl의 몰수는 2 mmol이며, 2x M * 20 mL = 2 mmol 이고, x = 1/20 이다. HCl의 농도는 0.1 M, Y 수용액의 농도 = 1/20 = 0.05 M 이다.
수용액 (나)는 0.1 M HCl 50 mL = 5 mmol 이 첨가된 상황이므로, 반당량점에 해당한다. 반당량점에서는 짝산과 짝염기의 비율이 같아지며, pH = 짝산의 pKa와 같다. 짝산 XH+의 pKa = 9 이며, 짝염기 X의 pKb = 5 이다.
따라서 Kb = 10-5 이며, α = 10-5 이다.
수용액 (다)는 0.05 M Y 수용액 100 mL에 0.1 M HCl 20 mL 이 첨가된 상황이며, 초기 염기 Y의 양은 5 mmol, 첨가된 HCl의 양은 2 mmol이다. 첨가된 산에 의해 짝산 형태인 YH+ 는 2 mmol 이 생성되며, 여전히 3 mmol의 Y는 짝염기 형태로 남아있다. 따라서 문제에서 주어진 농도 분율 y = 3 / (3+2) = 3/5 이다.
수용액 (라)는 0.05 M Y 수용액 100 mL에 0.1 M HCl 50 mL 이 첨가된 상황이며, 초기 염기의 양은 5 mmol, 첨가된 산의 양도 5 mmol이다. 해당 지점은 중화점이며, 강산과 약염기의 반응에 의한 중화점 pH는 생성된 짝산 HY+의 가수분해에 의해 7보다 작아진 것(산성 용액)을 알 수 있다.
중화점에서의 pH는 남아있는 짝산의 초기농도와 Ka 값에 의해 결정된다. 혼합 용액의 전체 부피는 150 mL이고, 초기 Y 몰수에 해당하는 5 mmol이 모두 짝산으로 변해 YH+ 로 존재하므로, 중화점에서의 짝산 농도는 다음과 같다.
[YH+] = 5 mmol / 150 mL = 1/30 M
pH = 5, 초기 농도 c = 1/30 M이므로, pH = - log √(c Ka) 로 계산하면,
10-5 = √(c Ka) , 10-10 = c Ka , Ka = 30 * 10-10 이다.
물의 자동이온화 상수 값 Kw = Ka * Kb = 10-14 이므로, Kb = β = (1/30) * 10-4 이다.
이제 문제에서 요구하는 y * (β/α) 값을 구하면, (3/5) * [ 10-4 / (30*10-5) ] = 1/5 이다.

[정답] ② 3/4
[풀이]
반응 전후 전체 질량은 40 g으로 일정하다. (문제를 푸는 과정에서는 A의 질량을 40 g 으로 제시해준 것이 오히려 방해가 되는 감이 있다.)
밀도가 변하는 이유는 A 소모되면서 B와 2C가 생성됨에 따라 기체 입자수 변동이 생기기 때문이다. 일정 온도에서 기체 부피는 입자수에 비례하며, 반응이 진행됨에 따라 입자수가 증가하므로, 부피는 증가하고 밀도는 감소한다.
즉, 반응의 진행 방향은 9/10 → 6/7 → 4/5 방향이다.
반응 진행 순서에 따라 1), 2), 3)이라 하자.
주어진 그래프의 x축 값을 역수 취한 값을 몰수나 부피 등으로 생각할 수 있다. 기체 밀도를 역수 취한 10/9, 7/6, 5/4로 생각할 수 있으며, 분모(질량)를 모두 통분하여 질량을 72 g으로 같게 해주면 밀도의 역수는 다음과 같다.
1) = 80/72 , 2) = 84/72 , 3) = 90/72
전체 질량(분모)이 72 g 라면, 분자 값(부피)에 의해 1) 에서 80 L , 2) 에서 84 L , 3) 에서 90 L에 해당한다. 이는 전체 입자수를 똑같이 80 mol, 84 mol, 90 mol 이라고 생각해도 무방하다.
1) 에서 생성된 B는 2.5 g 이며, 3) 에서는 B가 5.0 g이 생성되었다. B가 2.5 g 생성되는 동안 전체 기체의 몰수는 80 mol → 90 mol로 10 mol 늘었다. B 2.5 g 생성당 전체 부피는 10 mol씩 증가한다는 뜻이다.
그렇다면, B가 2.5 g 생기기 이전, 반응 초기 상태의 전체 몰수는 80 mol에서 10 mol 감소한 70 mol 이라고 생각할 수 있다. A만 존재하던 초기 조건의 몰수가 70 mol이다. A 72 g에 해당하는 몰수가 70 mol 이다.
A 70 mol이 모두 반응하면, B 70 mol + C 140 mol이 되어 전체 기체 몰수는 210 mol 이 된다.
문제의 (ㄱ) 지점은 전체 부피가 84 mol 이 될 때와 같다. 반응이 완결되었을 때, 100% 진행되었을 때, 전체 몰수는 초기보다 140 mol이 증가해야 하는데, (ㄱ) 지점까지는 14 mol 증가했다. 전체 반응 완결까지의 1/10 이 진행된 지점이다.
따라서 초기 A 70 mol 중 1/10인 7 mol만 소모되어 여전히 63 mol의 A가 존재하고, 전체 몰수는 84 mol 이므로 A 몰분율은
63/84 = 3/4

[정답] ④ 23/8
[풀이]
개인적으로 화학2의 화학반응속도론 문제가 점점 산으로 가고 있음을 느낀다. 원인은 교육과정에서 다양한 화학 반응을 다루지 못하고, 반감기도 1차 반응만 제시하기 때문에 "반감기는 얼마?" 맞추기식의 본질에서 벗어난 문제가 자꾸 만들어지고 있다. 학습해야하는 양을 줄인다고, 학습 부담이 줄어드는 것이 아니다. 차라리 1차, 2차, 0차 반응 모두 배우고, 각각의 반감기 특성을 공부하던 때가 학습 부담은 더 적다고 생각한다. (개인적으로)
1차 반응이며, 따라서 반감기는 일정하다. 온도가 달라지지만, 1차 반응이므로 반감기가 일정하다는 사실은 달라지지 않는다. 물론, 서로 다른 두 온도에서의 반감기 값은 같지 않다. (가)와 (나)의 반감기는 같지 않다.
문제에서 제시한 [B의 질량/A의 질량]은 어떤 의미를 가질까? 감소한 A 질량만큼 B의 질량이 늘어난다. 감소한 분모 질량만큼 분자의 질량이 증가한다.
초기 질량을 A [g]으로 미지수를 굳이 남겨서 정리해보려고 했는데, 점점 복잡해지고 문제 풀이 과정이 수습이 안되어서 기껏 쓴 내용을 모두 지워버렸다. 그냥 임의의 숫자를 잡고 풀고 설명하는 것이 보다 직관적이고 간편하다. (에휴)
초기 A의 질량을 64 g 이라고 가정하자. 64 g으로 가정한 이유는 최소 반감기를 6번을 거치게 하기 위함이다. 표에서 0 ~ 30분까지 주어졌는데, 반감기가 5라면, 최소 6번의 반감기를 거쳐야 한다. 우리가 사용해야 할 표의 조건에 30분이 있기 때문에 굳이 64 g으로 잡았다. 반감기를 따져주기 위해서는 8, 16, 32, 64, 128 등의 값이 초기 질량으로 적절하다.

반응이 진행됨에 따라 반응물 A가 점점 감소하면, 생성물 B는 점점 증가한다. A가 감소한만큼 B가 생기므로 감소한 A 양 (g)과 증가한 B 양 (g)은 같다. 표의 반응 (가)의 10분과 30분 사이의 [B/A] 값이 21배 이므로, 2차 반감기와 6차 반감기에 해당함을 알 수 있다.

즉, 반응 (가)의 반감기는 5분이다.
-
반응 (나)는 초기 A와 B의 질량을 알 수 없다. 따라서 지문에서 주어진 조건을 활용하는 수밖에 없다. (가)에서 20분 B 몰수 : (나)에서 10분 A 몰수 = 1 : 2 라고 주어져 있다. 그런데, 화학 반응식을 통해 추가적으로 알 수 있는 사실이 있는데, A의 분자량 : B의 분자량 = 2 : 1 이다.
몰수 [mol] * 분자량 [g/mol] = 질량 [g] 이므로,
반응 (가) 20분에서 B 질량 : (나) 10분에서 A 질량 = 1*2 : 2*1 = 1 : 1 이다. 즉, (나) 10분에서의 A 질량은 똑같이 60 [g]이다.
(가)와 (나)의 온도는 다르고, (가)와 반감기가 달라야 하므로 (나)의 반감기는 5분이 아니다. 반감기가 10분이라 가정했을 때의 표는 다음과 같다. 10분이라는 가정에 모순이 발생하면, 다른 시간으로 돌아가야 한다. 역량이 부족한 탓인지 다른 논리적인 방법이 떠오르지는 않는다.

10분에서의 A 질량이 60 [g]이므로, B의 질량은 240b [g]가 되며, 반감기 이전의 A 질량은 10분에서의 2배인 120 [g], B 질량은 60 [g]이 증가하기 이전이므로, 240b - 60 [g] 이 된다. B의 질량/A의 질량 = b 이므로, 반감기가 10분이라면, b = 0.5 이다.
0 ~ 10분 사이 관계로 구한 b = 0.5 가 10 ~ 20분 사이에도 해당하는지 확인해보면, 2차 반감기이므로, A 질량은 10분에서의 절반인 30 [g]이 되고, B의 질량은 30 [g]이 증가하여 240b + 30 [g] 이 된다. 다행이도 b = 0.5일 때, B 질량/A 질량 = 10b 를 여전히 만족한다. 따라서 반응 (나)의 반감기가 10분임을 알 수 있다. (휴~)
-
문제에서는 각 반응에서의 시간대 별 전체 압력 비를 구하도록 하고 있는데, PV = nRT 에서 부피는 V 로 일정하므로, P ∝ nT 에 해당한다. 결국, 몰수(n)는 해당 A, B의 질량(g)을 화학식량(g/mol)으로 나누어 찾을 수 있으며,
(가)의 15분에서 질량이 A = 8 [g] , B =56 [g] 이며, 화학식량을 A = 2, B = 1이라 한다면, A = 8/2 = 4 [mol], B = 56/1 = 56 [mol]이 존재하여 총 60 [mol]이 존재하며, 이 때의 압력 P1 ∝ nT1 이므로, P1 = 60T1 이라 할 수 있다.
(나)의 30분에서는 A 질량 = 15 [g], A 몰수 = 15/2 = 7.5 [mol], B 질량 = 165 [g], B 몰수 = 165/1 = 165 [mol]이 존재하여, 총 7.5 + 165 = 172.5 [mol]이 존재한다. 이를 압력 P_2로 변환하면,
P2 = 172.5T2 이다.
따라서(T1/T2)*(P2/P1) = 172.5/60 = 345/120 = 69/24 = 23/8

[정답] ① 12
[풀이]
1. 부피가 곧 몰수이다.
평형 I과 II는 온도가 T 로 같으므로, 평형 상수는 a로 같다. 평형 I과 II의 차이는 꼭지의 개방 유무이다. PV = nRT 에서 온도와 압력이 T, P로 일정하기 때문에, V 는 입자수 n 에만 의존한다. 따라서 주어진 부피가 곧 몰수를 의미한다고 생각해도 무방하다. (P/RT = 1로 가정)
(가)와 (나)의 4 [g]의 B = 10 L = 10 [mol] 이라면,
(가)의 20 [g]의 C = 20 L = 20 [mol] 이다.
의 전체 몰수 = 10 + 20 + 10 = 40 [mol]
2. 평형 I에서 꼭지를 열고, 평형이 이동해서 II에 도달해도 전체 질량 [g]은 변하지 않는다.
평형 I에서의 전체 질량은 (가)의 24 [g] + (나)의 4 [g], 평형 II에서 전체 질량은 28 [g]이다. 평형 II에서 기체 밀도는 꼭지를 개방한 이후이므로, (가)와 (나)가 같으며, 전체 질량은 언제나 28 [g] 이다. 표의 II에서 밀도가 49/80 [g/L]라고 주어졌는데, 실제 질량은 28 [g]이므로,
II에서의 전체 부피 = 28 [g] * 80/49 [L/g] = 320/7 [L] 이다.
II에서의 전체 몰수 = 320/7 [mol] 이다.
3. 꼭지를 열고 평형 II에 도달한 뒤, 부피가 320/7 [L]로 증가하였다.
전체 부피가 증가했다는 뜻은 평형 이동을 통해 전체 몰수가 증가했음을 뜻한다. 초기 몰수가 40 [mol] = 280/7 [mol] 이었으므로, 꼭지를 열고 평형 이동을 통해 증가한 몰수 = 40/7 [mol]이다.
화학 반응식의 계수를 통해 알 수 있는 사실은 2몰의 C가 완전히 반응하면, 2몰의 A와 1몰의 B를 생성하는 역반응이 진행되고, 전체 입자수는 1 몰 만큼 증가한다. 평형 이동을 통해 증가한 전체 몰수가 40/7 [mol]이므로, 생성물 C가 80/7 [mol] 만큼 감소하고, A가 80/7 [mol] 생기고, B가 40/7 [mol] 생겼음을 알 수 있다.

평형II의 평형 상수 a 는 다음과 같다.

평형 III에서는 온도가 7T/6 가 되었으므로, 전체 몰수가 같더라도 온도가 T 일 때보다 실제 부피가 7/6 배 증가한다. 표에서 제시된 평형 III에서의 밀도가 1/2이므로, 질량 28 [g]을 대입하면, 전체 부피는 56 [L]가 된다. 온도가 T 로 일정했다면, 부피는 56 [L]의 6/7에 해당하므로, 전체 부피는 48 [L]이고, 몰수는 48 [mol]에 해당한다. 초기 40 [mol] 보다 8 [mol] 만큼 수가 증가했다고 할 수 있다.

평형 III에서의 평형상수 b 는 다음과 같다.

따라서 a/b는 8 이다.
4. 평형 I은 꼭지를 열기 전의 평형이며, 평형 상수는 II와 같다.
평형 상수는 a이고, 평형 I에서의 전체 질량은 24 [g]이다. 초기 부피는 30 [L]이며, B 10 [mol]과 C 20 [mol]이 존재한다. 평형에 존재하는 전체 기체 몰수가 전체 부피와 같으므로, 평형에서의 몰수를 구하면 된다.

평형에서의 전체 입자 수는 2n + (10+n) + (20-2n) = 30 + n [mol] 전체 부피는 30+n [L]이다. 평형I의 평형 상수 a = 1이므로, 값을 대입하면,
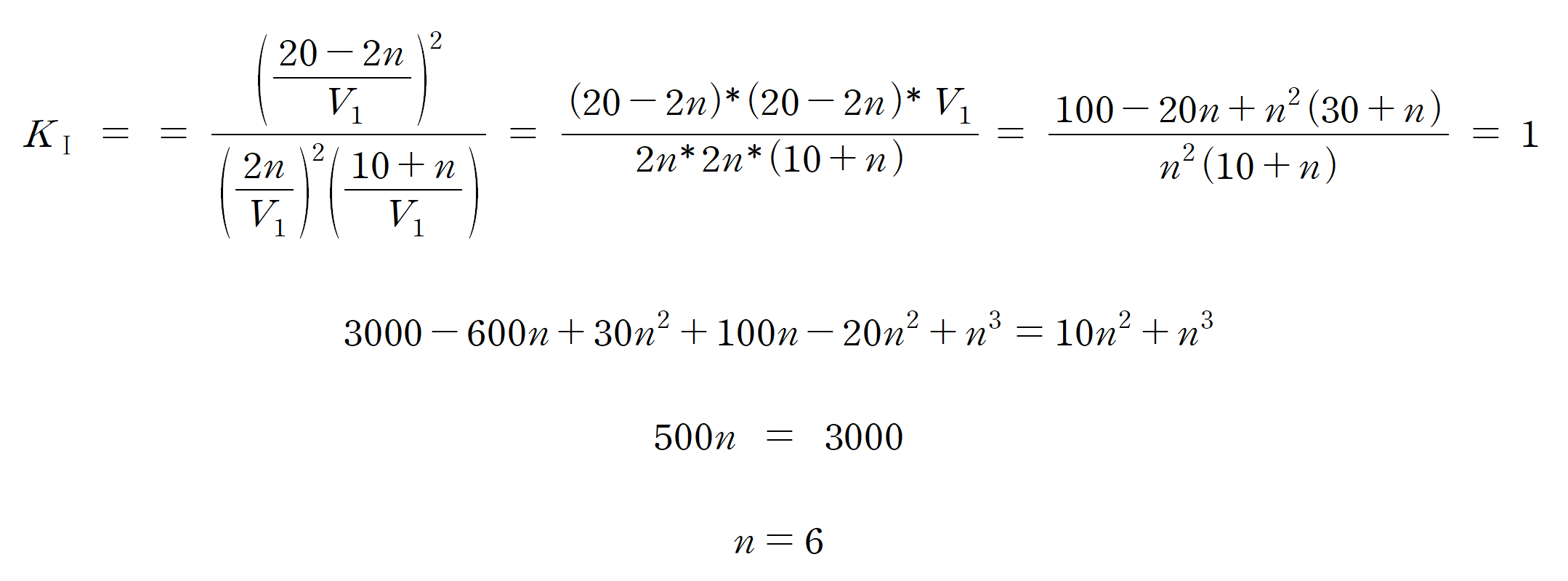
전체 부피가 36 [L], 전체 질량은 24 [g] 이므로, 평형I에서의 밀도 x = 2/3 [g/L] 이다. 문제에서 요구하는 a/bx = 12 이다. (정말 쉽지 않다...)
- 끝 -
* 위 문제의 출처는 한국교육과정평가원이며, 정답 및 해설 강의는 EBSi 사이트에서도 확인하실 수 있습니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (1번~10번) (3) | 2023.10.22 |
|---|---|
| 2023학년도 대학수학능력시험(2022.11.17.) 화학1 풀이 [1번 ~ 14번] (0) | 2023.08.22 |
| 2023학년도 대학수학능력시험(2022.11.17.) 화학2 풀이 [1번 ~ 12번] (0) | 2023.07.15 |
| 2024학년도 수능 6월 모의평가(2023.6.1.) 화학1 3점 문항 풀이 (0) | 2023.06.07 |
| 2024학년도 수능 6월 모의평가(2023.6.1.) 국어 지문 [8~11번] (0) | 2023.06.01 |



