평형 이동과 공통이온효과 | Common-ion Effect
1. 평형 이동과 르 샤틀리에 원리 (Le Chatelier's Principle)
평형 상태에 놓인 계에 외부 자극이 가해지면, 기존의 평형 상태가 깨지고 다시 평형에 도달하고자 반응이 진행된다. 이를 평형 이동이라 한다.
프랑스의 화학자 르 샤틀리에(Henry Louis Le Chatelier, 1850-1936)는 1884년, 평형 이동 방향을 연구하여 르 샤틀리에 원리(Le Chatelier's Principle)를 제안하였다.

"Any change is one of the variables that determines that state of a system in equilibrium causes a shift in the posion of equilibrium in a direction that tend to counteract the change in the variable under consideration."
"평형 상태에 가해진 외부 자극을 최소화할 수 있는 방향으로 반응은 진행한다."
예를 들어, 평형 상태에 놓인 계에 반응물을 첨가한다면, 외부 자극(반응물 첨가)을 최소화하기 위해 반응물을 제거하는 방향(정반응)으로 반응은 진행된다는 것이다. (반응물 또는 생성물 농도 변화에 따른 평형 이동)
르 샤틀리에 원리는 물질계의 평형에 가해진 자극이나 조건이 달라짐에 따라 어떤 방향으로 반응이 진행될지를 알려주며, 이에 평형 이동의 법칙(Law of equilibrium shift)이라 부르기도 한다.
(외부 자극에 의한 평형 이동은 반응물 또는 생성물의 농도 변화, 압력 변화(부피 변화), 온도 변화 등으로 다양한 요인에 의해 일어날 수 있으며, 자세한 내용은 별도 글을 통해 알아보도록 하자.)

2. 공통 이온 효과 (common ion effect)
아세트산(CH3COOH)은 물에서 아세트산 이온(CH3COO-)과 수소 이온(H+)으로 부분적으로 이온화(해리)되며, 아래와 같은 평형 반응식을 만족한다. 25℃ 온도 기준으로 산 이온화 상수(평형 상수) Ka 는 1.75 × 10-5 이며, 평형의 위치가 반응물 쪽에 상당히 치우쳐 있는 절대적 약산이다.
CH3COOH (aq) ⇄ CH3COO- (aq) + H+ (aq)
만약, 평형 상태에 놓인 아세트산 수용액에 아세트산 나트륨(CH3COONa)을 넣으면 어떻게 될까?
아세트산 나트륨(CH3COONa)은 물에서 완전히 이온화(해리)하여 아세트산 이온(CH3COO-)과 나트륨 이온(Na+)으로 나뉘어진다. 따라서 첨가한 아세트산 나트륨에 의해 수용액 내 존재하는 아세트산 이온(CH3COO-)의 양이 많아지는 효과를 갖게 되고, 기존 아세트산 수용액의 평형이 깨진다.
CH3COONa (aq) → Na+ (aq) + CH3COO- (aq)
평형이 깨진 용액은 르샤틀리에 원리에 따라, 증가한 아세트산 이온 몰수를 줄여나가는 방향(역반응)으로 이온화 평형이 이동하고, 덩달아 용액 내 수소 이온(H+) 농도가 감소하게 된다. (pH 증가)

이와 같이, 평형 상태에 놓인 이온(ex CH3COO-)과 같은 이온이 외부에서 첨가되어, 용액 내 공통 이온 농도가 증가하고, 이런 자극을 감소시키는 방향으로 평형이 이동하는 현상을 '공통 이온 효과(common ion effect)'라 한다.
공통 이온 효과는 난용성 염과 같은 약전해질의 평형(침전 평형)이나 약산의 평형에 영향을 미치며, 일반적인 수용액 환경에 비해 침전물의 몰용해도의 감소 또는 약산 수용액의 pH 상승의 결과를 가져온다.
3. 공통 이온 효과에 따른 약산 수용액의 pH 변화
앞선 아세트산 용액과 아세트산 나트륨 첨가 상황에 대한 용액의 pH 변화를 살펴보자.
일단, 0.1 M 아세트산 수용액의 pH(일반적인 수용액 환경)는 다음과 같이 구할 수 있다.
[참고] 약산의 pH 구하기(278) https://stachemi.tistory.com/278

pH = - log[H+] = - log(0.001322) = 2.88 이다.
만약, 0.1 M 아세트산 용액 1 L에 0.1 mol의 아세트산 나트륨(CH3COONa)를 첨가하면, pH는 어떻게 달라질까? (단, 아세트산 나트륨 첨가에 따른 용액의 부피와 온도 변화 등은 무시하도록 하자.)
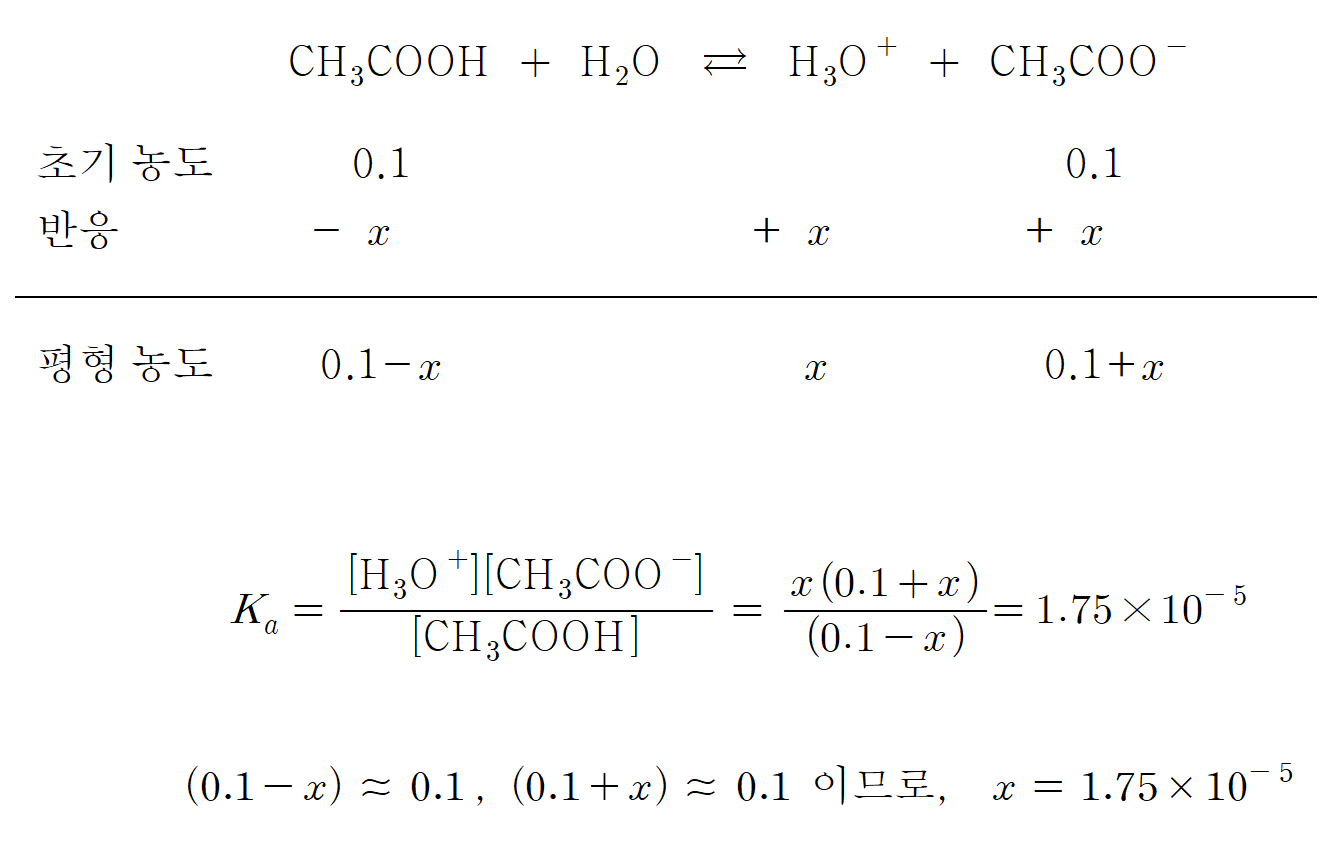
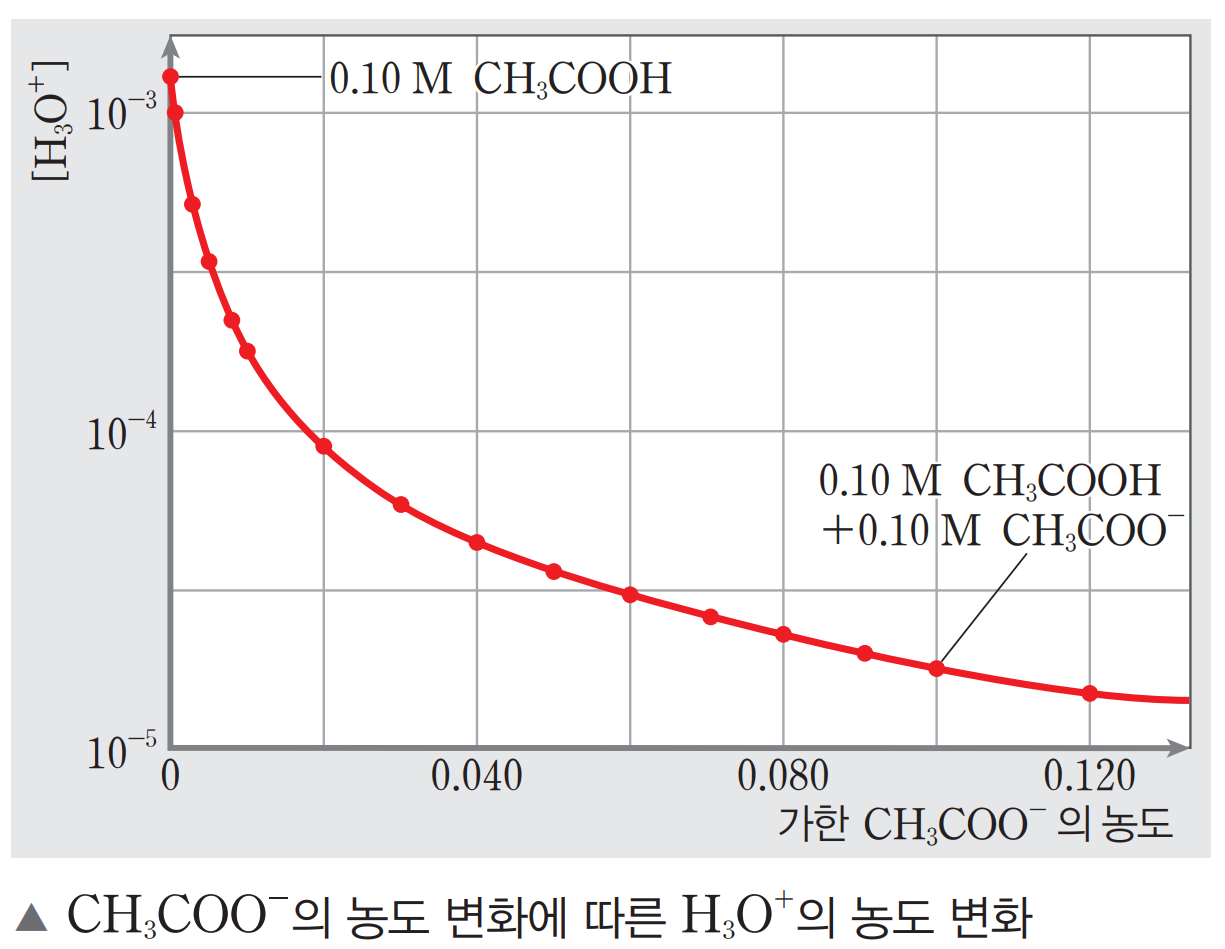
pH = - log[H+] = - log(1.75 × 10-5) = 4.75 이다. 첨가된 아세트산 나트륨(아세트산 이온)에 의해 용액의 수소 이온 농도가 감소하고, pH가 증가했음을 알 수 있다.
4. 마치며,
위의 아세트산과 아세트산 이온 조합과 같이 약산과 그 짝염기가 유의미하게 혼합된 용액은 외부 요인에 의한 pH 변화를 최소화할 수 있는 용액으로 작동할 수 있다. 외부에서 첨가되는 산(H+), 또는 염기(OH-)는 용액 내 존재하는 짝산(CH3COOH) 또는 짝염기 이온(CH3COO-) 중 하나에 의해 즉각적으로 소비되어 쉽게 제거될 수 있고, 이로 인해 용액 전체 pH에 거의 영향을 미치지 못하게 된다.
이러한 용액을 완충 용액(buffer solution)이라 하며, 완충 용액이 작동하는 원리가 공통 이온 효과에 의한 것이라고 할 수 있다. 완충 용액에 대한 자세한 설명은 다음 글을 통해 알아보고자 한다.
평형 이동과 공통 이온 효과
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
[2024-05-27 추가] 완충 용액 https://stachemi.tistory.com/320
완충 용액 (buffer solution)
완충 용액 (buffer solution) 0. 들어가기 메디컬 계열을 희망하는 많은 수의 학생이 진로선택 과목으로 화학2를 듣는다. 화학2는 메디컬 계열 진학 이후 접하게 될 내용들과 나름의 연관성을 갖기
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| [리뷰] "끼리끼리 녹인다." 개념을 가르치기 위한 용매 추출 시범 실험 (0) | 2023.08.04 |
|---|---|
| 분자 요리 (Molecular Gastronomy) (0) | 2023.07.14 |
| NH3와 NF3의 결합각 (feat. 벤트의 규칙) (7) | 2023.05.24 |
| 벤트의 규칙 (Bent's Rule) (2) | 2023.05.07 |
| 반응의 자발성과 자유에너지 (0) | 2023.04.28 |



