반트 호프 식 (van't Hoff equation)
"묽은 용액의 삼투압"
1. 삼투압
순수한 용매와 용액이 반투막을 사이에 두고 분리되어 있을 때, 순수한 용매가 용액 속으로 이동하려는 자발적인 경향을 삼투 현상(osmosis)이라 한다.
이러한 용매의 유입을 완전히 막기 위해서는 용액 쪽에 별도의 압력을 가해주어야 하는데, 이때 필요한 최소 압력을 삼투압(osmotic pressure, Π )으로 정의한다.

묽은 용액의 삼투압은 용액 내 포함된 용질의 몰농도에 의존하며, 다음과 같은 반트 호프 식(van't Hoff equation)으로 나타낼 수 있다. (CB = nB/V = 용액의 (용질) 몰농도)
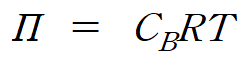
2. 반트 호프식의 증명
용액에 가해진 삼투압의 크기를 구하기 위해서는 서로 다른 압력(p vs p + Π ) 하에 평형을 이루고 있는 용매와 용액 관계에 주목해야 한다.
순수한 용매(A)에 용질(B)이 첨가되어 용액을 구성하면, 성분 A의 몰분율은 감소(xA < 1)하고, 그에 따라 화학 퍼텐셜(chemical potential, μ)도 낮아진다.

용액 내 A의 낮아진 화학 퍼텐셜을 순수한 용매 상태일 때 값으로 되돌리기 위해서는 기존 압력(p)보다 더 높은 압력(p + Π )이 필요하다. 추가로 가해진 압력 Π 의 크기에 따라 용액 내 A의 화학 퍼텐셜(μ )은 순수 용매 A의 화학 퍼텐셜(μ*)과 평형을 이룰 수 있다.

평형에서의 용매와 용액의 화학 퍼텐셜은 다음과 같이 쓸 수 있다.(1)

높은 압력(p + Π ) 하의 용액 내 A의 화학 퍼텐셜(μA(p + Π ))은 다음과 같이 쓸 수 있다.(2)

압력에 따른 효과( p → p + Π )를 고려하기 위해, 다음 '압력에 따른 몰 깁스 자유에너지(Gm)의 변화식'을 이용한다.
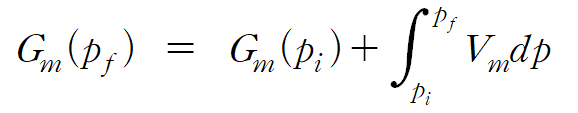
압력에 따른 몰 깁스 자유에너지 변화식을 적용하여 높은 압력에서의 순수한 용매 A의 화학 퍼텐셜(μA*(p + Π ))을 다시 나타내면, 다음과 같다.(3) 여기서 Vm은 순수한 용매 A의 1몰 부피이다.

위의 (1)과 (2)의 식을 결합하면, 다음 식을 얻을 수 있으며,

위의 식과 (3)식을 결합하면, 순수한 용매의 화학 퍼텐셜(μA*) 항을 모두 소거해줄 수 있다.

매우 묽은 용액(xB ≒ 0)의 경우 ln(xA) = ln(1 - xB) = - xB로 나타낼 수 있으며, 적분 압력 구간 역시 매우 좁아지기 때문에 용매의 1몰 부피(Vm)가 압력 변화에 대해 일정한 값을 갖는다고 가정할 수 있다. 이렇게 Vm을 적분 기호 밖으로 내보내 정리하면, 다음과 같다.

매우 묽은 용액의 경우 xB = nB /ntot ≒ nB/nA 로 나타낼 수 있으며, nA*Vm 은 용매의 전체 부피 V 로 나타낼 수 있으므로, 다음과 같이 정리된다.
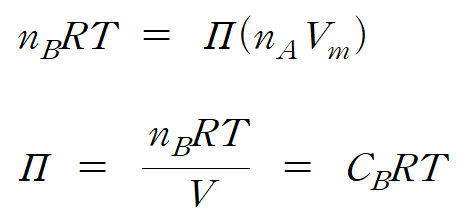
반트 호프 식 : 묽은 용액의 삼투압
-끝-
* 끝까지 읽어주셔서 감사합니다. 내용 중 오타나 문맥상 오류가 있는 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리도록 하겠습니다.
[참고한 책] Peter Atkins, Physical Chemistry 10th, Part 5B.2 (e)
[참고] 관련 글: 삼투와 삼투압, 그리고 농도 평형(190)
삼투와 삼투압, 그리고 농도 평형
[ 긴 글 주의 ] 삼투와 삼투압, 그리고 농도 평형 "그래서 언제까지 일어나는 건데?" 0. 들어가기 고등학교 화학2, 용액 단원에서는 총괄성(colligative property)을 다룬다. 학생들은 증기압 내림, 끓는
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| [스크랩] 용해도 규칙 (Solubility Rule) (0) | 2020.12.01 |
|---|---|
| 분자 궤도함수 이론 (Molecular Orbital Theory, MOT) (2) | 2020.11.27 |
| 삼투와 삼투압, 그리고 농도 평형 (22) | 2020.11.22 |
| 두 종류의 반응물로 이루어진 2차 반응 (3) | 2020.11.09 |
| 화학 반응의 속도 (6) | 2020.11.07 |



