2019학년도 PEET 화학추론(일반화학) 기출문제 9번 풀이 + 유사 기출

[풀이]
문제에서 요구하는 것은 크게 두 가지 입니다. 강철 용기를 가열했을 때, 내부의 변화를 예측할 수 있는가? 그리고, 그 변화 과정을 상평형 도표에 표현할 수 있는가? 입니다. 문제를 해결하기 위해 짚고 넘어가야 할 부분을 순차적으로 살펴보면,

1. 먼저 강철 용기라는 표현은 전체 부피가 일정하게 유지되고 있음을 의미합니다. 특히 내부 기체 몰수가 많아지면, 부피가 일정하기 때문에 압력이 증가한다는 뜻입니다.
2. 첫 번째 그림에서 액체와 기체는 공존하며, 평형에 도달한 상태라고 명시되어 있습니다. 즉, (가) 상황을 상평형 도표에 나타내면, 액체-기체 평형 곡선(증기압 곡선) 위 임의의 한 점(P1, T1)에 해당한다는 뜻입니다. <보기>의 모든 변화 시작점 (가)의 위치가 증기압 곡선 위 P1, T1 임을 확인할 수 있습니다.
3. 평형 상태에 놓인 강철 용기를 가열 합니다. 가열하면, 온도가 높아집니다. 상평형 도표에서는 오른쪽 방향(→)으로 미소하게 이동하여 평형을 벗어나려 합니다. 하지만, 온도가 높아지면 액체의 휘발성이 즉시 커집니다. 따라서 액체는 증기를 즉각적으로 만들며, 계의 증기압이 미소하게 높아집니다.(↑) 동시에 액체가 기화하는 과정에서 주위 열을 흡수해야 하니, 온도는 즉시 미소하게 낮아지려 합니다.(←) 결국 상평형 도표에서 미소하게 왼쪽 위 (↖)를 향해 이동하는 꼴입니다. 다시 평형 곡선 위로 돌아오게 되며, 액체와 기체가 공존하면서 안정한 평형 상태를 이룹니다.

4. 계속 열을 가해주면, 바꿔 말해 3의 과정을 반복하다보면, 계의 내부 상태가 점점 증기압 곡선을 따라 타고 올라가는 형상을 보이게 됩니다. 증기압 곡선을 타고 올라갈수록 기화가 진행되어 액체의 양은 초기보다 줄고, 기체의 양은 늘어납니다. 기체의 양이 늘지만, 전체 부피가 일정하므로, 기체의 압력(증기압)도 점점 늘어납니다.
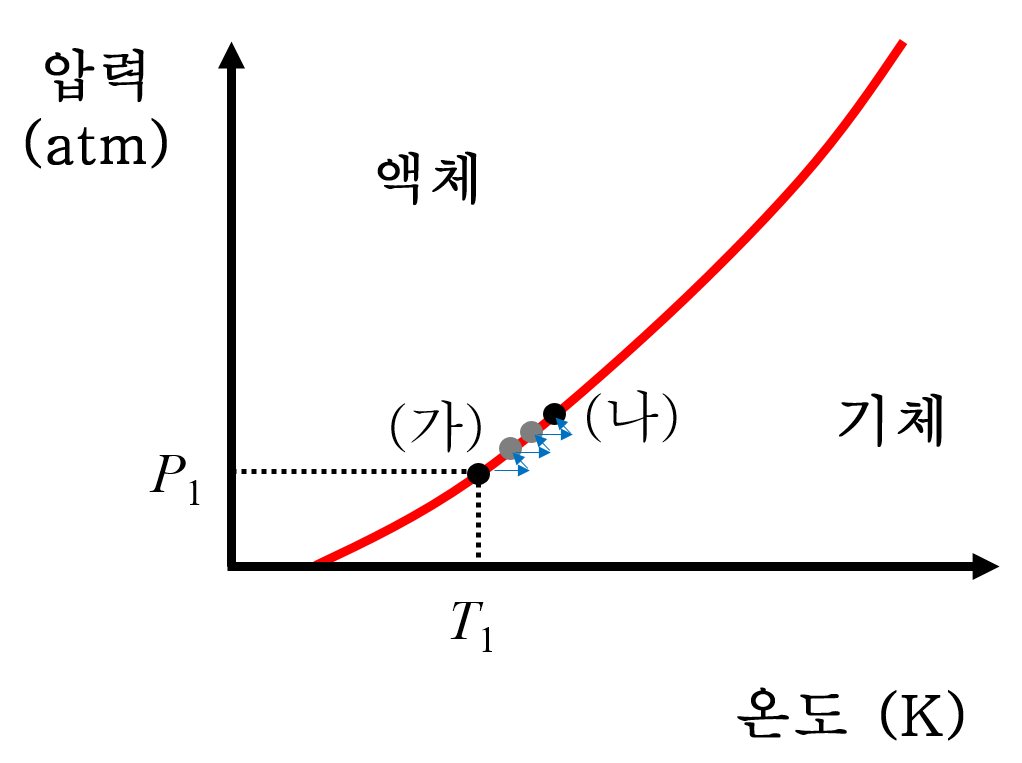
5. 결국 강철 용기 안에 마지막 액체 한 방울만 남고, 이제 거의 다 기체입니다. 다시 말해 마지막 한 방울의 액체마저 기화하면, 더이상 액체-기체의 평형 상태가 아니게 됩니다. 온도를 조금 더 높이자 마지막 한 방울의 액체마저 기화하여 강철 용기 안에는 기체만 남게 됩니다. 이후부터는 증기압 곡선(액체-기체 평형 곡선)을 벗어나게 됩니다. 이 때의 온도를 P ', T ' 이라고 합시다.
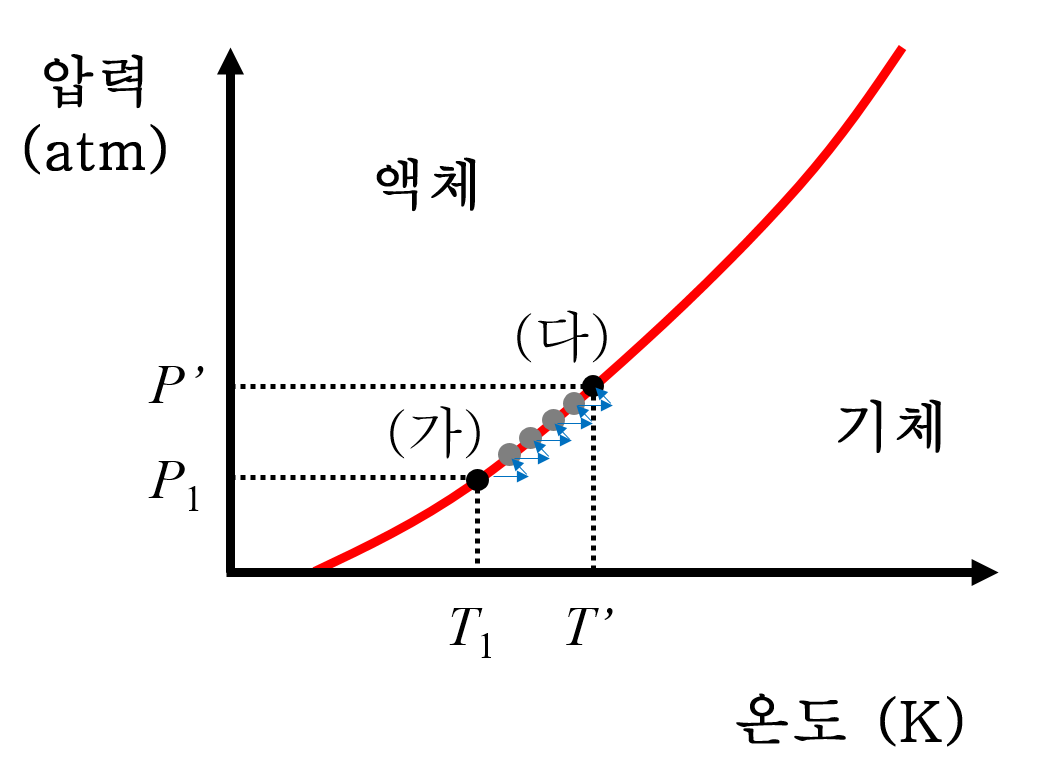
6. 기체만 남아있는 강철 용기를 계속 가열합니다. 강철 용기의 온도가 높아질테니 상평형 도표에서 오른쪽 방향(→)으로 이동하려고 하지만, 이상기체상태방정식에 따라 즉각적으로 기체의 압력도 함께 상승(↑)합니다. 부피와 기체 입자수가 일정한 상태에서 온도가 높아지면 기체 운동이 활발해져 압력이 증가하는 것은 PV=nRT를 통해 쉽게 알 수 있습니다. 이 과정에서 P = ( nR/V ) T 인데. n, R, V 가 모두 상수이니 P = kT 꼴로 직선형을 만족합니다.
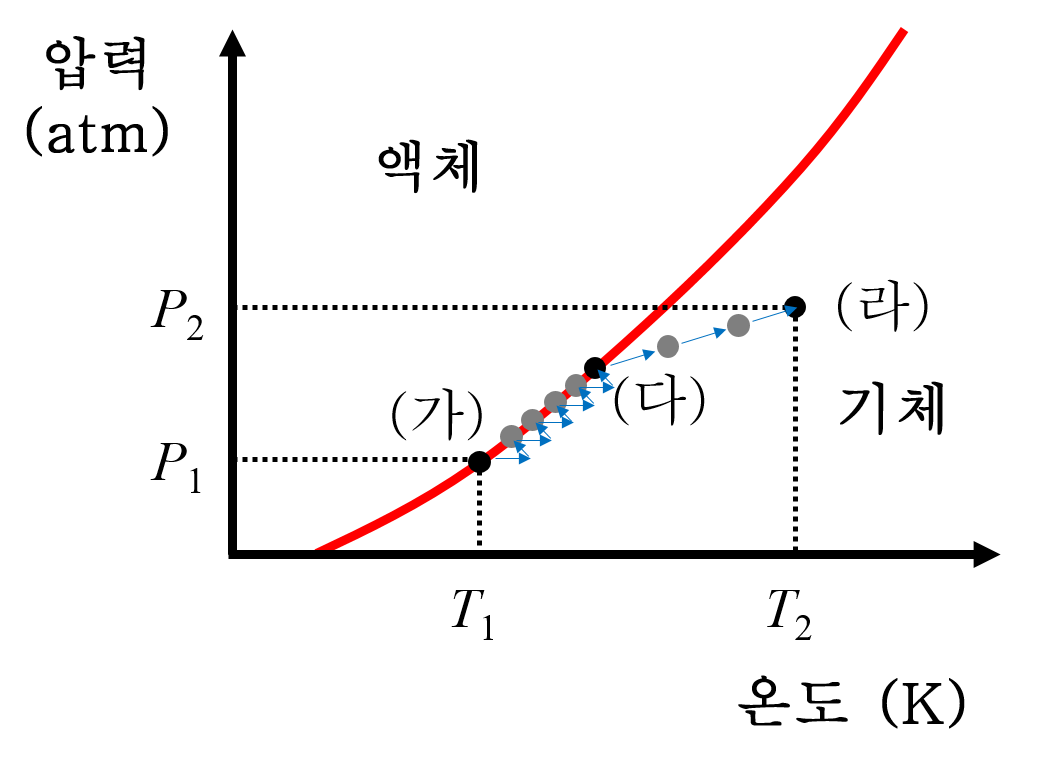
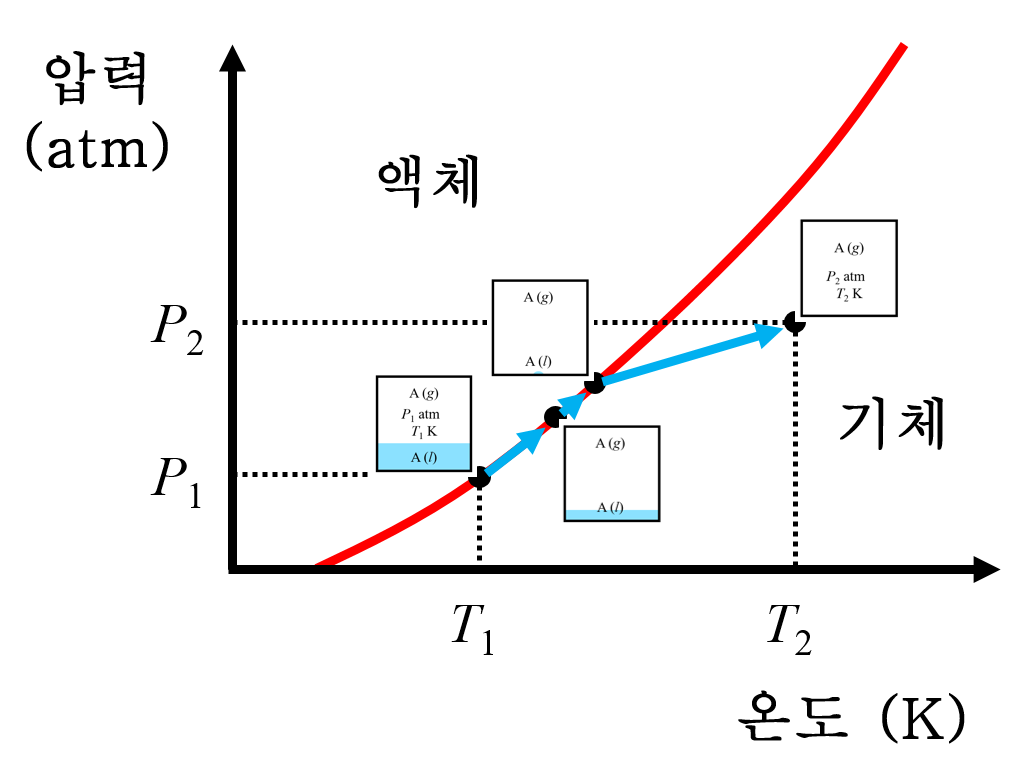
7. 전체적인 변화를 상평형 그림에 나타내면 다음과 같습니다. 해당하는 보기는 ③ 입니다.
[유사 기출] 2016학년도 10월 고3 전국연합학력평가 화학2 (2016.10.11. 시행)

위의 PEET 기출문제와 거의 유사합니다. 오히려 묻는 것이 더 많습니다. 점선(---)으로 표현된 그래프 (가)는 증기압력 곡선입니다. 점선 아랫부분은 모두 기체, 점선 윗부분은 액체 단일상이 가장 안정한 상입니다. 점선 아랫부분에 위치한 액체는 기화하며, 점선 윗부분에 위치한 기체는 액화합니다.
실선 (나)는 진공 강철 용기에 액체 A를 넣고 가열했을 때, 강철 용기 내부 상태 변화를 상평형 도표에 나타낸 것입니다. 가열을 하면, 온도가 높아지는 상황이므로, 시간 변화에 따른 화살표로 나타낸다면, (→) 방향으로 상태가 변하고 있습니다.
초기 진공 용기의 내부 압은 0인 상태이므로, 상평형 도표의 y축 압력 값이 0인 부분부터 시작합니다. 액체는 즉각적으로 기화하여 증기를 만들며, 액체가 완전히 소진되어 사라지지 않는 한 액체와 기체의 평형 상태에 도달(증기압 곡선 위에 위치)합니다.
이후 계속 가열하면, 점차 액체의 양은 줄어들고, 증기압은 즉각적으로 높아집니다. 위의 PEET 문제와 마찬가지로 마지막 한 방울 남은 액체마저 기화(P = a, T = t1)해버리면, 강철 용기는 기체 단일상 영역(점선 아래)에 진입하게 되며, 이 때부터는 이상기체상태방정식에 따라 압력이 선형으로 증가(P = kT )합니다. 여기까지가 주어진 <보기> 그래프에 대한 설명입니다. (a, t1) 지점은 모든 액체가 완전히 기화된 지점(마지막 액체-기체 상평형 지점)입니다.
같은 조건에서 액체의 양을 두 배로 늘리면, 액체가 모두 기화시키는데 더 많은 열에너지가 필요하며, 이에 <보기>의 경우보다 액체와 기체의 평형 상태를 더 오래 유지(모두 기체로 만드는데 많은 열이 필요)할 수 있습니다. 즉, a보다 더 높은 온도에서 완전히 기화하며, 그만큼 높은 증기압을 갖습니다. 다시 말해 기체 단일상에 접어드는 온도와 압력(증기압) 값이 커집니다. (2w의 액체를 넣었을 때, a, t1 지점에서는 w [g]의 액체만이 완전히 기화되었으며, 아직 w [g]의 액체가 여전히 남아 있습니다. 남은 액체 w [g]을 완전히 소모하기 전까지는 평형 상태 이므로, 증기압 곡선을 따라갑니다.)
또한 기체 단일상에 접어든 이후에는 기체 질량이 2w [g]으로 늘었기에 몰수도 두 배 증가합니다. 즉, <보기> 그래프 기울기의 2배를 가져야 합니다. ( P = 2kT )
이 모든 조건을 만족하는 그래프는 ④번 입니다.
[또 다른 유사 문제] 2015 MEET/DEET 자연과학2 기출문제 5번 : https://stachemi.tistory.com/47
2015 MEET/DEET 자연과학2(일반화학) 기출문제 5번 풀이
2015 MEET/DEET 자연과학2(일반화학) 기출문제 5번 풀이 개요 처음 문제를 접했을 때, 도대체 무엇을 묻고자 하는지에 감이 오지 않을 수 있습니다. 물의 상평형 그림과 함께 상전이 과정에서의 엔탈�
stachemi.tistory.com
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트 하도록 하겠습니다. 위 문제의 출처는 http://www.kpeet.or.kr 한국약학교육협의회 사이트입니다.
* 아울러 첨부한 유사기출문제는 2016년 10월 11일 시행되었던 고3 전국연합학력평가 화학2 문제이며, 출처는 서울특별시교육청 http://ww.sen.go.kr 학력평가자료실입니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2021 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 (6번-10번) (0) | 2020.08.18 |
|---|---|
| 2021 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 (1번-5번) (2) | 2020.08.17 |
| 2020학년도 7월(7.22.) 고3 학력평가 화학1 3점 문항 풀이 (0) | 2020.07.26 |
| 2021학년도 수능 6월 모의평가(2020.6.18.) 화학1 3점 문항 풀이 (0) | 2020.06.19 |
| 2020학년도 4월(5.21.) 고3 학력평가 화학2 3점 문항 풀이 (2) (0) | 2020.05.25 |



