2020학년도 4월(5.21.) 고3 학력평가 화학2 3점 문항 풀이 (2)
< 16번 ~ 20번 >
2020학년도 4월(5월 실시) 고3 학력평가 화학2 3점 문항 풀이 (1) : https://stachemi.tistory.com/112
2020학년도 4월(5.21.) 고3 학력평가 화학2 3점 문항 풀이 (1)
2020학년도 고3 4월(5월 21일) 학력평가 화학2 3점 문항 풀이 (1) <6번, 10번, 11번, 12번, 15번> 학교 현장에서 화학2를 선택하는 학생은 매우 드물다. 그래서인지 화학1 보다 화학 교과에서 주로 다루는 �
stachemi.tistory.com
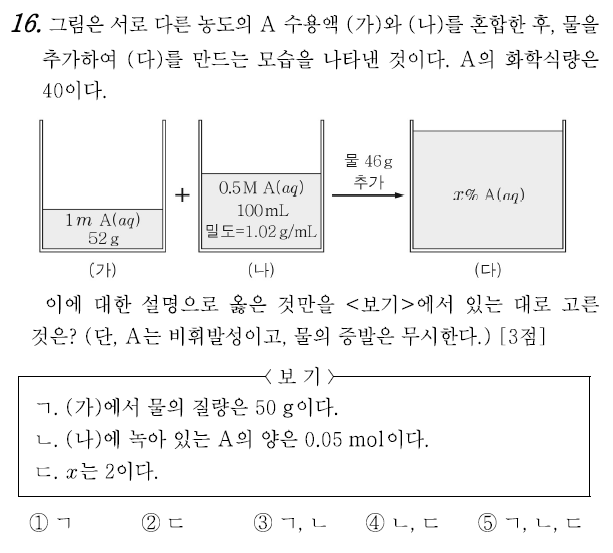
16번 ⑤
농도는 분율 개념으로 (관심대상/전체)로 표현된다. 몰농도는 용액의 부피 당 포함된 용질의 입자수(몰수)다. 문제의 (가)는 몰랄농도, (나)는 몰농도, (다)는 퍼센트농도로 표현되었지만 어떤 농도로 표현되었는가는 그다지 중요하지 않다. 각 용액에 포함된 용질의 입자수를 찾는 것이 가장 먼저 해결해야 할 과제다.
ㄱ. (가) 1 m(몰랄농도)는 1 mol 용질이 1 kg의 용매에 녹아있다는 의미다. 즉, 40 g(1 mol)의 A가 1000 g의 물에 녹아있는 것과 같은 농도다. 용질과 용액의 비례식을 통해 (가) 용액에 포함된 용질 A의 질량을 구하면, 다음과 같다.
40 g : 1040 g = (가) : 52 g (가) = ( 52 * 40 ) / 1040 = 2 g
따라서 물의 양은 52 - 2 = 50 g 이다. (참)
ㄴ. (나)의 밀도 값을 통해 용액의 질량과 부피를 알 수 있다. 밀도가 1.02 g/mL 이므로 용액 100 mL는 102 g의 질량을 갖는다. 몰농도는 0.5 M이므로, 용액 1 L에는 0.5 mol(20 g)의 용질이 포함되어 있다. (나) 용액 100 mL에는 2 g(0.05 mol)의 용질이 포함되어 있다. (참)
ㄷ. (가)와 (나) 용액을 더한 (다) 용액에는 2+2 = 4 g (0.1 mol)의 A가 포함되어 있다. 용액의 질량은 52 + 102 + 46 = 200 g 이다. 용액의 퍼센트 농도는 2%이다. (참)
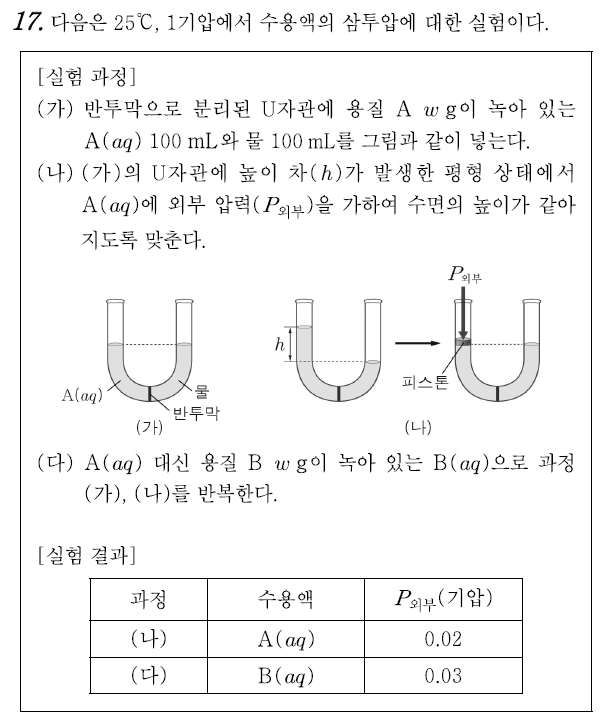

17번 ⑤
삼투압은 반투막으로 분리된 두 용액의 농도 차이에 의해 발생한다.농도 차이에 의해 용매가 이동하면서 U자관의 양 쪽의 수면 높이 차가 발생하는 것을 삼투 현상(osmosis)이라 하며, 이러한 높이 차를 없애기 위해 가해주어야 하는 압력이 삼투압(osmotic pressure)이다. 삼투압의 크기는 용액의 몰농도 차이와 용액의 온도에 의해 다음과 같은 관계식을 갖는다.
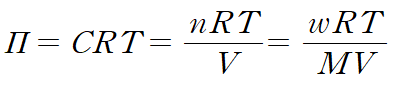
ㄱ. 실험결과에서 B의 삼투압이 A의 삼투압보다 큰 것으로 보아 B의 초기 농도가 A의 초기 농도보다 컸다는 것을 알 수 있다. (참)
ㄴ. 삼투압 식을 통해 삼투압과 분자량이 반비례함을 알 수 있다. 삼투압의 비는 A : B = 2 : 3 이므로, 분자량은 (1/2) : (1/3)이다. 따라서 3 : 2이다. (참)
ㄷ. 2w g에는 w의 2배만큼의 입자가 포함되어 있다. 삼투압은 용질의 입자수에만 의존하는 총괄성이므로, 삼투압은 (나)의 2배인 0.04이다. (참)
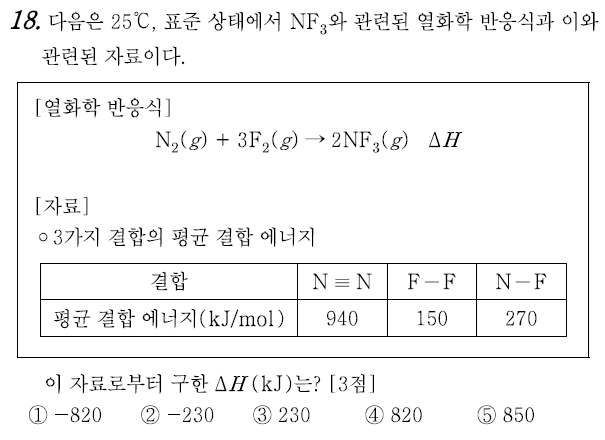
18번 ②
평균결합에너지를 이용하면, 대략적인 반응열(엔탈피 변화)을 예상할 수 있다. 결합에너지는 결합을 끊어 원자상태로 만드는 과정에 필요한 에너지이다. 문제의 열화학 반응식을 세 단계로 구분해보면,
1. N2 → 2N (N≡N 3중 결합을 1개를 끊어내야 하므로, 엔탈피 변화는 +940 kJ)
2. 3F2 → 6F (F-F 결합 3개를 끊어내야 하므로, 엔탈피 변화는 150*3 = +450 kJ)
3. 2N + 6F → 2NF3 (N-F 결합 3개씩 2분자를 만들어내며, 결합을 통해 안정화 되므로 엔탈피 변화는 음의 부호를 갖는다. 270 * 3 * 2 = -1620 kJ)
1 ~ 3을 순서대로 거칠 때 엔탈피 변화이므로, 헤스의 법칙에 따라 940 + 450 - 1620 = -230 kJ 이다.

19번 ⑤
화학2에서는 기체 영역이 변별력을 위한 문제로 뒷부분에 출제가 되는 경향이 많다. 이번에도 19, 20번 문제가 기체 영역에서 출제되었다. MEET/DEET/PEET도 대체로 비슷하다. 유형도 점점 비슷해지고 있다. PV=nRT의 변수들 중에 일정하게 유지되는 조건은 상수취급하고, 변수 중 일부를 가정해서 풀면, 빠르게 풀 수 있다. 위 문제에서는 주어진 질량 정보에 따라 몰수를 가정하여 푸는 것이 좋다.
H2 기체와 He 기체 분자량이 각각 2, 4이므로, 실린더 왼쪽의 H2 x g 을 1몰(2 g)이라 가정하면, 오른쪽의 He 역시 1몰(4 g)이다. 강철용기에는 3x g 이 존재하므로, 3몰(6g)의 H2가 있다고 생각할 수 있다. 이를 바탕으로 <보기>를 살펴보면,
ㄱ. 과정 (가)는 온도(T)가 200 K으로 유지되고 있으며, 고정 장치로 부피(V) 또한 고정되어 있다. PV = nRT에서 V, T가 일정한 조건이다. 이 경우, 압력 P는 오직 입자수 n에만 의존한다. 주어진 질량비가 1 : 2, 분자량비가 1 : 2라는 정보를 통해 H2가 1 몰, He 역시 1 몰이라는 사실을 알 수 있다. 따라서 실린더 양쪽의 압력은 같다. (참)
ㄴ. 과정 (나)는 온도가 300 K으로 높아졌다. 즉, 모두 닫힌 용기이므로 내부 입자수(n)는 모두 일정하지만, 온도(T)가 (가)보다 1.5 배 증가했으므로, PV=nRT 의 좌측 PV 값이 1.5 배 증가한다. 예를 들어 강철 용기 내부의 상황을 비교해보면, 부피는 1 L로 고정되어 있으므로 콕(꼭지)을 열기 전 (온도 증가 직후) 강철 용기 내 H2 기체의 압력은 1.5 atm이 되는 것을 알 수 있다.
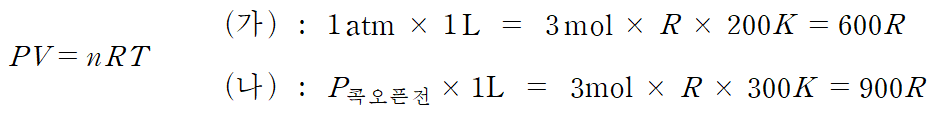
콕을 열면, 강철 용기와 실린더가 연결되어 전체 부피가 1L에서 2L로 변하며, 압력은 콕 열기전에 비해 1/2로 감소해야 한다. 반면, 입자수는 3몰에서 4몰로 증가하기 때문에 이에 따라 압력은 4/3배 증가해야 한다. 이를 동시에 고려하면, 콕을 열기 전 압력 1.5atm의 (1/2)*(4/3) = (2/3)배가 된다. 따라서 P = 1.5atm*(2/3) = 1atm이 된다. (참)
ㄷ. 과정 (나) 이후 콕을 닫으면, 강철 용기에 2 몰, 실린더에 2 몰이 가두어지며, 각 용기마다 H2 압력은 모두 1 atm이다. 반면, He은 200 K에서 1atm이었던 압력은, 온도가 300 K으로 1.5 배 증가하면서 압력 또한 1.5atm으로 증가한다. 고정 장치를 풀면, 압력이 일정해질 때까지 부피 변화를 갖게 된다. 좌측과 우측의 압력, 온도는 같아야하므로 이를 바탕으로 등식을 세울 수 있다.
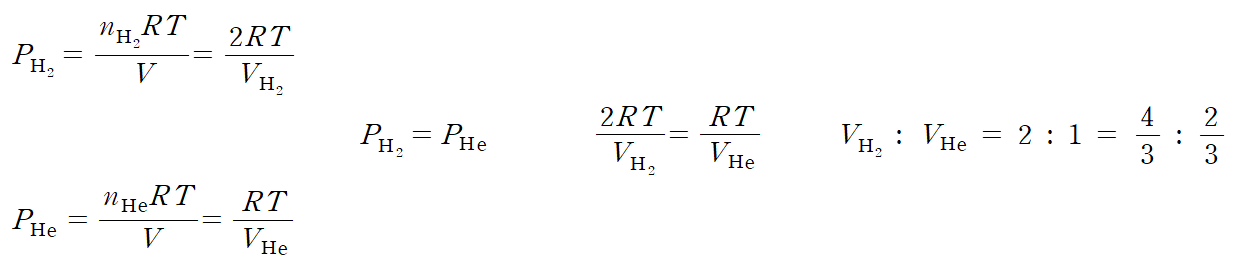
전체 부피 2 L의 2/3는 H2가, 전체 부피의 1/3은 He이 차지하게 되며, He의 부피(V)는 2 L * (1/3) = 2/3 L 가 된다. (참)
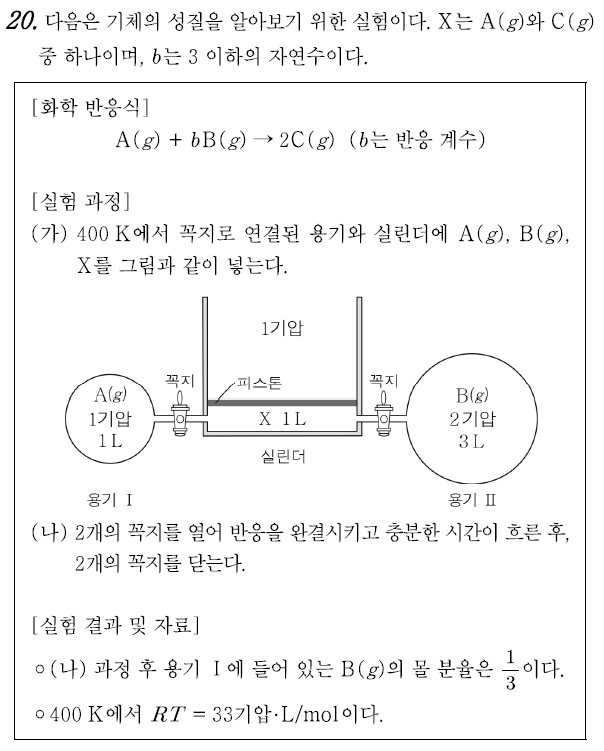

20번 ③
기체와 화학 반응의 양적 관계를 함께 다루는 문제이다. 일정 온도 조건이므로, PV = n으로 해석해서 간단하게 풀 수 있지만, 실험 자료에 RT = 33을 직접적으로 제공한 것을 보아 최종적으로는 실제 몰수를 구해야 한다는 것을 알 수 있다.
실린더의 피스톤은 대기압에 의해 평형을 유지하고 있으므로, 콕을 열기 전(반응 전) X의 기압은 1기압이라는 것을 알 수 있다. 또한 실험 결과에서 (나) 과정 후 용기 I에 B의 몰분율이 1/3이라는 것을 통해 B가 반응 후에 남아있으며, 한계 반응물이 아니라는 것을 알 수 있다. 한계 반응물은 A이다. 참고로, 반응 후 기체의 조성은 용기 I, 실린더, 용기 II가 모두 같다.
PV = 33n의 관계식(∵RT = 33) 통해 각 용기별 몰수는 PV/33 임을 알 수 있다. 용기 I의 A와 실린더의 X는 1/33몰, 용기 II는 6/33몰이다. 이후 과정에서는 편의상 1/33 값은 생략하고 식을 작성하였다.
ㄱ. 화학 반응식을 완성하기 위해서는 실험 결과로 주어진 B의 몰분율을 활용해야 한다. 아직 X가 A인지, C인지 알 수 없기 때문에 두 가지 경우를 모두 따져주어야 한다.
1) X = C 인 경우, A의 초기 몰수 = 1 mol, B의 초기 몰수 = 6 mol, C의 초기 몰수 = 1 mol
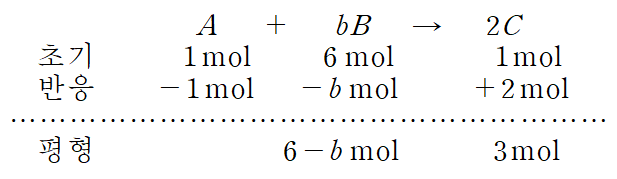
평형에 도달했을 때, 전체 기체의 몰수는 9-b 몰이며, 이 중 B의 몰수는 6-b 몰이다. 몰분율은 다음과 같이 나타낼 수 있으며, 만족하는 b 값이 없음을 알 수 있다. b는 3 이하의 자연수여야 한다.
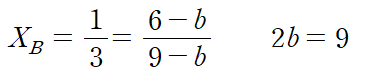
2) X = A 인 경우, A의 초기 몰수 = 2 mol, B의 초기 몰수 = 6 mol, 생성되는 C의 몰수 = 4 mol
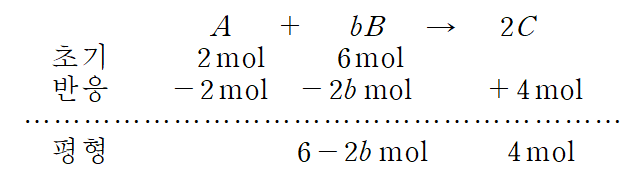
평형에 도달했을 때, 전체 기체의 몰수는 10-2b 몰이며, 이 중 B의 몰수는 6-2b 몰이다. 몰분율은 다음과 같이 나타낼 수 있으며, b = 2 라는 것을 알 수 있다. (참)
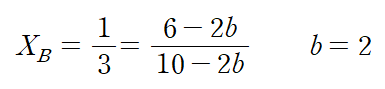
ㄴ. 이에 따라 반응 후 남아있는 기체는 B = 2/33 몰, C = 4/33 몰, 전체 기체의 몰수 = 6/33 몰이다. 반응 후 기체는 대기압(1 atm)에 도달할 때까지 부피 변화를 한다.
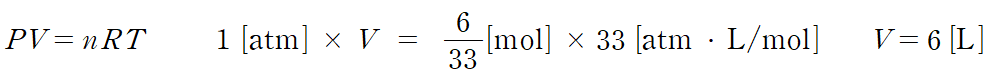
반응 후 전체 부피는 6 L가 되어야 한다. 용기 I과 용기 II의 부피가 1 L, 3 L로 고정되어 있으므로 실린더의 부피는 2 L가 될 때까지 팽창한다. (참)
ㄷ. (나) 과정 후 실린더 내부 C 기체의 몰수는 반응 후 C의 몰수*(실린더 부피/전체부피) = (4/33)*(2/6) = 4/99 몰이 존재한다. (참)
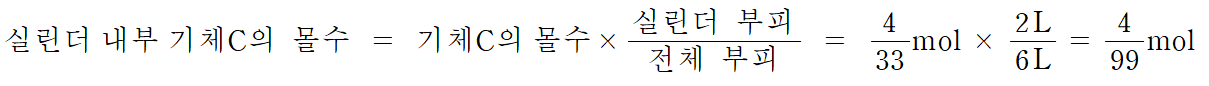
* 분문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트 하도록 하겠습니다. 위 문제의 출처는 경기도교육청과 EBSi 사이트입니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2020학년도 7월(7.22.) 고3 학력평가 화학1 3점 문항 풀이 (0) | 2020.07.26 |
|---|---|
| 2021학년도 수능 6월 모의평가(2020.6.18.) 화학1 3점 문항 풀이 (0) | 2020.06.19 |
| 2020학년도 4월(5.21.) 고3 학력평가 화학2 3점 문항 풀이 (1) (0) | 2020.05.24 |
| 2020학년도 4월(5.21.) 고3 학력평가 화학1 3점 문항 풀이 (2) (0) | 2020.05.22 |
| 2020학년도 4월(5.21.) 고3 학력평가 화학1 3점 문항 풀이 (1) (0) | 2020.05.21 |



