2020 PEET 화학추론(일반화학) 기출문제 풀이 (21번~25번)
이전 문제(1번~20번) 풀이는 다음 링크를 참고하시기 바랍니다.
1번~5번 : https://stachemi.tistory.com/93
6번~10번 : https://stachemi.tistory.com/97
11번~ 15번 : https://stachemi.tistory.com/99
16번~ 20번 : https://stachemi.tistory.com/102

21번 답 ④
문제에 주어진 반응은 크게 3 가지입니다. 첫 번째 AgI의 해리 반응, 두 번째 Ag+의 암민 착물 형성 반응, 그리고 마지막은 AgBr의 해리 반응입니다. 편의상 제시된 순서대로 (a), (b), (c) 반응이라 칭하겠습니다. (a)와 (c) 반응의 Ksp 값 비교를 통해 AgI의 순수한 물에서의 용해도가 AgBr 보다 작음을 알 수 있습니다. 즉, AgI가 AgBr보다 물에 더 안 녹습니다. 즉, Ag+ 이온이 Br-, I- 이온과 함께 존재하면 AgI 침전을 더 잘 형성합니다.
이제 문제 조건을 살펴보면, (가)는 NH3 수용액에 불용성 염인 AgI를 첨가하여 평형에 도달한 것을, (나)는 (가) 용액에 NaBr 첨가한 후 평형에 도달한 것을 나타냈습니다. (가), (나) 모두 NH3 수용액에서의 평형이므로 (b)의 착물 형성 반응에 의존합니다. 제시된 착물 형성 상수 Kf가 2*107로 매우 큰 값이므로, AgI 침전이 해리되어 생성되는 Ag+는 즉각적으로 착물 형성으로 소모된다고 할 수 있습니다. 반응식으로 정리하면 다음과 같습니다.
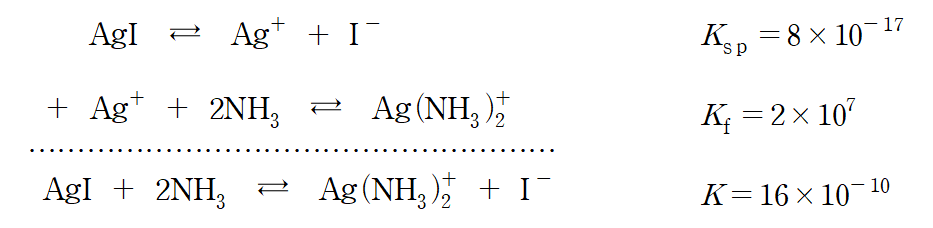
위 반응식처럼 AgI 해리에 의해 생성되는 Ag+는 모두 Ag(NH3)2+ 착물로 전환됩니다. 문제에 단서 조항으로 제시된 [NH3]=1, [Ag(NH3)2+] = [I-] 라는 점을 이용해 AgI의 몰용해도를 구할 수 있습니다. 몰 용해도(S )는 [Ag(NH3)2+] 또는 [I-]와 같습니다. 이제 <보기>를 살펴보면,
ㄱ. (가)에서 AgI의 몰용해도는 위의 (a)+(b) 식의 평형 상수(16*10-10)를 통해 다음과 같이 구할 수 있습니다. (참)

ㄴ. (나)에서는 Br-가 첨가에 의해 AgI의 해리 반응의 평형을 유지하던 Ag+ 이온 수가 감소합니다. AgBr의 침전 반응은 (c)의 역반응으로 K = 2*1012 으로 매우 큰 값을 갖기 때문에 Br- 첨가와 함께 바로 AgBr 침전이 일어납니다. 이로 인해 (가) 상태에서 평형을 유지하던 Ag+ 이온 수를 감소시키며, AgI의 몰 용해도는 (가) 보다 커집니다. (참)
ㄷ. 평형에 도달한 (나)에 고체 AgI를 첨가해도 수용액의 평형에는 영향을 주지 않습니다. 용액의 평형은 용액에 존재하는 이온과 착물에 의해 결정됩니다. (거짓)
[굿노트 요약 풀이]

22번 답 ⑦
[굿노트 요약 풀이]
자세한 풀이 과정은 이전에 작성한 글을 참고하시기 바랍니다.
https://stachemi.tistory.com/66
2020 PEET 화학추론(일반화학) 기출문제 22번 풀이
2020 PEET 화학추론(일반화학) 기출문제 22번 풀이 개요 문제에서 반응 시간이 주어진 경우 일반적으로 반감기(t_1/2)를 사용하면, 쉽게 해결되는 경우가 종종 있습니다. 주어진 문제의 경우에도 반응 시간이 0,..
stachemi.tistory.com

23번 답 ②
처음에 얕잡아 보고, 풀이를 미뤄두다가 업로드를 준비하는 과정에서 은근히 시간이 많이 걸렸던 문제입니다. 영역은 산화-환원 적정입니다. 적정액의 초기 농도, 화학반응식의 계수, 생성된 크롬 이온의 산화수 등이 모두 미지수이기 때문에 차분하게 하나씩 풀어나가야만 합니다. 산화-환원 반응에서는 결국 산화종과 환원종 사이의 전자 수, 또는 산화수의 변화가 같다는 것에서 시작하면 대체로 해결되는 경우가 많습니다.
미지 농도 x M의 SO32- 용액 30 mL을 0.04 M Cr2O72- 용액으로 적정합니다. SO32-의 농도가 0이 되는 Cr2O72- 10mL 지점이 산화-환원 적정의 당량점입니다. 항상 H+와 OH-가 1:1로 반응하는 산-염기 중화 반응과 달리 반응식의 계수를 맞춰주어야 반응 비를 알 수 있습니다. 미지수 a와 b를 사용하여 반응식을 써보면 다음과 같습니다.

황 원자(S) 한 개 기준으로 산화수는 SO32- (+4)에서 SO42- (+6)으로 2 증가합니다. 이 반응에서 산화되는 화학종은 황입니다. 관여한 총 전자 수는 2a 개입니다. 크롬 원자(Cr) 한 개 기준으로 산화수는 Cr2O72- (+6)에서 Crn+ (+n)으로 6-n 감소하며, 환원됩니다. 산화수인 n은 자연수이고, 6보다 작은 값을 갖습니다. 관여한 총 전자 수는 (12-2n)b 개입니다. 산화와 환원에 관여하는 전자 수는 같아야 하므로, 2a = (12 - 2n)b의 관계를 만족해야 합니다. 정리하면 다음과 같습니다.

n은 자연수이면서 6보다 작은 값을 가져야 하기 때문에 좌변의 a/b 는 1보다 큰 자연수이어야 합니다.
다음으로 그래프의 당량점(10 mL) 지점에서의 (가)와 (나)의 몰농도 비를 이용하면 a와 b의 비를 찾을 수 있습니다. 초기 적정액인 K2SO3의 부피는 30 mL 이며, 첨가한 K2Cr2O7의 부피 10 mL를 더해 전체 부피를 구할 수 있습니다. 당량점에서의 전체 부피는 40 mL 입니다. 따라서 생성된 화학종 (가)와 (나)의 몰비(계수비)는 다음과 같습니다.
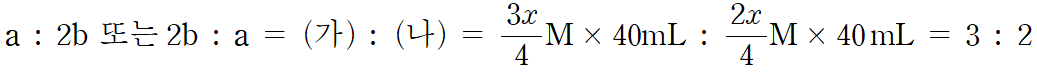
간단하게 정리하면, a : b = 3 : 1 또는 a : b = 4 : 3 입니다. 두 가지 경우 모두 a > b 이지만, a/b 값이 자연수이어야 하므로, a : b = 3 : 1임을 알 수 있습니다. 따라서 그래프에서 몰 수가 큰 (가)는 SO42-, 작은 (나)는 Crn+ 입니다. (보기ㄱ 거짓)
또한 위의 a/b = 6-n 의 관계식을 통해 생성된 크롬의 산화수가 +3이라는 것도 알 수 있습니다. (보기ㄷ 거짓)
화학 반응식을 완성하면 다음과 같습니다.

완성된 화학 반응식을 통해 반응물 SO32-와 Cr2O72-가 3 : 1의 몰 비(계수 비)로 반응하는 것을 알 수 있습니다. 산화-환원 적정에 사용된 K2Cr2O7의 몰 수가 0.04 M * 10 mL = 0.4 mmol 이므로, SO32-는 K2Cr2O7의 3 배인 1.2 mmol이 있었음을 알 수 있습니다. x M * 30 mL = 1.2 mmol 이므로, 초기 몰농도인 x = 0.04 M 입니다. (보기 ㄴ 참)
[굿노트 요약 풀이]


24번 답 ①
주어진 그래프는 x 축이 log[화학종], y 축이 전위(E )로 이루어져 있습니다. 직관적으로 네른스트식(Nernst's Equation)을 이용해야 함을 알 수 있습니다. 네른스트식은 비표준 상태에서의 전위에 관한 식입니다. 그래프는 모두 기울어진 직선의 그래프 형태를 보이고 있으므로, 네른스트식을 y = ax + b 꼴에 대응시키는 것이 문제를 풀어나가는데 도움이 됩니다.
제시된 식 중 수소 전극에 대한 네른스트식을 작성해보면 다음과 같습니다.

수소 전극 그래프의 기울기 a는 + 0.0592 이며, y 절편인 b는 수소 전극의 표준환원전위 0 V입니다. 수소 전극 그래프와 비교해보면, 전극 I은 수소 전극과 같은 기울기를 가지며, 전극 II는 기울기가 수소 전극의 1/2로 완만합니다. 이는 환원 반응에 관여한 전자(혹은 금속 이온의 산화수)와 관련되어 있을 것임을 예상할 수 있습니다. 표준 상태에서의 갈바니 전지에 대한 <보기>를 살펴보면,
ㄱ. 전극 I에 대한 네른스트식을 작성하면, 다음과 같습니다.

전극 I의 기울기는 수소 전극과 같으므로, 기울기인 0.0592/m은 0.0592이며, m = 1 임을 알 수 있습니다. (참)
ㄴ. 전극 I과 II의 표준환원전위는 각각 a, b 입니다. 그래프의 y절편을 통해 a > 0 이며, b < 0 라는 것을 알 수 있습니다. 표준 상태에서 환원이 더 잘 되는 전극 I이라는 것을 알 수 있습니다. (거짓)
ㄷ. 전지 전위가 0 이라는 것은 전극 I과 전극 II 사이에서 전위차가 발생하지 않으며, 이는 두 전극의 전위 값이 같아지는 순간을 말합니다. 전극 II에 대한 네른스트식도 위와 같이 나타내면 다음과 같습니다.

전극 전위가 0이 되기 위해서는 두 전극에 대한 네른스트식이 같아야 합니다. 정리하면, 다음과 같습니다. (거짓)







[굿노트 요약 풀이]


25번 답 ⑥
[굿노트 요약 풀이]
자세한 풀이 과정은 이전에 작성한 글을 참고하시기 바랍니다.
https://stachemi.tistory.com/65
2020 PEET 화학추론(일반화학) 기출문제 25번 풀이
2020 PEET 화학추론(일반화학) 기출문제 25번 풀이 개요 기체의 압력(P)과 부피(V), 몰수(n)의 관계를 묻는 문제입니다. 온도(T)가 일정할 때, 보일의 법칙에 따라 P와 V의 곱이 일정하며, 이는 기체의 몰수(n)과..
stachemi.tistory.com
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트 하도록 하겠습니다. 위 문제의 출처는 http://www.kpeet.or.kr 한국약학교육협의회 사이트입니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2020학년도 4월(5.21.) 고3 학력평가 화학1 3점 문항 풀이 (2) (0) | 2020.05.22 |
|---|---|
| 2020학년도 4월(5.21.) 고3 학력평가 화학1 3점 문항 풀이 (1) (0) | 2020.05.21 |
| 2020 PEET 화학추론(일반화학) 기출문제 풀이 (16번~20번) (2) | 2020.05.10 |
| 2020 PEET 화학추론(일반화학) 기출문제 풀이 (11번~15번) (2) | 2020.05.05 |
| 2020 PEET 화학추론(일반화학) 기출문제 풀이 (6번~10번) (0) | 2020.04.29 |








