 2020학년도 6월(6.18.) 고2 학력평가 화학1 풀이 [20번]
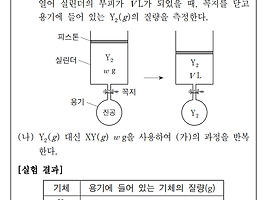
2020학년도 6월(6.18.) 고2 학력평가 화학1 풀이 [20번] 정답 : ④ 22 풀이 : [자료] t ℃, 1 기압에서 XY2 w [g]의 부피가 V [L] 라고 주어져 있다. 온도와 압력이 일정하게 유지되는 조건이면, 기체의 부피를 곧, 몰수라고 볼 수 있다. 여기서는 기체의 질량, 부피, 온도가 임의의 값으로 제시되어 있지만, 그냥 문제 조건을 0 ℃, 1 기압, V = 22.4 [L]라고 생각하고 풀어도 좋다. 어차피 기체는 네 가지 변수인 압력과 온도, 부피, 몰수가 함께 맞물려 변한다. (찝찝하다면, w [g] = n [mol]으로 계산해 보자.) 기체 XY2의 질량과 몰수 관계 w [g] = 1 [mol]이다. [실험 과정] 같은 온도, 같은 1 기압 조건에서 기체 Y2 w [g]을 실..
2020학년도 6월(6.18.) 고2 학력평가 화학1 풀이 [20번]
2020학년도 6월(6.18.) 고2 학력평가 화학1 풀이 [20번] 정답 : ④ 22 풀이 : [자료] t ℃, 1 기압에서 XY2 w [g]의 부피가 V [L] 라고 주어져 있다. 온도와 압력이 일정하게 유지되는 조건이면, 기체의 부피를 곧, 몰수라고 볼 수 있다. 여기서는 기체의 질량, 부피, 온도가 임의의 값으로 제시되어 있지만, 그냥 문제 조건을 0 ℃, 1 기압, V = 22.4 [L]라고 생각하고 풀어도 좋다. 어차피 기체는 네 가지 변수인 압력과 온도, 부피, 몰수가 함께 맞물려 변한다. (찝찝하다면, w [g] = n [mol]으로 계산해 보자.) 기체 XY2의 질량과 몰수 관계 w [g] = 1 [mol]이다. [실험 과정] 같은 온도, 같은 1 기압 조건에서 기체 Y2 w [g]을 실..