식용 색소와 락스 반응을 통한 반응 차수의 결정
Reaction of Blue Food Dye with Bleach
0. 들어가기
연말은 바쁘다. 학생은 학생 나름대로, 학교는 학교 나름대로, 교육청은 교육청 나름대로... 날씨는 춥고, 움직이기는 싫은데, 미뤄놓은 일들과, 제출해야 할 연구보고서, 결과보고서, 정산서가 산더미다. 이맘때쯤이면, 과거의 나 자신에게 '왜 이리 무책임했냐'고 탓을 돌려보지만, 매년마다 반복되는 것을 보니, 사람은 쉽게 변하지 않음을 또다시 느낀다.
내가 속한 지역은, 보통 12월 둘째 주 정도에 교육청 주관 과학교육 성과발표회가 열린다. 올해에도 교육청 사업에 이리저리 걸쳐 있는 상황이어서, 어쩔 수 없이 성과발표회에 1시간 정도를 담당해야 했었다. 사실, 복잡할 것은 없다. '센서와 디지털 기기를 활용한 과학 수업'을 주제로 1년 동안 연구회를 운영했고, 그 결과물들을 잘 소개하면 되는 것이었다. 혼자 하는 것도 아니고, 연구회 소속의 능력자 선생님들과 함께이기에 부담도 덜었다.
그럼에도 한가지 걱정이 남아있었다면, 그것은 기존의 것들과 차별성을 보여줄 수 있을지에 대한 불확실함이었다. 매년 이름만 바뀌었지 '지능형 과학실을 활용한 과학수업', '첨단 기기를 활용한 과학수업' 모두 다 결국은, 학교 과학 수업에서의 자료 수집 단계를 자동화하고, 편리하게 도와주는 센서와 기기를 적극적으로 활용해 보고, 수업에 적용해 보자는 방향성이기에 크게 보면 똑같다.
이에 어떤 수업과 아이디어를 제시해도, 주중에 시간 내어 참관 오시는 선생님들의 시각에는 그다지 새로워 보이지 않을 것 같다는 걱정이 다소 있었다. 기존의 것들과는 다르다는 느낌을 주고 싶어 이리저리 고민했다. 여러 사람에게 동시에 시연하거나 체험하는 형태로 운영될 수 있어야 하고, 교과에 직접 적용 가능한 주제이어야 했다. 배정받은 세션 운영이 일반 강의실 한 구석에서 작은 부스처럼 이루어지는 형태였기 때문에 실험실이 아닌, 제한된 환경에서도 부담 없이 시연할 수 있어야 한다는 조건도 고려해야 했다.
그러다 우연치않게 괜찮은 주제의 탐구 실험을 발견했다. (케첩 얼룩을 화학적으로 지우는 방법을 주제로 글을 작성 중이라 더더욱 반가웠다.)

1. 이론적 배경
가. 청색 1호 (Brilliant Blue FCF)
식용색소 청색 1호(FD&C Blue No.1, Brilliant Blue FCF)는 우리 주변에서 식품, 음료, 화장품 등에 흔히 사용되는 합성 색소로, 분자량 792.86의 삼설폰화 트라이아릴메테인(triarylmethane) 계열의 화합물이다. m&m 초콜릿과 파워에이드와 같은 이온 음료에도 모두 청색 1호가 사용되는데, 가시광선 영역 대의 628 nm 부근 빛을 주로 흡수해 푸른색을 나타낸다. 보통은 나트륨염으로 존재하여 물에 잘 녹고, 약간 염기성인 환경에서 더욱 안정적인 편이다.
청색 1호의 구조를 살펴보면, 분자 내 긴 공액 구조(이중-단일-이중-단일 결합의 반복)를 갖는다. 분자 내 긴 공액구조를 갖는 경우, π-전자가 비교적 자유롭게 이동할 수 있어(비편재화되어), 가시광선 영역의 빛을 흡수하고 색을 띠는 경우가 많다. 관련 설명은 아래 링크로 대신한다.
[참고] 상자의 길이 변화로 설명하는 물질의 색(334)

나. 반응 속도(reaction rate)
물질의 화학적 변화를 반응(reaction)이라 한다. 반응이 진행되면, 반응물은 줄고, 생성물은 늘어난다. 반응 속도(reaction rate)는 단위 시간당 반응물 또는 생성물의 농도 변화로써 정의한다.

[A ], [P ]는 반응물과 생성물의 몰농도를 뜻하며, t 는 시간이다. 반응 속도는 반응물의 농도, 온도, 촉매의 영향을 받는다.
반응이 일어나기 위해서는 반응물들끼리 충돌해야 한다. 그리고 그 충돌이 유효해야 한다. 유효한 충돌이 일어나기 위해서는 두 가지가 충족되어야 하는데, '(1) 반응을 일으킬 수 있는 최소한의 에너지 이상을 가진 입자들'이 '(2) 적절한 방향으로 충돌할 때' 유효 충돌이 일어나고, 반응이 진행된다.
반응이 일어나기 위해 입자가 갖춰야 하는 최소한의 에너지를 '활성화 에너지(activation energy)'라 하는데, 온도가 높을수록 분자 자체의 평균 운동 에너지가 높아지고, 활성화 에너지 이상의 분자 수가 많아지므로 반응 속도가 빨라진다(온도 ∝ 반응속도). 또한, 반응물의 농도가 진할수록 반응물 분자끼리의 충돌 빈도가 커지고, (대부분의 경우) 유효 충돌 확률 또한 커지기 때문에 반응 속도도 빨라진다(농도 ∝ 반응속도). 마지막으로, 촉매는 반응이 일어나기 위한 최소 에너지(활성화 에너지) 기준 자체를 낮춰주어 반응 속도를 빠르게 한다.
그리고, 이러한 화학반응의 빠르기를 속도식의 형태로 나타내면 다음과 같다.

반응 속도는 반응물 농도 [A ]와 [B ]에 비례하며, 충돌에 직접적으로 관여하는 입자 수에 따라 차수 m 과 n 이 결정된다. 예를 들어 반응물 A 분자 1개와 B 분자 2개가 동시에 충돌을 일으켜 반응이 진행되는 경우 A에 대해 1차, B에 대해 2차 반응이며, 전체 반응 차수(reaction order)는 3차가 된다.
안타깝게도 반응 차수를 화학반응식만으로 알 수 있는 방법은 없다. 실험을 통해서만 결정할 수 있다. 화학반응식의 계수는 반응물과 생성물의 포괄적인 반응 비만 뜻할 뿐, 한 번에 직접 충돌에 관여하는 분자 수에 대한 정보를 알려주지는 않는다. A 분자 1개와 B 분자 1개가 충돌하거나, A 분자 2개와 B 분자 2개가 동시에 충돌하는 경우 모두 반응 몰비는 1:1이고, 화학반응식의 계수는 모두 1로 표현된다. 하지만, 속도론적으로 전체 반응 차수는 2와 4로 차이가 크다.
반응속도식의 k 는 속도 상수이며, 반응물 농도와 반응 속도 사이에 등식 관계가 성립하도록 하는 비례상수이다. 당연하게도 속도 상수가 클수록, 같은 농도에 대한 반응 속도는 빨라진다. 또한 속도 상수는 온도에 비례한다.
다. 색소와 표백제의 반응
물질이 색을 띠는 이유를 화학적으로 설명하는 방법은 다양하다. 황산구리 수화물처럼 금속과 리간드 사이 배위 결합으로 인한 에너지 갈라짐에 의한 경우도 있고, 앞선 식용색소 청색 1호와 같이 분자 내 긴 공액 사슬 때문에 색을 나타내기도 한다. 우리 주변에서 흔히 찾아볼 수 있는 대부분의 유기 염료 및 색소들이 색을 띠는 원인으로는 분자 내 긴 공액 사슬에 의한 경우가 많으며, 분자 내 공액 사슬의 변화에 따라 겉보기 색의 변화가 일어나기도 한다.
일례로, 유기 염료나 식용색소에 표백제(락스, 차아염소산 나트륨(NaOCl) 수용액)를 넣으면, 공액 사슬의 변화를 직접 관찰할 수 있다. 이 변화가 어떤 메커니즘으로 일어나고, 최종적으로 어떤 생성물이 생기는지까지를 모든 색소에 일반화하여 설명할 수는 없겠지만, 공액계를 이루는 수많은 이중 결합 중 어딘가에서 반응이 일어나고, 그로 인해 나타나는 전체적인 변화를 관찰할 수는 있다. 색소에 첨가된 표백제로 인해 공액 사슬이 짧아지거나, 둘 이상의 작은 분자로 쪼개지면서 색이 연해지다가 결국, 색을 잃는 것을 관찰할 수 있다.
* 아래 Scheme은 단백질 염색제로 사용되는 청색 색소 중 하나인 Coomassie Brilliant Blue-R가 차아염소산(HOCl)의 반응에 의해 세 가지 분자(P1, P2, P3)로 분해되는 과정을 보여주고 있다. 해당 논문에서는 NMR, GC, MASS 등을 이용하여 세 가지 분해 생성물을 확인했으며, 세부적인 메커니즘도 함께 제시하였다(S. Nadupalli et al., 2015).
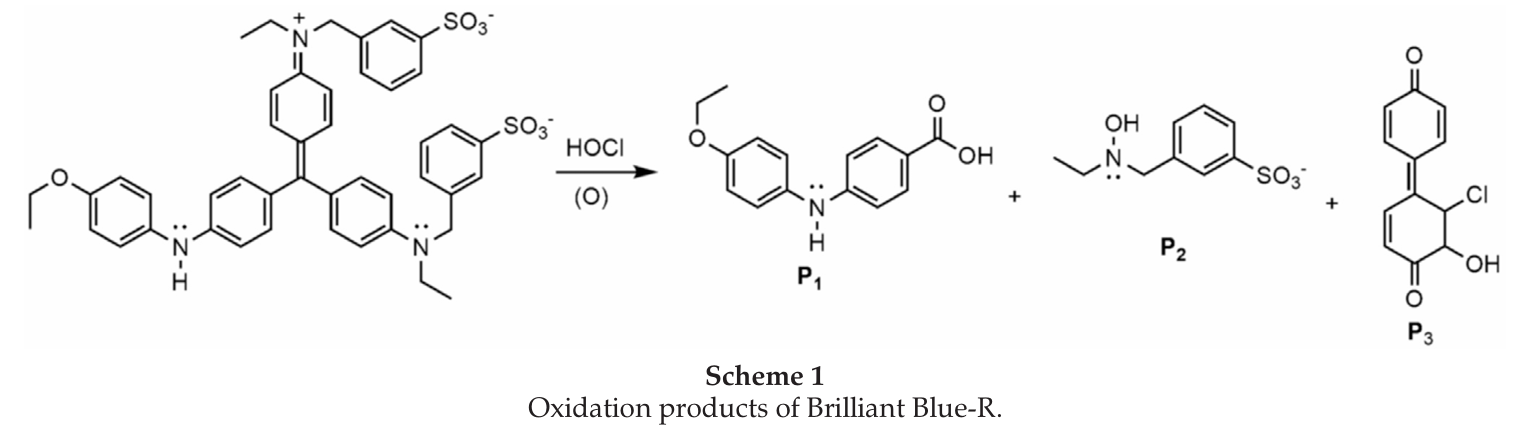
이 경우, 분해된 색소와 분해 반응을 일으키는 표백제는 각각 반응물에 해당한다. 두 물질 간의 반응을 통해 생성된 물질에 대한 정확한 정보가 없다 하더라도, 색소의 분해 속도를 측정하는 것에는 문제가 없다. 예를 들어, 식용색소인 청색 1호가 락스에 의해 분해되면, 푸른색이 점점 옅어질 것이며, 이러한 색변화는 분광광도계를 이용하면 시간에 따른 흡광도 변화로 표현할 수 있다. 흡광도와 농도는 비어 법칙(Beer's Law)에 따라 선형 비례하므로, 흡광도 변화를 색소의 농도 변화로 볼 수 있으며, 단위 시간 동안의 색소의 흡광도 변화는 분해 반응 속도가 된다.

라. 반응 속도식 구하기 - 초기 속도법
초기 속도법을 통해 반응 속도식을 결정하는 방법은 고등학교 화학2 교과서에 잘 설명되어 있다. 천재교육(2015)의 화학2 교과서를 예로 들면, 일산화질소(NO)와 산소(O2)가 반응하여 이산화질소(NO2)를 생성하는 반응이 주어지고, 반응물 농도에 따른 초기 반응 속도 표가 제시되었다. 반응 속도식의 반응 차수를 결정하기 위해서는, 반응물인 NO와 O2 중 한 가지가 일정한 두 실험에서의 나머지 반응물의 농도 비와 초기 반응 속도 비를 비교한다.

O2 농도가 0.01 M로 일정하고, NO 농도가 2배 차이 나는 [실험 Ⅰ, Ⅱ]의 초기 반응 속도는 약 4배 차이가 난다. 이를 통해 반응 속도 v가 [NO]2 에 비례함을 알 수 있다. 또한 NO 농도가 일정하고, O2 농도가 2배 차이 나는 [실험 Ⅰ, Ⅲ] 또는 [실험 Ⅱ, Ⅳ]의 초기 반응 속도가 약 2배 차이 나는 것을 통해 O2 농도에 대한 차수가 1차임을 알 수 있다.
이 반응의 속도 v ∝ [NO]2[O2] 관계가 있으며, 실험 Ⅰ ~ Ⅳ 중 하나의 실험 결괏값을 반응 속도식에 대입하면, 비례상수인 속도상수 k 를 구할 수 있다.
v = k [NO]2[O2]
[실험Ⅰ] 결괏값 대입 → 0.0142 [M/s] = k * [0.01]2[0.01]
속도 상수 k = 142 [M-2s-1]
마. 적분 속도식과 농도 변화
A → P 반응에서 시간에 따른 반응물 A의 농도 변화를 반응 차수에 따라 그래프로 나타내면 다음과 같다.
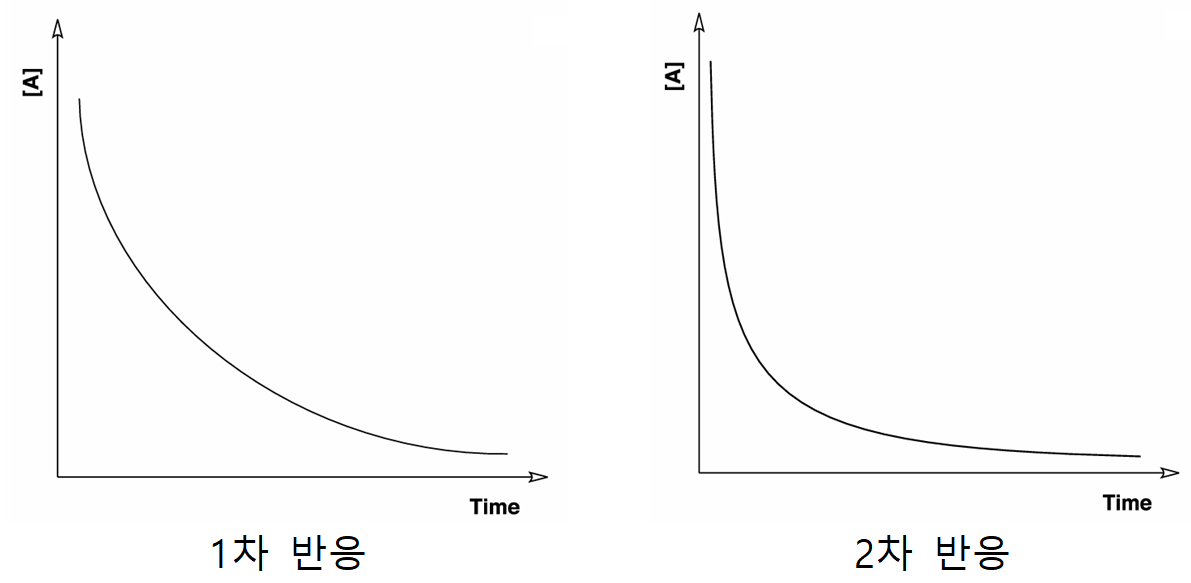
1차 반응과 2차 반응 모두 시간에 따라 농도가 감소하는 경향을 보이는데, 기울기도 시간에 따라 점차 완만해지는 것을 알 수 있다. 2차 반응 그래프가 1차 반응 그래프에 비해 보다 더 의존하고 있음을 대충 느낄 수는 있지만, y축 값만 살짝 바꿔주면 두 반응의 차이를 보다 직접적으로 판단할 수 있다.
y축의 A 농도값을 ln[A]와 1/[A]로 변환하여 그리고, 그려진 그래프의 개형이 선형에 잘 대응하는지를 판단하면, 1차와 2차 구분이 명확해질 수 있다.
1차 반응은 시간에 따른 ln[A] 그래프가 직선형이며, 2차 반응은 시간에 따른 1/[A] 그래프가 직선형이다. 0차 반응은 별도의 농도 변환없이도, 반응물의 농도가 시간에 따라 일정하게 선형 감소하는 경우이다.

2. 탐구 과정
가. 용액 준비 및 최대 흡수 파장의 확인
[1] (청색 #1호 용액 준비) 식용색소 청색 1호(MW=792.86 g/mol) 0.02 g(약 0.025 mmol)와 물 100 mL를 혼합하여 청색 #1호 용액 100 mL를 만든다. (제조한 청색 용액의 농도는 약 0.25 mM이지만, 농도는 크게 중요하지 않다.)
[2] (락스 준비) 락스는 시중에서 판매되는 것을 그대로 사용한다. 시중의 락스는 5% 차아염소산나트륨 수용액에 가깝다. 락스 40 mL를 비커에 따로 준비하여 '5% 락스'로 라벨링 한다.
[3] (2.5% 락스 준비) 5% 락스 10 mL를 취하여 다른 비커에 옮기고, 물을 10 mL 첨가하여 초기 락스의 절반 농도인 락스 용액 20 mL를 제조하여 '2.5% 락스'로 라벨링 한다.
[4] (1.25% 락스 준비) 5% 락스 5 mL를 취하여 또 다른 비커에 옮기고, 물을 15 mL 첨가하여 초기 락스 농도의 1/4인 락스 용액 20 mL를 제조하여 '1.25 락스'로 라벨링 한다.
* 각 모둠별 준비된 용액은 청색 #1호 용액 100 mL, 5% 락스 25 mL, 2.5% 락스 20 mL, 1.25% 락스 20 mL 이다.
[5] (분광광도계 준비 및 최대 흡수 파장 측정) 분광광도계의 전원을 켜고 컴퓨터(또는 태블릿)와 연결한 뒤, 분석 프로그램을 실행시켜 청색 용액의 최대 흡수 파장을 측정한다. (약 620 ~ 640 nm 부근)
나. 반응 속도 측정
[1] 앞서 측정한 청색 용액의 최대 흡수 파장(ex. 628 nm)을 기준으로 Chemical Kinetics 분석을 준비한다. (사용하는 분광광도계별로 분석 이름이나 세부적인 측정 방식은 다를 수 있다. 만약, 사용하는 분광광도계에서 Kinetics 분석을 따로 제공하지 않는다면, 측정한 최대 흡수 파장(ex. 628 nm)에서 단파장 측정 모드로 일정 시간 간격으로 흡광도를 측정하는 방식으로 대신할 수 있다.)
[2] 50 mL 비커를 3개 준비하고, A, B, C로 라벨링 한다. 각 비커에 청색 용액을 각각 30 mL씩 넣는다. 준비된 A, B, C 비커에 락스를 10 mL씩 넣어 반응을 진행할 예정이며, 넣어줄 락스 농도는 다음 표와 같다. (락스는 흡광도 측정 직전에 넣어야 하므로, 절대 미리 넣어서 준비하지 않는다.)

[3-1] A 비커에 5% 락스 10 mL를 넣고, 잘 혼합한다. 혼합 용액을 취하여 큐벳에 옮긴 뒤, 락스 첨가한 지 10초가 지나는 순간부터, 분광광도계로 15초 간격으로 흡광도를 8회(약 2분) 측정한다.
[3-2] B 비커에 2.5% 락스 10 mL를 넣고, 잘 혼합한다. 혼합 용액을 취하여 큐벳에 옮긴 뒤, 락스 첨가한 지 10초가 지나는 순간부터, 분광광도계로 15초 간격으로 흡광도를 8회 측정한다.
[3-3] C 비커에 1.25% 락스 10 mL를 넣고, 잘 혼합한다. 혼합 용액을 취하여 큐벳에 옮긴 뒤, 락스 첨가한 지 10초가 지나는 순간부터, 분광광도계로 15초 간격으로 흡광도를 8회 측정한다.

3. 결과 처리
가. [Blue #1] 의 반응 차수(m) 결정
15초 간격으로 측정한 흡광도 값을 구글 시트(Google Sheet) 또는 마이크로소프트 엑셀(Microsoft Exel)으로 시간에 따라 정리한다. 그리고, 정리한 흡광도 값을 ln(흡광도)와 1/(흡광도)으로 변환한다.

x축 시간, y축 ln(흡광도) 그래프(1)와 x축 시간, y축 1/(흡광도) 그래프(2)를 그린다. 각 그래프에 추세선(Trendline, 직선형)을 추가하고, 추세선 식(y = ax + b 형태)을 표현한다. 그려진 추세선의 R2 값은 어떤 그래프가 직선형에 가까운지 알려준다. R2 값이 1에 가까울수록 분산형 그래프의 점들이 직선형 추세선 위에 놓인다는 뜻이다.

그룹 A의 ln흡광도 그래프와 1/흡광도 그래프를 비교해 보면 확연한 차이가 보인다. 좌측의 ln(흡광도) 그래프의 R2 = 0.99이지만, 우측의 1/(흡광도) 그래프의 R2 = 0.825이다. ln(흡광도) 그래프가 1/(흡광도) 그래프에 비해 선형 관계가 훨씬 뚜렷하므로, 이 반응은 [Blue #1]에 대한 1차 반응이다.
v ∝ [Blue #1]1
만약, 시간에 대한 1/(흡광도) 그래프가 직선 형태로 나타나면, [Blue #1]에 대한 2차 반응이다.
"[반응물]에 대한 1차 반응이면, ln(흡광도) 그래프가 선형으로 나타나며,
[반응물]에 대한 2차 반응이면, 1/(흡광도) 그래프가 선형으로 나타난다."
2.5% 락스를 넣은 B 비커의 ln(흡광도) 그래프(아래, 우측) 역시, 직선에 잘 대응되고, [Blue #1] 에 대한 1차 반응임을 다시 한번 확인시켜주고 있다.
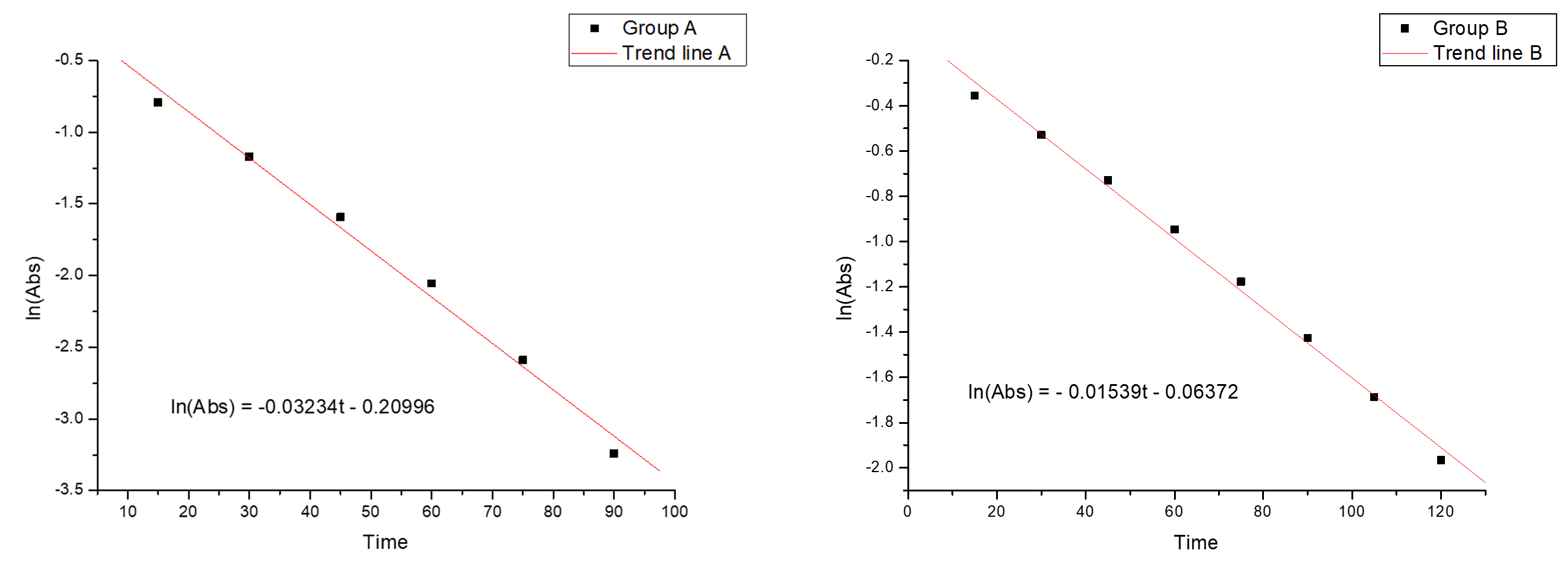
비커 A와 B 모두 ln(흡광도) 그래프가 선형 비례하고 [Blue #1]에 대한 1차 반응임은 그래프 개형을 통해 공통적으로 확인할 수 있는 부분이지만, 두 비커의 그래프 기울기에는 차이가 있다. ln(흡광도) 그래프의 기울기는 속도 상수에 해당하는데, 여기서의 기울기 k' = k [OCl^-]n 에 해당한다.
v = k' [Blue #1] , (k' = k [OCl-]n )
기울기는 그래프 A(=0.03234)가 그래프 B(=0.01539)에 비해 약 2배 가량 크고 가파르다. A와 B의 청색 용액 농도는 같으므로, A의 반응 속도가 B보다 2배 빠르다.
나. [OCl-]의 반응 차수(n) 결정
시간에 따른 색소의 흡광도 그래프가 ln(흡광도)에 선형 비례하는지, 1/(흡광도)에 선형 비례하는지 확인하여 [Blue #1]의 차수(m)를 결정할 수 있었다. 이제 A, B, C의 속도 상수(k' )를 비교하여 락스(OCl-) 농도에 대한 반응 차수(n)를 결정해 보자. 앞서 결정한 속도 상수 k' 은 락스 농도항을 포함하고 있다.

실험 A, B, C에서 청색 #1호의 농도는 모두 같으며, A, B, C의 반응 속도의 차이는 락스 농도에 의해서 발생한다. 실험 A와 B의 속도상수 k' 은 0.03234와 0.01539이며, 약 2배 정도 A가 큰 값을 갖는다.
청색 색소와 락스의 속도식을 v = k [OCl-]n [Blue #1]이라 표현했을 때, 그룹 A, B, C의 [Blue #1]가 일정하고, 락스 농도는 4:2:1의 비를 가지므로, k' 값을 통해 락스(OCl-) 농도에 대한 반응 차수(n)를 결정할 수 있다.
락스 농도가 5%에서 2.5%로 1/2로 줄어듦에 따라 속도 상수 k' 역시, 0.03234에서 0.01539로 1/2 가량 감소했으며, 이는 락스 농도 [OCl-]에 대해 1차 반응이며, 반응 차수 n = 1임을 뜻한다. 최종적으로 완성된 속도식은 다음과 같으며, 전체 반응 차수는 2차가 된다.
v = k [OCl-][Blue #1]
4. 마치며,
사실, 시간적 여유가 있고, 학생들이 충분하게 동기 부여가 되어 있다면, 직접 그래프를 그리고 구글 시트나 엑셀 등의 도구를 이용하여, 추세선을 찾고, 차수를 직접 결정하는 과정을 수행할 수 있겠지만, 현실적으로 고3 교실에서 전 과정이 원활하게 이루어지기 어렵다는 것을 나 역시 잘 알고 있다.
영상과 디지털 기기와는 떼려야 뗄 수 없는 세대임에도, 의외로 컴퓨터와 워드프로세서, 스프레드시트 등에는 익숙하지 않은 경우가 많다. 플레이스토어와 앱스토어를 수시로 이용하면서도, 자기 이메일 주소는 모르는 학생이나, 누군가에게 이메일을 한 번도 보내 본 적 없는 아이들도 적지 않다.
이러한 교실 환경을 고려할 때, 본문의 과정을 정규 수업과정에서 학급 전체가 처음부터 끝까지 수행해 나간다는 것은 여러 방면에서 상당히 어려운 일일 수 있다.
게다가 현행 교육과정에서는 물질에 대한 반응 차수와 전체 차수를 찾고, 자료를 바탕으로 반응 속도식을 결정하지만, 시간에 대한 농도 그래프는 1차 반응만 다룬다. 또한, 1차 반응의 적분속도식(ln[A]t = -kt + ln[A]0)도 언급되고, 선형 비례 관계도 언급되지 않기 때문에, 추가적인 이론 설명이 필요하며, 교육과정에 있는 그대로 적용하기에는 분명 무리가 있다.
그럼에도,
고등학교 3학년 교실에서 굳이 반응 차수를 직접 구하기 위해 용액을 묽히고, 흡광도를 측정하고, 자료를 변환해서 추세선을 그리지는 않더라도, 식용색소와 락스를 활용해 반응의 빠르기를 눈으로 관찰하는 정도로 수업을 보조할 수 있다. 락스의 농도만 달리하면, 색깔 변화(청색 → 무색)의 빠르기를 조절할 수 있으니, 동기유발을 하거나, 전체 과정을 간소화하여 활기를 잃은 고3 교실에서 활용될 수 있기를 기대해 본다.
- 끝 -
* 긴 글, 끝까지 읽어주셔서 감사합니다.
* 2024-12-22 탐구 과정 및 결과 처리 일부 수정
'화학 > 화학이야기' 카테고리의 다른 글
| 농도차 전지와 네른스트 식 (0) | 2025.10.29 |
|---|---|
| 형광과 인광 (Fluorescence & Phosphorescence) (6) | 2025.03.30 |
| 색소의 구조와 종류 (0) | 2024.12.16 |
| DPPH를 이용한 항산화능 분석 (5) | 2024.11.24 |
| 상자 길이 변화로 설명하는 물질의 색(feat. 짝불포화계) (5) | 2024.11.13 |



