* 이전 글 : (327) 1차원 상자 속 입자 https://stachemi.tistory.com/327
상자 속 입자 (The Particle in a Box, PIB)
상자 속 입자 ( The Particle in a Box, PIB)어쩌다가, 입자는 상자에 빠지게 되었나... 0. 들어가기 수업을 구성할 때, 전반적인 흐름에 가장 신경을 쓰는 편이다. 이 단원이 왜 가장 먼저 등장하는지,
stachemi.tistory.com
상자 길이 변화로 설명하는 물질의 색 (feat. 짝불포화계)
주황색 당근, 빨간 토마토를 분자 구조를 통해 설명해보자.
0. 들어가기
상자 속 입자 모델은 원자핵에 붙들린 전자에 대한 정보를 제공한다. 상자 속 입자는 경계 조건과 정규화 조건에 의해 허용되는 파동함수가 있으며, 그에 따른 에너지도 양자화되어 있다.
상자 속 입자의 에너지 준위 또한 n 에 의존한다. n 은 자연수이므로 에너지 값 전체가 0이 될 수는 없다. 이는 입자가 갖는 최소한의 기본 에너지가 있다는 뜻이며, 이를 영점 에너지(Zero-Point Energy)라 한다.

1차원 상자 속 입자의 에너지 식 구성 요소들을 살펴보면, 플랑크 상수(h), 입자 질량(m), 자연수(n), 그리고 상자 길이(L)이다. 이번 글을 통해서는 상자 길이(L) 변화에 따른 에너지 준위 변화와 간격 변화를 살펴보고, 이를 바탕으로 색을 갖는 물질에 대한 이야기를 하고자 한다.

1. 상자의 길이가 변하면?
상자 속에 입자가 갇혀있는데, 상자의 길이가 길어지거나 줄어들면 입자는 어떻게 될까? 좋아할까? 싫어할까? 입자가 감정을 느끼고 표현할 일은 1도 없겠지만, 그래도 상상력을 발휘하여 입자 관점에서 생각해 보자. 머무르는 공간이 넓어지면, 쪼끔은 좋지 않을까? (입자가 말하길, 평생 갇힌 건 변함이 없는데, 집 좀 넓어진다고 좋겠냐?)
입자에게 허용된 에너지 식을 통해 입자의 마음을 조금 들여다보면, 겉으로는 내색하지 않았지만 에너지적으로 안정화된다는 것을 알 수 있다. 1차원 상자 길이 L 이 2L 로, 2배 증가했을 때, 입자의 에너지는 1/L 2에 비례하므로, 4배 낮아진다. 상자 길이가 길어질수록 입자가 가질 수 있는 에너지는 점점 낮아지고 안정화된다. (티는 안 냈지만, 싫지는 않은 것 같은데?ㅎㅎ)

뿐만 아니라, 인접한 에너지 준위 사이 간격에도 변화가 생긴다. 에너지 간격(E (n+1) - E n)을 일반화된 식으로 나타내면, 다음과 같다. 마찬가지로 상자 길이가 2배 늘어나면, 인접한 에너지 간격 또한 1/4로 줄어드는 것을 알 수 있다.

정리하면, 상자의 길이가 길어질수록 입자에 허용된 에너지의 절대적인 준위가 낮아짐과 동시에 인접한 에너지 준위 사이 간격 또한 작아진다. 에너지는 안정화됨과 동시에 간격은 촘촘해진다. 만약, 상자 길이가 무한히 길어진다면, 에너지 간격은이 거의 0에 가까워져 연속적인 에너지 준위에 대응되는 것처럼 생각할 수 있다.

2. 상자 길이 변화로 설명하는 화학 결합
이전 글(327)에서 상자 속 입자가 비유 모델임을 강조했고, 원자핵에 붙들린 전자를 설명하기 좋다고 했다. 그렇다면, 앞서 언급한 상자의 길이가 늘어날수록 입자의 에너지 준위가 낮아지고, 에너지 간격이 줄어든다는 것은 물질의 어떤 부분을 설명할 수 있을까? 가정 먼저 생각나는 것은, 화학에서 원자들이 모여 결합을 형성하고 분자를 이루는 과정에서 에너지적 안정화를 갖는 과정을 상자 길이의 변화로 설명할 수 있을 것 같다.
서로 무관한 두 수소 원자가 서로에게 이끌려 수소 분자를 이룬다. 각각의 수소 원자는 결합을 통해 하나의 수소 분자로 묶인다. 결합은 오비탈(전자 구름)의 중첩으로 표현할 수 있으며, 오비탈의 중첩은 전자가 존재 가능한 영역의 확장과 같다. 왠지 상자 길이가 늘어난 것 같지 않은가?

서로 분리된 수소 원자 HA, HB를 생각하자. 각각의 수소 원자를 서로 다른 두 상자 A, B에 두 입자 a, b가 각각 갇힌 상황 처럼 생각할 수 있다. 너무나도 당연하겠지만, 상자 A에서는 a 입자만 발견되고, 상자 B에서는 b 입자만 발견될 것이다.
상자 A 속 입자 a → 원자 A
상자 B 속 입자 b → 원자 B
서로 무관한 두 수소 원자 HA, HB가 수소 분자(H2)가 되면, 기존에는 한 원자핵 주변에서만 머무를 수 있던 전자의 존재 가능한 범위가 넓어진다. 분리된 원자 HA, HB 상태에서는 a 전자는 언제나 A 수소 원자핵 주변에서만 발견될 수 있지만, 결합 이후에는 a 전자가 B 수소 원자핵 주위에서도 발견될 수 있게 된다. 반대로, b 전자도 A 원자핵 주변에서 발견될 수 있다.
마치 두 수소 원자핵이 마치 각각 소유하고 있던 전자를 서로 공유하고 있는 것과 같다. 그리고 이러한 상태를 상자 속 입자 모델로 바라보면, 마치 길이가 L 인 두 상자 A, B가 합쳐져 이전보다 더 긴 새로운 상자가 만들어지고, 상자 속 입자들이 존재할 수 있는 영역이 넓어진 셈이다.
각각의 원자 상태일 때보다, 결합을 통해 분자를 이루면서 전자의 존재 가능한 영역이 확장된다.
마치 입자를 가둔 상자의 길이가 길어진 것 처럼,
3. 긴 공액계를 갖는 분자들의 공통점
상자 길이 증가에 의한 효과는 π-결합 전자들이 만드는 공액계(짝불포화계, conjugated system)에서 특히나 잘 나타난다. 공액계는 "다중(이중) 결합-단일결합" 형태의 결합이 반복되는 시스템을 말한다. 이중-단일-이중-단일의 퐁당퐁당 형태로 반복되는 구조를 갖는 분자들은 연속된 sp2 탄소들의 나열로 이루어지는데, 이 경우 C-C 사이 σ-결합(혼성)에 참여하지 않는 여분의 p-오비탈들이 모두 같은 축(axis) 상에 놓이게 되고, 이들 간에 중첩(겹침)에 의해 '연속된 π-결합'이 가능해진다.
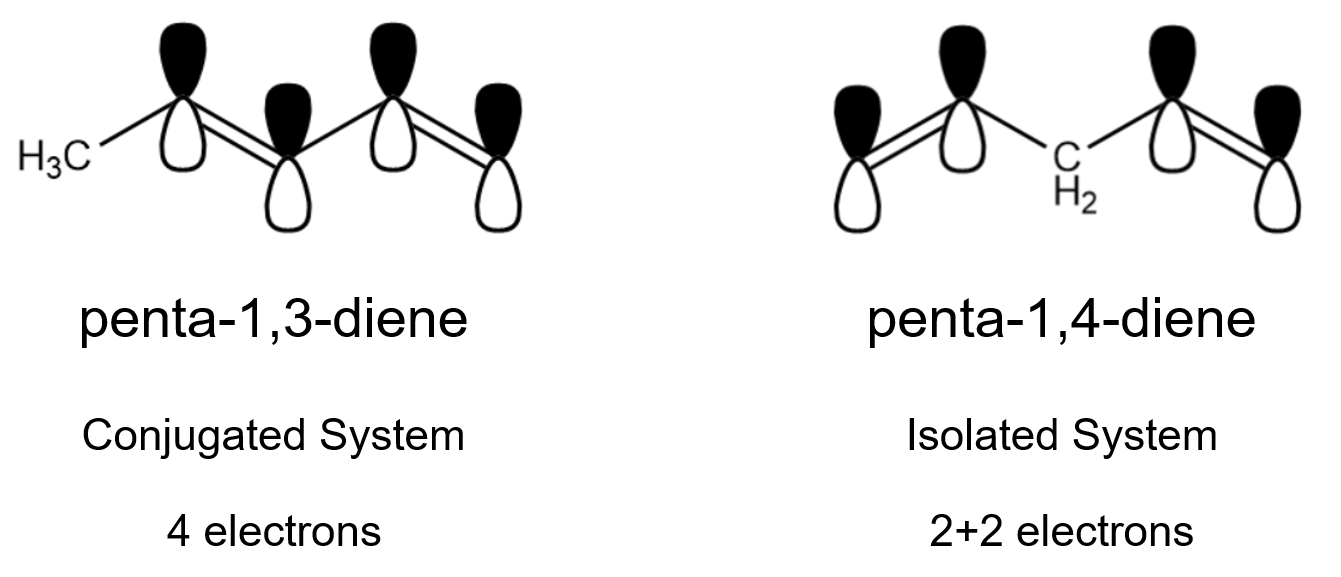
공액계를 구성하는 π-전자들은 특정 원자 핵 하나에 구속되지 않으며, 공액계 어딘가에 존재할 수 있고, 어디서든 발견될 수 있다. 이를 전자의 비편재화(delocalized)라 하며, 분자를 안정화시키는 요인으로 설명되곤 한다. (유기 화학에서는 공명 효과에 의한 안정화로 설명한다.)
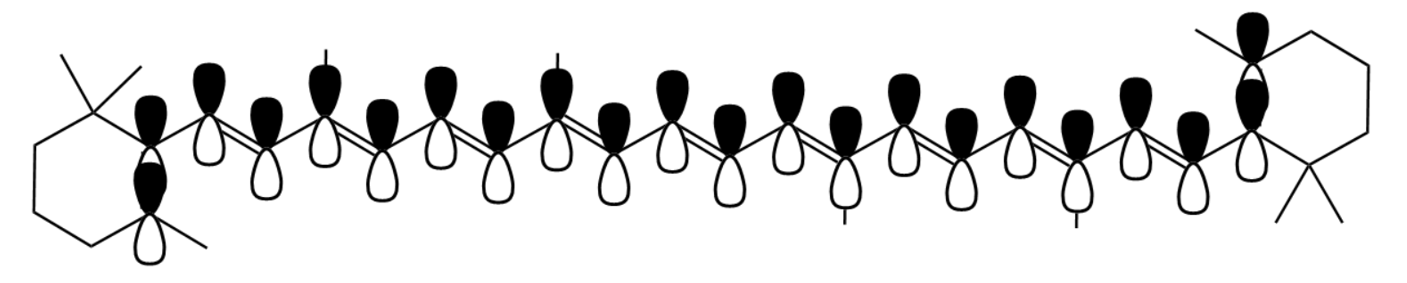
따라서 어떤 분자가 길이가 긴 공액계를 갖는다면, 공액계에 포함된 π-전자들이 분자 내 상당히 넓게 퍼져있는 것과 같다. 그리고 이를 상자 속 입자 모델에 적용해 본다면, π-전자가 갇힌 상자 길이 L 이 매우 매우 긴 것과 같다. 분자 내 길고 긴 이중-단일-이중-단일 형태의 짝불포화계는 전체 에너지를 낮아지게 함과 동시에, 분자의 에너지 간격 또한 좁게 만든다. 그리고 에너지 간격은 전자 전이(바닥 상태 → 들뜬 상태) 과정에서 흡수하는 빛의 파장과 밀접하다.
[참고] 에너지 간격과 빛의 파장 사이 관계
물질은 전이(transition)를 위해 필요한 에너지 간격에 해당하는 빛을 흡수한다. 에너지는 E = hv = hc/λ 이므로, 파장 길이와 에너지의 크기(E )는 서로 반비례한다. 물질은 전이를 위해 에너지 간격만큼의 빛을 흡수 해야하며, 에너지 간격(ΔE )에 해당하는 파장의 빛을 흡수한다. 에너지 간격이 크면, 짧은 파장의 빛을, 에너지 간격이 좁으면, 긴 파장의 빛을 흡수한다.
분자의 전자 전이는 HOMO에서 LUMO로의 전자 전이다. HOMO(Highest Occupied Molecular Orbital)는 전자가 채워진 가장 높은 분자오비탈을 말하며, LUMO(Lowest Unoccupied Molecular Orbital)는 전자가 채워져있지 않은 가장 낮은 분자 오비탈을 말한다. 마치, 리튬 원자의 2s는 전자가 채워진 가장 높은 '원자 오비탈', 리튬 원자의 2p는 전자가 채워지지 않은 가장 낮은 '원자 오비탈'인 것처럼, 분자에서도 허용되는 에너지 준위의 순서가 있고, 순서에 따라 채워진 전자들에 의해 HOMO-LUMO가 구분되며, 그 간격이 전자 전이에 해당하는 에너지 크기라고 생각하면 된다.
분자들의 전자 전이에 해당하는 HOMO-LUMO 간격에 해당하는 파장은 자외선-가시광선 영역(ultraviolet-visible)인 경우가 많으며, 에너지 간격이 넓을수록 짧은 파장의 자외선을, 에너지 간격이 좁을수록 긴 파장의 가시광선을 흡수한다.
어떤 물질이 색을 갖는다는 것은 가시광선 영역에서 빛의 흡수가 일어난다는 말과 같다. 그리고, 분자 내 긴 공액계를 갖는 많은 분자들이 색을 나타낸다. 그리고, 분자 구조에서 색을 내는 원인이 되는 부분을 발색단(Chromophore)이라고 부르는데, 긴 사슬 형태의 공액계도 발색단이 된다.
당근의 베타-카로틴(β-Carotene), 토마토의 라이코펜(Lycopene), 포도나 블루베리에 포함된 안토시아닌(Anthocyanin)과 루테인(Lutein) 구조를 살펴보면, 공통적으로 이중-단일-이중-단일 결합이 연속적으로 반복되는 긴 공액계 사슬(발색단)을 가졌음을 알 수 있다.
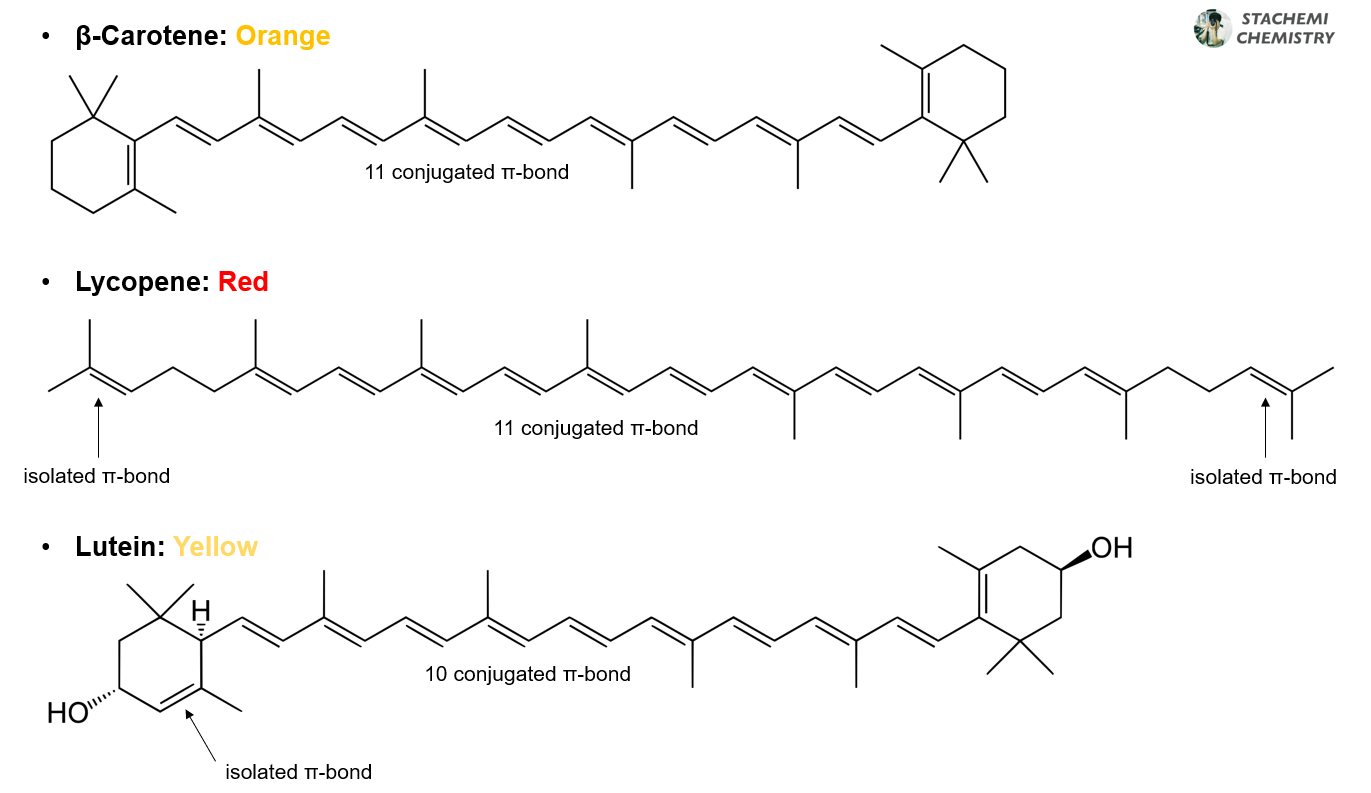
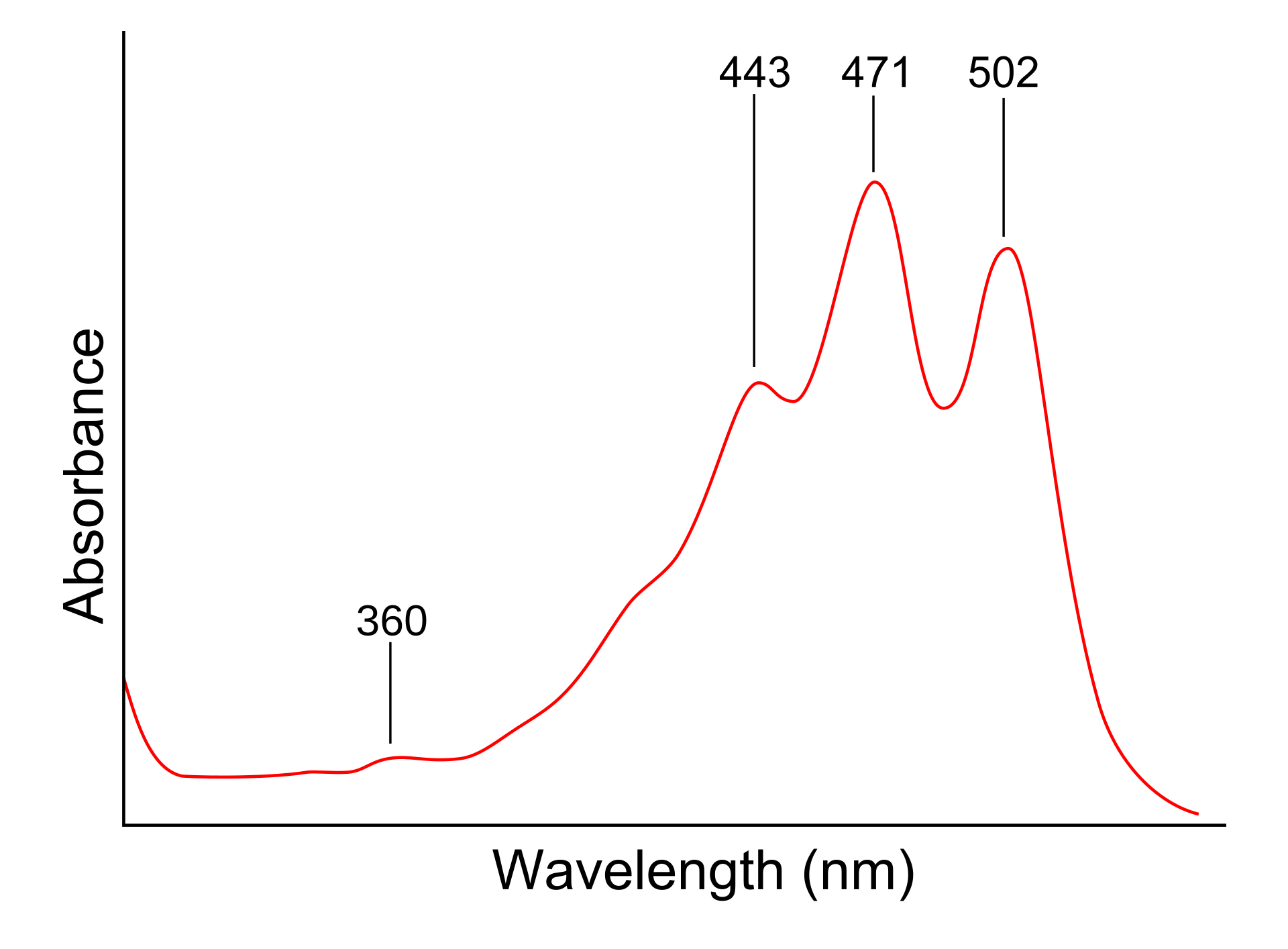
긴 공액계에 의해 분자 전체 에너지 간격(ΔE )이 줄고, HOMO-LUMO 간격이 좁아질수록 흡수 파장이 길어져 가시광선 영역(380 - 780 nm)의 빛 흡수가 이루어진다면, 이와 관련된 색(대체로 보색)을 관찰할 수 있게 된다. 토마토의 라이코펜 흡수 스펙트럼을 살펴보면, 가시광선 영역의 443 - 502 nm 부근(파랑-보라)에서 넓은 흡수띠를 가지는 것을 알 수 있다.
4. 마치며,
상자 속 입자 모델을 통해 분자 구조와 색의 관계를 직관적으로 이해할 수 있음을 알아보았다. 공액계의 길이에 따른 색상 변화는 상자 속 입자 모델의 수학적인 설명을 넘어 분자의 성질과 구조에 대한 이해를 돕는다.
다만, 이러한 단순한 모델이 실제 색이나 흡수 파장을 정확하게 예측하지 못하는 경우도 많다. 이 모델은 전자가 1차원 상자에 갇혀 있다고 가정하고 있으며, 분자 내 전자의 다양한 상호작용이나 입체적인 구조까지 완전하게 반영할 수 없다. 따라서 이 모델을 통한 예측은 전체적인 해석의 방향성은 제공하지만, 정확한 색을 예측하거나 분자 내 전자 움직임을 완전하게 설명하기에는 한계가 있다. (일반화학 또는 물리화학 교재에 실린 예제 문제의 풀이 결과로 얻은 파장값이 가시광선 영역을 벗어나는 이유이기도 하다.)
그럼에도 상자 속 입자를 통해 화합물이 빛과 상호작용해서 색을 나타내는 원리를 직관적으로 이해하는 데 유용하다는 측면에서는 큰 의미가 있다.
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 색소의 구조와 종류 (0) | 2024.12.16 |
|---|---|
| DPPH를 이용한 항산화능 분석 (5) | 2024.11.24 |
| 신호등 반응 (인디고 카민의 산화-환원 반응) (5) | 2024.11.02 |
| 라티머 도표와 불균등화 반응 (0) | 2024.10.11 |
| 이온의 선택적 침전 (Selective Precipitation) (0) | 2024.09.30 |



