라티머 도표와 불균등화 반응
과산화수소가 저절로 물과 산소로 분해되는 이유
1. 라티머 도표
라티머 도표(Latimer diagram)는 어떤 원소의 '다양한 산화수'와 '표준 환원 전위' 사이 관계를 보여준다. 라티머 도표는 미국의 화학자 웬델 미첼 라티머(Wendell Mitchell Latimer, 1893-1955)가 그의 저서 《The Oxidation States of the Elements and Their Potentials in Aqueous Solution》를 통해 처음 소개하였다. 다음은 아이오딘(I) 원소 산화수에 따른 표준 환원 전위를 라티머 도표로 나타낸 것이다.

라티머 도표는 화합물 종류, 원소 산화수, 화살표, 환원 전위로 구성된다. 가장 왼쪽에 위치한 IO4-의 아이오딘 산화수는 +7이고, 가장 오른쪽에 위치한 I- 산화수는 -1이다. 화살표는 왼쪽에서 오른쪽(→)을 향하며, 산화수가 감소하는 방향(환원)을 기본으로 한다. 화살표 주위에는 해당 반응의 환원 전위(E )를 함께 표시한다. 즉, 위 도표에서 IO3-→ HOI 반응의 환원 전위는 + 1.154 V 라는 뜻이다. 환원 전위 값은 용액의 pH에 따라 달라지기 때문에, 용액의 액성에 대한 정보를 도표에 함께 표현해야 하지만, 따로 주어지지 않았다면, 1 M H+, pH = 0 산성 용액을 기본으로 한다.
라티머 도표는 원소 산화수와 화학식, 반응에서의 전위 등 비교적 간단한 정보만 포함하지만, 용액의 액성이 주어진다면, 균형 잡힌 화학반응식을 완성하는 것은 어렵지 않다.
산성 조건에서의 IO3- → HOI 반응의 화학반응식을 완성해 보면,

[1] IO3- → HOI에서 아이오딘 산화수는 +5 → +1로 변하므로 산화수는 4 감소, 관여한 전자 4개, 반응물에 4e- 추가
[2] 산성 조건이므로, 반응 전후 전하 균형(0)을 맞춰주기 위해 반응물에 5H+ 추가 (만약, 염기 조건이라면 OH-로 균형)
[3] 반응 전후 수소(H), 산소(O)의 질량 균형을 위해 생성물에 2H2O 추가
반응의 환원 전위가 + 1.154 V이고, E 가 0보다 크다는 것은, 산화수가 +5인 아이오딘(IO3-)이 산화수가 +1인 아이오딘(HOI)로 변하는 과정이 자발적임(ΔG < 0)을 의미한다. (산화수 변화에 해당하는 4 몰의 전자가 관여)

-
라티머 도표에 IO3- → I - 반응의 환원 전위 값은 주어지지 않았다. 하지만, [1] 환원 전위 값을 깁스 자유에너지로 표현할 수 있다는 점(ΔG = - nFE )과 [2] 깁스 자유에너지는 상태함수이기 때문에 연속된 단계별 반응의 합으로 나타낼 수 있다는 점을 이용하면, 도표에 표현되지 않은 환원 전위도 쉽게 구할 수 있다.
먼저, 산성 조건에서의 IO3- → I - 반응부터 균형 잡힌 반응식을 완성해보자.

[1] IO3- → I-에서 아이오딘 산화수는 +5 → -1로 변하므로 산화수는 6 감소, 관여한 전자는 6 개, 반응물에 6e- 추가
[2] 산성 조건에서 반응 전후 전하 균형(-1)을 맞춰주기 위해 반응물에 6H+ 추가
[3] 반응 전후 수소(H), 산소(O)의 질량 균형을 위해 생성물에 3H2O 추가
해당 반응을 라티머 도표에서 환원 전위가 주어진 각각의 단계별 반응 [1] IO3- → I2 , [2] I2 → I- 으로 구분해 보면,

우선 첫번째 반응, IO3- → ½I2 에서 산화수 변화는 - 5이며, 전자 5 몰이 관여한다. ΔG 1 = - 5 * (1.210) * F = - 6.05F 이다. 이어서 ½I2 → I- 반응의 산화수 변화는 - 1이며, 전자 1 몰이 관여한다. ΔG 2 = - 1 * (0.535) * F = - 0.535F 이다.
두 반응이 차례로 진행되었다면, 총 산화수 변화는 - 6이며, 전자 6 몰이 관여한다. ΔG 3 = - 6 * E 3 * F 로 나타낼 수 있고, ΔG 3 = - 6 * E 3 * F = ΔG 1 + ΔG 2 = - 6.585F 이다. 따라서 전체 반응의 전위 값 E 3 = 6.585F / 6F = 1.098 V 이다.

따라서 어떤 반응이든, 원소의 산화수 변화(n 1, n 2, n 3)와 단계별 환원 전위 값(E 1, E 2)을 알고 있다면, 주어지지 않은 환원 전위 값(E 3)도 어렵지 않게 구할 수 있다. 전체 반응의 환원 전위가 주어지고, 단계별 환원 전위 일부를 구하는 반대 과정 또한 가능하다.
2. 불균등화 반응 (Disproportionation)
라티머 도표는 [1] 어떤 화학종이 열역학적으로 안정한 지를 판단하거나, [2] 어떤 화학종의 불균등화 반응 진행 여부를 예측하는 데 유용하게 사용될 수 있다. 불균등화 반응(disproportionation)은 어떤 화학종이 둘 이상의 안정적인 생성물을 만드는 방향으로 자체 산화-환원 반응을 하는 것을 말한다. 가장 대표적인 것이 과산화수소(H2O2)의 분해 반응이며, 과산화수소는 자체 산화-환원 반응을 통해 안정한 H2O와 O2을 생성한다.

어떤 화학종(A)이 스스로 자체 산화-환원 반응을 통해 둘 이상의 새로운 생성물(A', A")을 만든다는 것은 기존 반응물(A)이 자체 반응 이후 생성된 물질들(A', A") 보다 열역학적으로 불안정하다는 것이다. 따라서 불균등화 반응을 2A → A' + A" 형태로 나타냈을 때, 이 반응은 자발적이고, ΔG < 0 이다.

그런데, 라티머 도표를 통해 불균등화 반응의 진행 유무를 어떻게 쉽게 판단할 수 있다는 것일까? 산소의 라티머 도표를 예로 들어 알아보자.

가장 왼쪽의 O2 산소 산화수는 0, 가장 오른쪽의 H2O 산소 산화수는 - 2이다. 가운데 H2O2 산소 산화수는 - 1이다. 라티머 도표에서 확인 가능한 두 환원 반응과 전위는 다음과 같다.

그런데, 과산화수소(H2O2)가 자체 산화-환원 반응을 한다는 것은 스스로가 산화종이면서 동시에 환원종이 된다는 뜻이며, 아래와 같이 화살표 방향을 뒤집어 나타내는 것이 보다 직관적이다.
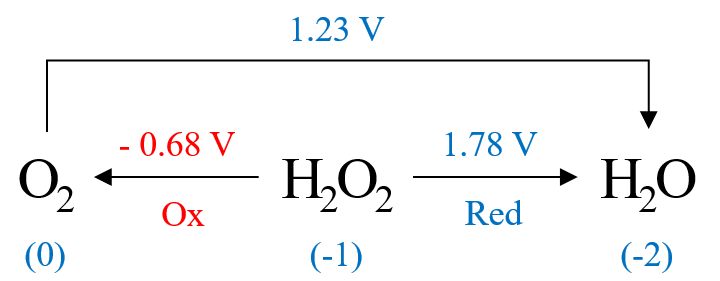
①의 역반응이 H2O2의 산화 반응이며, 산화 전위는 기존 환원 전위의 부호만 바뀐 - E 1˚ = - 0.68 V 이다. 그리고, 반응 ②는 H2O2의 환원 반응으로 환원 전위는 도표에 나타난 그대로 E 2˚ = + 1.78 V이다.
과산화수소의 자체 산화-환원 반응을 화학반응식으로 나타내면 다음과 같다.

산화 반응, 환원 반응 모두 n = 1로 같으므로, 결국 E 3 = E 2 - E 1 형태가 되고, 전지 전위 E 3˚ = + 1.10 V임을 알 수 있다. 전지 전위인 E 3˚ > 0 이라는 것은 자체 산화-환원 반응에 대한 깁스 자유에너지가 ΔG < 0 이라는 뜻이며, 해당 반응은 저절로 일어날 수 있음을 뜻한다.
결과적으로, 라티머 도표에 표현된 어떤 화학종(H2O2) 우측 화살표의 환원 전위 값(1.78 * n )이 왼쪽 화살표의 환원 전위 값(0.68 * n ) 보다 크면, 해당 화학종은 자체 산화-환원 반응에 대해 필연적으로 양(+)의 전지 전위(E > 0)와 음의 자유에너지 변화(ΔG < 0)를 갖게 되어, 불균등화 반응을 일으킬 수 있다. (어떤 화학종 좌우의 환원 반응의 산화수 변화가 같은 간격이라면, 좌우 환원 전위 값의 크기만 단순 비교하여 전체 반응의 전지 전위를 결정하는 것도 가능하다.)
3. 참고
[1] Daniel C. Harris, Quantitative Chemical Analysis, 9th, 321p
[2] chem.libletexts.org -4.11: Latimer Diagrams
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 상자 길이 변화로 설명하는 물질의 색(feat. 짝불포화계) (4) | 2024.11.13 |
|---|---|
| 신호등 반응 (인디고 카민의 산화-환원 반응) (5) | 2024.11.02 |
| 이온의 선택적 침전 (Selective Precipitation) (0) | 2024.09.30 |
| 상자 속 입자 (The Particle in a Box, PIB) (5) | 2024.08.03 |
| 산-염기 지시약의 작용 원리 (0) | 2024.07.06 |



