이온의 선택적 침전 | Selective Precipitation
본문은 Oxtoby, Principles of Modern Chemistry 7th, 16-6. Selective Precipitation of Ions과 Peter Atkins, Chemical Principles 6th, 13-11. Selective Precipitation 내용을 바탕으로 작성되었습니다.
1. 침전 반응과 용해도곱상수
여러 금속 이온이 섞인 혼합물을 분리하는 방법 중 한 가지는 침전을 만들어 용액으로부터 제거하는 것이다. 예를 들어 나트륨 이온(Na+)과 은 이온(Ag+)이 섞여있는 혼합 용액에 과량의 염화 이온(Cl-)을 첨가하면, 염화 은(AgCl)이 침전물로 가라앉고, 이를 여과하면 용액 내 Na+과 Ag+을 분리할 수 있다.

여기서 중요한 사실은 첨가된 Cl-이 두 금속 이온 중에 Ag+과 선택적으로 침전을 만든다는 것이며, 만약 Cl-이 두 금속 이온 모두와 반응하여 침전을 만들 수 있다면, 분리 과정은 위 예시처럼 간단치는 않다.
납 이온(Pb2+)과 은 이온(Ag+)이 여기에 해당하는데, 두 금속 이온 모두 Cl-과 반응하여 침전을 만들 수 있다. Pb2+, Ag+이 혼합된 용액에 Cl-이 첨가되는 상황을 살펴보자.
두 금속 이온 모두 Cl-과 반응해서 각각 염화 은(AgCl), 염화 납(PbCl2) 침전을 만들 수 있으며, 생성된 AgCl과 PbCl2의 용해 평형 반응식과 용해도곱 상수(Ksp)를 보면, 물에 잘 녹지 않음을 알 수 있다.

조금 더 자세히 AgCl과 PbCl2의 Ksp를 비교해 보면, AgCl의 Ksp 값이 훨씬(약 106 배) 작다. Ksp는 용해도곱(solubility product) 상수로, 침전물과 용해된 이온들 사이의 평형에 의해 결정되는 값이다. 침전이 물에 잘 용해될수록 용액 내 이온 농도가 높아지고, 큰 Ksp 값을 갖게 된다.
AgCl 침전의 용해도가 PbCl2 보다 훨씬 작은데, 이는 역반응인 침전 생성 반응은 AgCl이 PbCl2 보다 훨씬 우세함을 뜻한다. 두 침전의 Ksp 값에 차이가 있고, AgCl 생성이 PbCl2 보다 유리하다면, Ag+, Pb2+ 혼합 용액에 절묘한 양(농도)의 Cl-을 넣어, Ag+만 침전으로 떨어뜨려 용액으로부터 제거하는 것도 가능하다는 것이다.
Na+와 Ag+ 혼합물과 같이 한 가지 금속 이온만 침전 반응에 참여하는 앞선 예시와 달리, Ag+, Pb2+ 혼합물은 공통 이온(Cl-)에 의해 두 금속 이온 모두 침전을 만들 수 있다. 그럼에도, 두 침전의 용해도 차이에 따라 선택적 침전이 가능한 농도 구간이 분명 존재하고, 이를 활용하면 두 금속 이온의 정량적인 분리가 가능하다. (물론, 용해도가 매우 비슷한 금속 침전물에까지 적용하기는 어렵겠지만...)

2. 선택적 침전 (Selective Precipitation)
AgCl, PbCl2 두 침전의 Ksp를 비교하면, AgCl < PbCl2이다. 순수한 물에서 AgCl 보다 PbCl2이 훨씬 많이 녹는다. 침전 생성 관점에서 본다면, AgCl이 PbCl2 보다 훨씬 침전되기 쉬우며, 이는 용액 내 Cl- 농도에 따라 Ag+는 AgCl로 침전되지만, PbCl2은 전혀 침전되지 않는 구간이 있음을 말한다. 이 구간에서는 Ag+ 이온만 선택적 침전(selective precipitation)이 일어난다고 할 수 있다.
Cl-을 대중없이 과량 첨가하여 용액 농도가 매우 매우 진하다면, 용액에 Cl-이 넘쳐나기 때문에 Ag+, Pb2+ 가리지 않고, AgCl, PbCl2 침전이 마구잡이로 생겨버릴 것이다.
반대로, Cl-을 매우매우 소량 첨가하여 농도가 아주 묽다면, 두 침전 모두 생기지 않거나, AgCl만 쬐~금 만들어질 수도 있다. 물론, 이런 경우 용액에는 여전히 많은 양의 Ag+가 침전되지 않은 채 Pb2+와 섞여 있다는 사실은 변함없다. 대신, PbCl2가 혹시나 침전될까 걱정할 필요는 없겠다.
이온의 선택적 침전이란 [2] Ksp값이 큰 침전(PbCl2)는 생성되지 않으면서, [1] Ksp값이 작은 침전(AgCl)은 생성되는 Cl- 농도 범위에 관한 것이다. 만약, 선택적 침전이 가능한 농도 범위에서 Ag+를 모두(최대한) 침전으로 제거하고, 용액에 Pb2+만 온전히 남길 수 있다면, 혼합된 두 금속 이온을 (거의) 완전히 분리할 수 있다는 것이며, 이는 선택적 침전이 가능한 Cl- 농도 범위에서 가질 수 있는 최댓값을 찾는 것이라고 할 수 있다.
[1]
먼저, Ksp가 작은, 생성에 유리한 AgCl 한 톨이 처음 생기기 시작하는 Cl- 최소 농도를 찾아보자.
0.1 M Ag+ 용액이 AgCl 침전을 만들기 위해서는 용액 내 존재하는 이온 농도의 곱 Q = [Ag+][Cl-]이 Ksp 값보다 커야 한다. AgCl이 생기기 시작하는 Cl-의 농도는 다음과 같다.

[Cl-]가 1.6 × 10-9 M 보다 크면, AgCl 침전이 생긴다. Cl- 농도가 더 진해지면, 침전은 더 생길 것이다. 농도가 더더 진해지면, 침전은 더더 생길 것이다. 그렇다면, Cl- 농도는 얼마까지 진해질 수 있을까? 사실, 여기서 중요한 것은 잘 생성되고 있는 AgCl 침전이 아니다. 한 톨이라도 생성되면 곤란한 PbCl2 이다.
[2]
언제 PbCl2 침전 처음으로 생겨날까? 우리는 PbCl2 침전이 생기기 직전 Cl- 농도에서 "똬악" 멈춰야 할 필요가 있다. 그래야 Ag+은 최대로 침전시켜 AgCl로 제거하고, Pb2+는 온전히 용액에 남긴 상태가 되기 때문이다.
0.1 M Pb2+ 용액에서 PbCl2 침전이 처음 생기기 시작하는 Cl- 농도를 찾아보자.
Cl- 첨가 전, 용액은 [Pb2+] = 0.1 M , [Cl-] = 0.0 M 이므로, 반응지수 Q = [Pb2+][Cl-]2 = 0.1*(0.0)2 = 0이다. 현재는 Q < Ksp인 상태인데, Q 가 Ksp 보다 커진다면 용액 내 이온이 평형에서의 이온 농도에 비해 너무 많은 상태가 되므로, 침전이 생성되는 방향(←)으로 반응이 진행된다.
다시 말해, PbCl2가 한 톨도 생성되지 않기 위해서는 용액 내 존재하는 Pb2+, Cl- 농도의 곱 [Pb2+][Cl-]2 값이 Ksp 를 절대 넘어서면 안 된다.

결국, 용액 내 [Cl-] = 0.049 M 보다 진해질 수 없다. 이보다 작아야 한다. Cl- 농도가 0.049 M 보다 작다면, 어쨌든 두 번째 침전인 PbCl2는 생성되지 않고, 용액 내 Cl- 농도가 0.049 M가 될 때까지는 용액 내 Ag+가 지속적으로 Cl-와 반응하여 AgCl 형태로 제거된다.
그렇다면, 용액 내 Cl- 농도가 정확하게 0.049 M일 때, 혼합 용액 내 Ag+은 얼마나 남아있을까? 용액 내 남아있는 Ag+, Cl- 이온 농도 곱 = [Ag+][Cl-] = Ksp 값을 만족해야 하기 때문에, [Ag+] 값이 절대로 0이 되지는 않겠지만, 두 이온을 대부분 분리했다고 말할 정도는 될까?
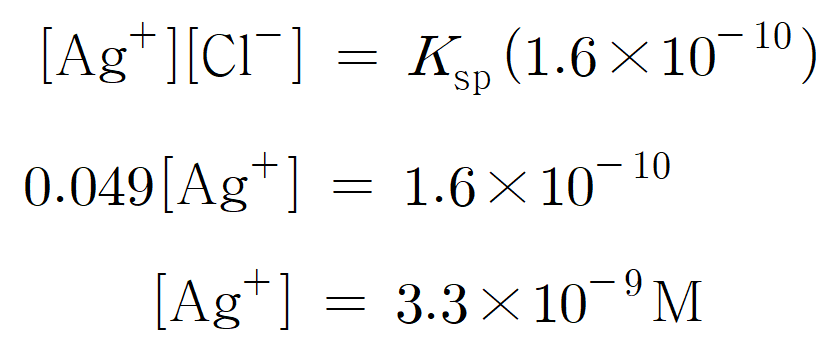
즉, 수용액 속 남아있는 Ag+ 농도는 3.3 × 10-9 M이다. 초기 농도가 0.1 M이었고, 현재 0.0000000033 M이므로 Ag+ 농도가 줄긴 엄청 줄었다. 얼마나 줄어든 것이냐면, 초기 Ag+ 이온 수를 100,000,000 개(1억, 108)였다고 하면, 단 3 개의 Ag+만 여전히 침전되지 않고 용액에 남아있다는 뜻이다. 아무튼 엄청 쪼금이다.
정리하자면, 0.1 M Ag+, Pb2+ 혼합 용액에서 선택적 침전이 일어나는 [Cl-] 범위는 다음과 같다.
1.6 × 10-9 M < [Cl-] < 0.049 M
AgCl과 PbCl2의 용해도곱상수인 Ksp 식을 조금만 변형하여 선택적 침전이 나타나는 구간을 그래프에 시각화할 수 있다. 두 침전의 공통 이온인 Cl- 농도에 관한 항을 우변으로 넘기고, 양변에 log(로그)를 취해보자.

정리된 식에 대해, Cl- 농도를 x축으로, 금속 이온(Ag+ 또는 Pb2+)의 농도를 y축으로 설정한 뒤, 축 간격을 로그 스케일로 도시하면, 음의 기울기를 갖는 직선 형태 그래프를 얻을 수 있다.
AgCl의 용해 평형 그래프는 -1의 기울기를, PbCl2 용해 평형 그래프는 -2의 기울기로 나타나며, 각 직선에 의해 나뉜 구획에 따라 침전 생성 유무를 알 수 있다.
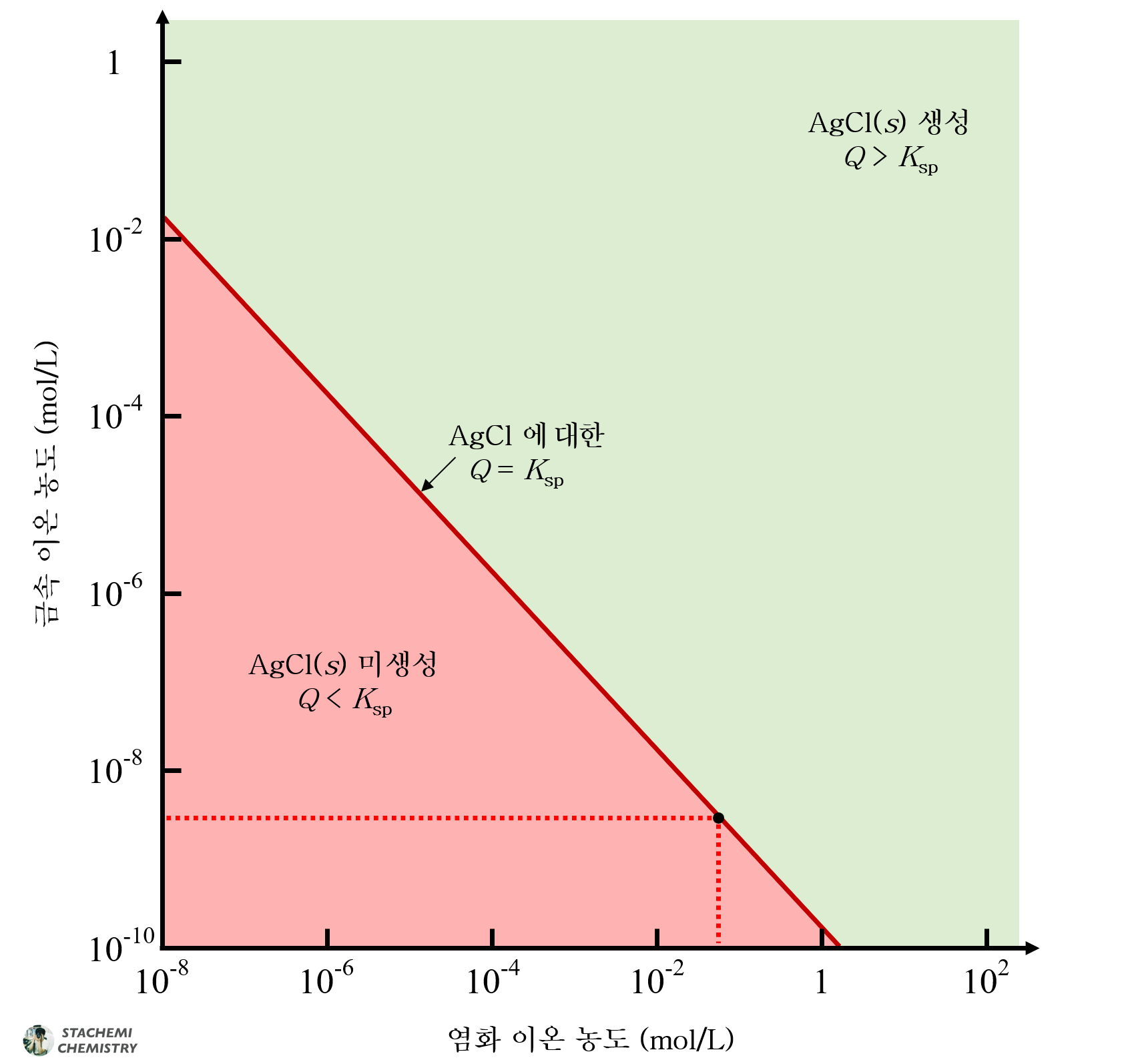
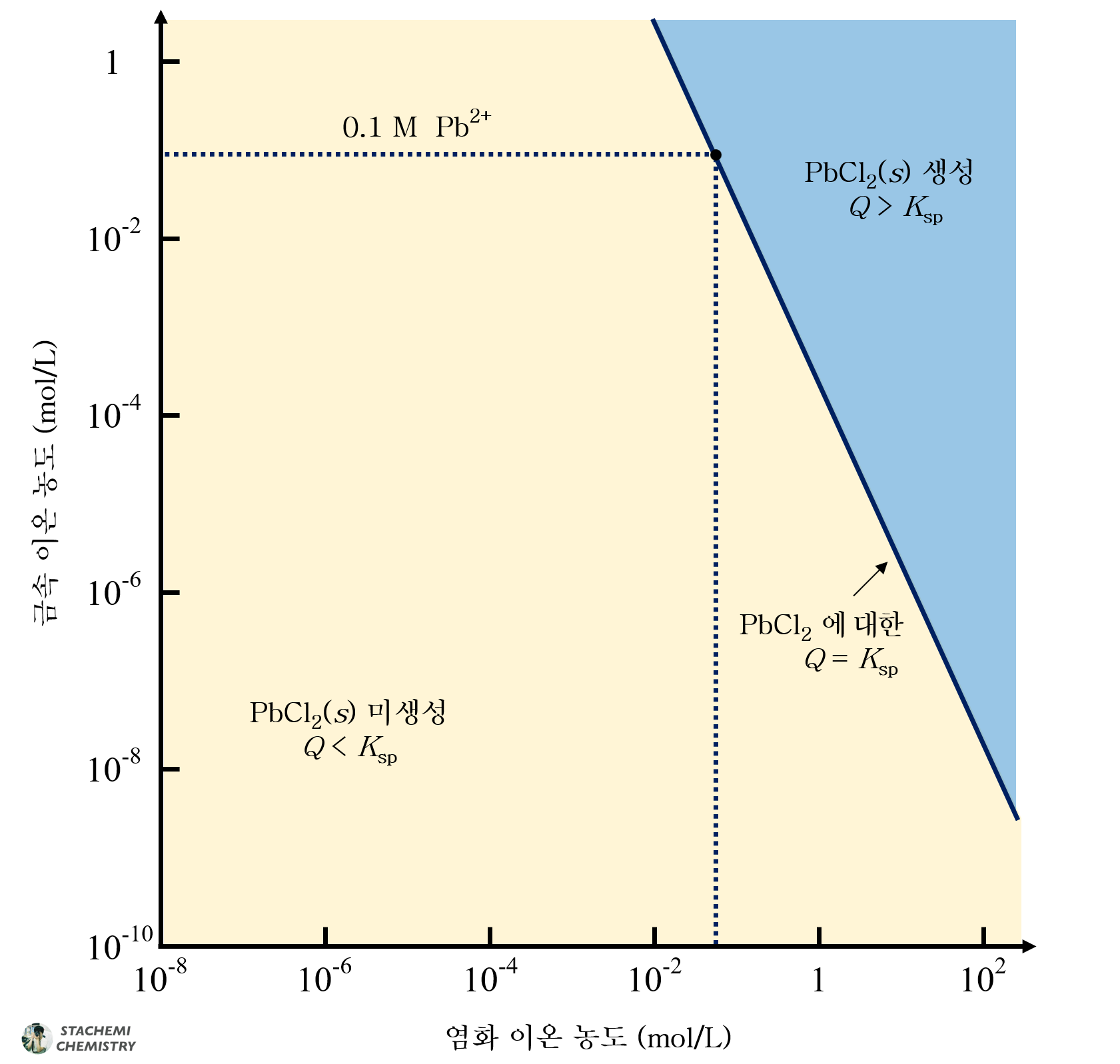
위 그래프를 하나의 좌표 공간에 나타내면 다음과 같다.
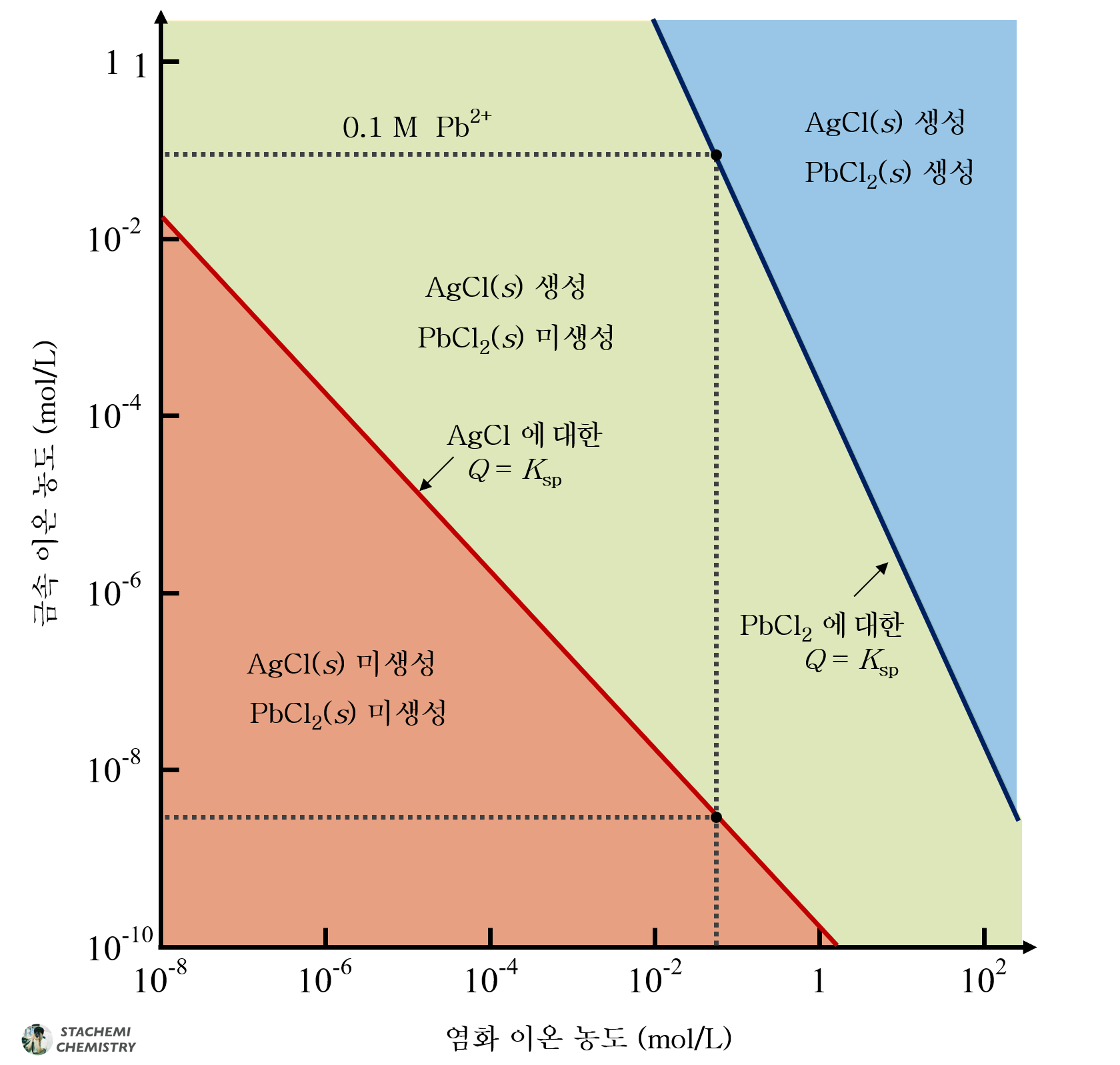
3. 연습하기
[예제]
Atkins, Chemical Principles, 6th, Example 13.11.
어떤 해수 시료에 0.05 M의 Mg2+(aq)와 0.01 M의 Ca2+(aq)가 녹아 있다. 이 시료에 고체 NaOH를 첨가했을 때, (a) 각 침전이 일어나기 시작하는 OH- 농도를 결정하고, (b) 두 번째 금속 이온에 의해 침전물이 만들어지기 시작할 때 용액 중에 남아 있는 첫 번째 금속 이온의 농도를 계산하시오.
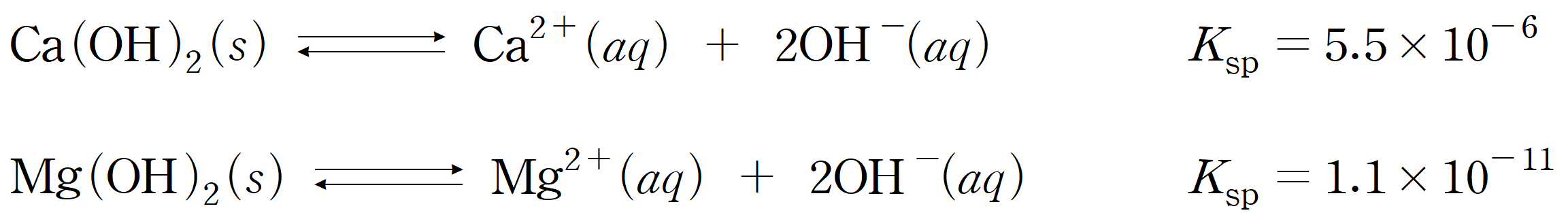
[풀이]
(a) 두 침전의 용해도곱상수 Ksp를 비교해 보면, Mg(OH)2 < Ca(OH)2로 Mg(OH)2의 용해도곱 상수가 작고, 용액 내 포함된 금속 이온의 농도도 Mg2+ > Ca2+이기 때문에, Mg(OH)2가 Ca(OH)2 보다 먼저 침전될 것을 예상할 수 있다. 용액 내 Q > Ksp 를 만족하면, 침전물이 생성되므로,
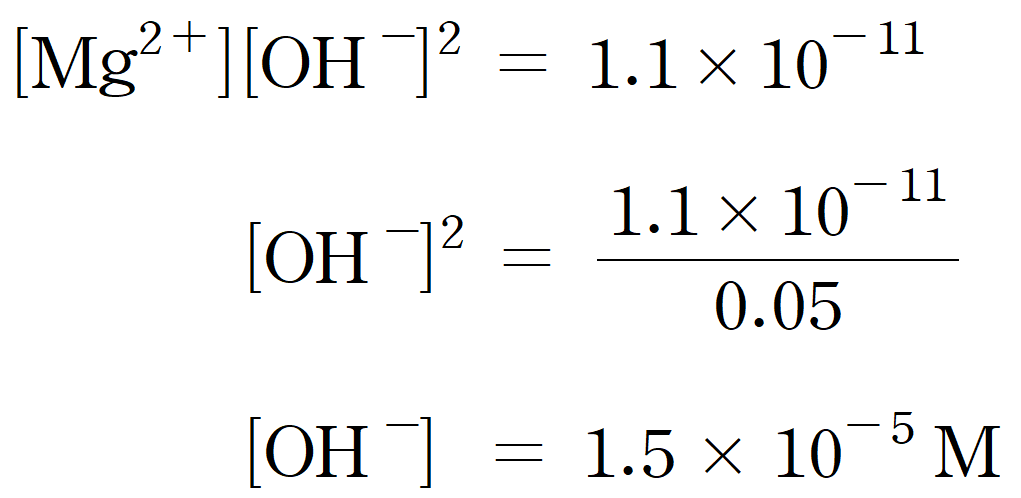
따라서 첫 번째 침전인 Mg(OH)2가 생성되기 시작하는 [OH-] = 1.5 × 10-5 M 이다. 두 번째 침전이 생성되기 시작하는 OH- 농도도 이어서 구해보면,
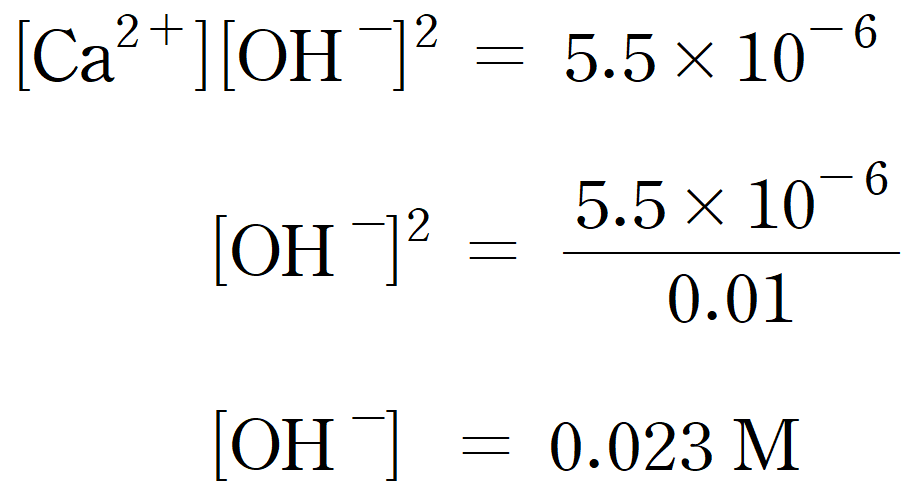
따라서 두 번째 침전이 생성되기 시작하는 [OH-] = 0.023 M 이다. 따라서 선택적 침전이 가능한 구간을 pH 범위로 나타내보면, 약 9.18 < pH < 12.36 라고 할 수 있다.
(b) 그리고, 수용액 내 OH- 농도가 0.023 M 일 때, 용액 내 남아있는 [Mg2+]를 구해보면, 다음과 같다.
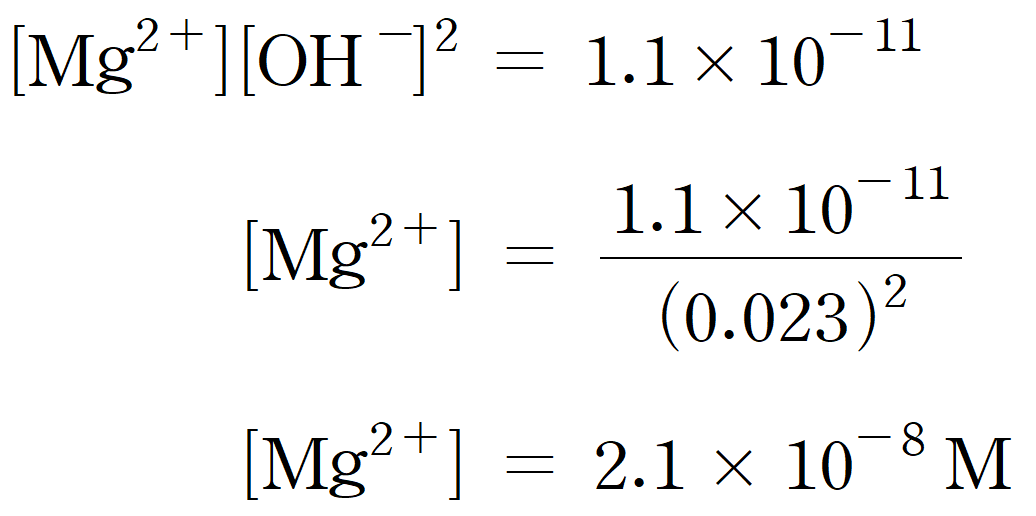
두 번째 침전인 Ca(OH)2가 생성되기 시작할 때, 용액 내 남아 있는 금속 이온의 양은 매우 매우 매우 적음을 알 수 있다.
이온의 선택적 침전
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
'화학 > 화학이야기' 카테고리의 다른 글
| 신호등 반응 (인디고 카민의 산화-환원 반응) (5) | 2024.11.02 |
|---|---|
| 라티머 도표와 불균등화 반응 (0) | 2024.10.11 |
| 상자 속 입자 (The Particle in a Box, PIB) (5) | 2024.08.03 |
| 산-염기 지시약의 작용 원리 (0) | 2024.07.06 |
| [교과서 읽기] 생체 내 완충 작용 (4) | 2024.06.09 |



