0. 들어가기
복직 후 학교 생활이 바쁘다는 핑계로 모의고사 풀이 업로드를 하지 못했다. 그런데 여름방학 방과후학교로, 화학1 개설이 거의 확실시되어 이를 준비할 겸 풀이 업로드를 마음먹었다. 물론, 2회 고사가 끝난 지 일주일밖에 안되었고, 학기말 성적 처리, 3학년 생기부 정리와 모든 학년 세부능력 특기사항 작성 등 이것저것 학기 마무리가 더 바쁘지만, 이럴 때일수록 급하지 않은 일이 재미있는 법이다. 마치 학생 시절 시험기간만 되면, 거들떠보지 않던 다큐멘터리와 뉴스가 재밌듯 말이다.
지난 6월 3일에 시행된 평가원 수능 모의평가 화학1 3점 문항 풀이를 업로드한다. 물론, 풀이와 해설 영상이 EBSi 사이트와 Youtube EBS 채널에 이미 업로드되어 있기에 기존 풀이와 영상만 해도 충분히 해결가능한 경우에는 관련 풀이를 참고하면 되겠다.
이전 풀이들과 마찬가지로, 시간 내 빠르게 정답을 찾아내는 방법을 서술하기보다, 풀이(전개) 과정을 최대한 풀어내어 설명하는 것을 목적으로 하였다.
3점 문항은 4번, 5번, 7번, 8번, 12번, 13번, 16번, 17번, 19번, 20번 총 10문항이다.
2022학년도 수능 6월 모의평가(2021.6.3.) 화학1 3점 문항 풀이

정답 : ④
풀이 :
분자의 구조와 결합각에 관한 문제이다. 분자의 구조와 그에 따른 결합각은 중심 원자의 결합수(공유 전자쌍 수)와 비공유 전자쌍의 수에 따라 결정된다. 공유 전자쌍 수와 비공유 전자쌍 수의 합을 입체수(steric number)라 한다.
NH3의 중심 원자, 질소(N)는 공유 전자쌍 3쌍, 비공유전자쌍 1쌍을 가지며, AX3E1 타입으로 입체수는 4(삼각 피라미드형)이다. α 는 109.5 ˚보다 작은 값, 약 107˚ 를 갖는다. 비공유 전자쌍이 공유 전자쌍에 비해 강하게 반발하여 결합각을 좁히기 때문이다. F2CO의 중심 원자인, 탄소(C)는 공유 전자쌍 3쌍만을 가지며, AX3 타입으로 입체수는 3(평면 삼각형)이다. 결합각 β = 120˚ 정도를 갖는다. (참고로, 입체수를 따져주기 위해 공유 전자쌍의 개수를 셀 때, 다중 결합은 신경 쓰지 않는다. 다중 결합은 전체적인 분자 구조에 영향을 주지 않기 때문이다.)
CCl4의 중심 원자, 탄소(C)는 공유 전자쌍 4쌍 만을 가지며, AX4 타입으로 입체수는 4(정사면체)이다. 따라서 결합각 γ = 109.5˚ 이다. 결합각의 크기를 비교하면, β > γ > α 이다.

정답 : ① ㄱ
풀이 :
동적 평형에 관한 문제다. 동적 평형 상태에서는 정반응의 속도와 역반응의 속도가 같다. 즉, 물의 증발 속도와 수증기의 응축 속도가 같다. t2에서 동적 평형 상태에 도달했으므로, t2 이후부터는 물의 증발과 수증기의 응축이 같은 속도로 일어나고 있다. 다만, 겉보기에만 아무런 변화가 없는 것처럼 보일 뿐이다. 해당 <보기>는 동적 평형 개념을 확인하기 위한 문제에서 자주 사용될 수 있는 문장 중 하나이다. (보기 ㄴ, 거짓)
또한, 평형 도달 전인 t1에서는 물의 증발 속도가 수증기의 응축 속도보다 빠르며, 이에 응축 속도/증발 속도 < 1 의 값을 갖는다. (보기 ㄱ, 참)
그리고, 초기 조건이 진공 상태이므로, 초기 수증기량은 0 mol에서 점차 증가하여 t2에 d mol에 다다르지만, 초기 물의 양은 b mol 까지 감소하게 된다. 즉, 언제나 a > b 이고, c < d이다. 따라서 a/c ≠ b/d 이다. (보기 ㄷ, 거짓)

정답 : ⑤ ㄴ, ㄷ
풀이 :
분자 (가)와 (나)는 X와 Y가 H로 포화된 수소화물이다. 2주기 원소이므로, (가)와 (나)가 될 수 있는 분자는 BH3, CH4, NH3, H2O, HF 와 같은 것들이다. 그런데, 분자 내 옥텟 규칙을 만족한다고 했으므로, BH3는 후보에서 제외된다.
(가)는 비공유 전자쌍이 0, (나)는 2 이다. 중심 원자가 수소화물을 각각 만들었을 때, 중심 원자의 비공유 전자쌍의 수는 C = 0, N = 1, O = 2, F = 3 이다. 따라서 (가)는 CH4, (나)는 H2O 임을 알 수 있다. a = 4 , b = 2 이다.
(다)는 C = 1, H = 2 이며, 공유 전자쌍의 수가 4개이다. 즉, 중심 탄소는 산소와 이중 결합을 해야 하며(보기 ㄴ, 참), 화학식은 CH2O, 폼알데하이드라는 것을 알 수 있다. c = 1 이다. 따라서 a ≠ b + c 이다. (보기 ㄱ, 거짓)
마지막 보기의 XY2 는 CO2이므로, O=C=O 형태의 직선형 구조로, 공유 전자쌍 수는 4개이다. (보기 ㄷ, 참)

정답 : ③ ㄱ, ㄷ
풀이 :
껍질 모형을 통해 A는 1주기, 1족 원소인 수소(H), B는 3주기, 17족 원소인 염소(Cl) 임을 알 수 있다. C와 D는 동일한 전하의 양이온 음이온을 생성하는데, 주어진 화학반응식에서 A와 D의 전하 비가 1 : 2 임을 알 수 있다. 즉, Dm-는 -2가를 나타냄을 알 수 있다. D는 2주기 원소인 산소(O), C는 3주기 원소인 마그네슘(Mg)이다.
ㄱ. m = 2 이다. (참)
ㄴ. (가)는 2HCl + MgO 반응에 의해 생성되는 물질이다. 금속 산화물과 산의 반응을 통해 H2O와 염이 생성된다. 이 반응에서 생성되는 염은 MgCl2 이다. (가)는 MgCl2로 이온 결합 물질이다. (거짓)
2HCl + MgO → MgCl2 + H2O (산-염기 반응, 산화수 변화 없음)
ㄷ. B2는 Cl2, D2는 O2이다. Cl2의 비공유 전자쌍의 수는 6쌍, O2의 비공유 전자쌍의 수는 4쌍이다. 따라서 B2 > D2 이다. (참)

정답 : ③ ㄱ, ㄷ
풀이 :
농도를 아는 용액의 제조 과정에 관한 문제다. (나)에서 1 M 용액을 x [mL] 취했으므로, 취한 용질의 몰수는 x [mmol]이다. 용질 x [mmol] 을 이용하여 100 [mL] 용액을 제조했으므로, (다) 수용액 I의 농도는 x/100 [M] 이다.
같은 방법으로 (라)에서 1 M 용액을 y [mL] 취했으므로, 취한 용질의 몰수는 y [mmol]이고, 용질 y [mmol]을 이용하여 250 [mL] 용액을 제조했으므로, (마) 수용액 II의 농도는 y/250 [M] 이다.
실험 결과 및 자료를 살펴보면, 수용액 I과 수용액 II의 몰농도가 모두 a [M]이므로, x와 y를 각각 a로 바꾸어 표현할 수 있다.
x = 100a , y = 250a
x + y = 70 이므로 350a = 70 이며, a = 1/5 = 0.2 이다. (보기 나, 거짓) 자연스럽게 x = 20, y = 50 이다. (보기 가, 참)
또한, I과 II를 모두 혼합한 수용액에 포함된 A의 양은 x + y [mmol] 이므로, 20 + 50 = 70 [mmol] 이다. (보기 다, 참)

정답 : ② ㄴ
풀이 :
pH = -log [H3O+] 이다. (가) 용액의 [H3O+] 농도를 알고 있으므로, x와 a 의 관계를 찾을 수 있다.
x = - log(100a) , 100a = 10-x , a = 10(- x - 2) ......... ①
(나) 용액의 경우 [OH-] 농도를 알고 있으므로, pOH 를 이용하여, 또다른 x와 a 관계식을 찾을 수 있다. pH와 pOH의 합은 14이다. (Kw = 10-14, pKw = 14)
14 - 3x = - log(a) , a = 10(-14 + 3x) ......... ②
ㄱ. 위의 ①, ② 식을 통해 x = 3 임을 알 수 있다. (보기 ㄱ, 거짓)
- x - 2 = - 14 + 3x , 4x = 12 , x = 3
ㄴ. 따라서 (가) 용액의 pH = 3, (나) 용액의 pH = 9 이다. (가) 용액의 [H3O+] = 10-3 이며, a = 10-5 이다. 용액 (다)는 [H3O+] = [OH-] = b 이며, pH = pOH = 7 이다. b = 10-7 이다. a/b = 100 이다. (보기 ㄴ, 참)
ㄷ. (다) 용액의 pH = 7, (나) 용액의 pH = 9 이므로, pH는 (나) > (다) 이다. (보기 ㄷ, 거짓)

정답 : ① ㄱ
풀이 :
홀전자수와 제2 이온화 에너지를 통해 주어진 원소 W, X, Y, Z 가 무엇인지를 찾아야 한다. W ~ Z는 7 ~ 14 번 원소 중 하나라고 했으니, N, O, F, Ne, Na, Mg, Al, Si 중에서 찾아야겠다.
7번 질소(N)에서 14번 규소(Si)까지 홀전자 수를 세어 보면, N(=3), O(=2), F(=1), Ne(=0), Na(=1), Mg(=0), Al(=1), Si(=2) 이다. 홀전자수가 3개인 것은 15족, 질소(N) 뿐이며, 따라서 Z = 질소(N) 이다.
ㄱ. W는 홀전자수가 1개이며, 질소(Z) 보다 제 2 이온화 에너지가 작다. 주어진 7 ~ 14번 중 홀전자 수가 1개인 원소는 플루오르(F), 소듐(Na), 알루미늄(Al)이다. 플루오르(F)는 같은 2주기 원소이지만, 질소에 비해 큰 유효핵전하를 가지며, 이에 제 2 이온화 에너지가 크다. 소듐(Na)은 1족 원소로 매우 큰 제 2 이온화 에너지를 가져야 한다. 따라서 W = 알루미늄, 13족 원소이다. (참)
ㄴ. X와 Y는 모두 홀전자 수가 2개이며, 산소(O) 또는 규소(Si)이다. X는 Z(질소)보다 큰 제 2 이온화 에너지를 가지며, Y는 Z(질소)보다 작은 제 2 이온화 에너지를 갖는다. 이를 통해 X는 산소(O), Y는 규소(Si)임을 예측할 수 있다. 따라서 원자 반지름은 3주기 원소인 Y(규소)가 2주기 원소인 X(산소)보다 크다. Y > X (거짓)
ㄷ. 최대 스핀 다중도를 갖는 질소(Z)는 짝지은 전자를 갖는 산소(X)에 비해 더 큰 제 1 이온화 에너지를 갖는다.(경향성 역전) 따라서 분모 값은 Z > X 이다.

반면, 제 2 이온화 에너지는 1가 양이온의 전자 배치로 경향성을 생각해야 한다. Z+는 탄소 원자의 전자 배치처럼, X+는 질소 원자의 전자 배치와 같게 취급한다. 따라서 유효핵전하가 더 큰 X+ > Z+ 이다. 분자 값은 Z < X 이다.
정리하자면, 분모항은 X가 Z보다 작으면서 동시에 분자항은 X가 Z보다 더 크다. 따라서 [ 2차 IE / 1차 IE ]은 언제나 Z < X 이다. (거짓)

정답 : ② ㄴ
풀이 :
용기 (가)와 (나)에 Cl2 기체가 각각 1 mol씩 들어있다. 용기 (가)에는 35-35Cl2 분자와 37-37Cl2 분자의 혼합 기체 1 mol 이 들어있으며, (나)에는 35Cl, 37Cl 하나씩이 결합해서 만들어진 35-37Cl2 분자 1 mol이 들어있다. 용기 (나)에 포함된 35Cl 원자와 37Cl 원자는 각각 1 mol씩 있는 셈이다.
[참고] 문제에서 35Cl 원자 두 개가 결합해서 만들어진 기체 분자를 35Cl2 로 표기했지만, 원자와 분자의 직관적인 구분을 위해 35-35Cl2 형태로 표기하여 설명을 진행했다.
주어진 설명에서 35Cl의 양은 (가)에서가 (나)에서의 3/2 배라 했으므로, (가) 용기에는 35Cl 원자가 1.5 mol 존재한다. 자연스레 35Cl 원자 두 개가 모여서 만들어진 35-35Cl2 분자는 절반인 0.75 mol 이다. 또한 37-37Cl2 분자는 0.25 mol 이겠다.
ㄱ. (가)에서 35-35Cl2 분자 / 37-37Cl2 분자 = 0.75/0.25 = 3이다. (거짓)
ㄴ. (가)의 37Cl 원자수는 0.25 * 2 = 0.5 [mol] 이며, (나)의 37Cl 원자수는 1 [mol] 이다. 따라서 (나)에서가 (가)에서의 2배이다. (참)
ㄷ. 용기 (가)에는 35Cl 원자 1.5 [mol], 37Cl 원자 0.5 [mol] 이, 용기 (나)에는 35Cl 원자 1 [mol], 37Cl 원자 1 [mol] 이 존재한다. 즉, (가) 용기에 0.5 [mol] 의 35Cl 원자가 더 많고, (나) 용기에 37Cl 원자가 0.5 [mol] 더 많다. 35Cl과 37Cl은 질량수가 2 차이 나며, 원자 하나당 중성자수 차이는 2 개다. 즉, 용기 (나)에 중성자 2개 * 0.5 mol = 1 [mol] 만큼 더 많다는 것을 알 수 있다. (거짓)

정답 : ⑤ 2
풀이 :
화학 반응 전후, 반응물과 생성물은 모두 기체 상태이다. 온도와 압력이 일정한 조건에서 기체의 부피는 입자수(몰수)에 비례한다. 따라서 (가)의 15V, (나)의 16V 부피는 (가)와 (나)의 전체 몰수 비를 나타낸다고 할 수 있다. (몰비 = 15 : 16)
계산 편의를 위해 반응전 (가)의 A, B, D 입자수 합을 15 [mol], 반응후 (나)의 C, D 입자수 합을 16 [mol] 이라 하자. (가)와 (나)의 D 몰분율이 주어졌기 때문에 손쉽게 D의 몰수를 다음과 같이 찾을 수 있다.
(가)에서 D 몰분율 = 2/5 = 0.4 이며, D의 몰수는 0.4 * 15 mol = 6 [mol]
(나)에서 D 몰분율 = 3/4 = 0.75 이며, D의 몰수는 0.75 * 16 mol = 12 [mol]
1-1. (나)에서의 D의 몰수, 화학 반응식에서 C의 계수
(나)에 존재하는 입자는 C와 D 뿐이므로, C의 몰수는 16 - 12 = 4 [mol] 이다. D는 반응전(가) 6 [mol]에서 (나) 12 [mol]로 늘어났으므로, 생성된 D의 몰수는 6 [mol]이다.
또한 화학 반응식 D의 계수가 6이고, C와 D의 몰수 비 = 4 : 6임을 통해 C의 계수 c = 4 라는 것을 알 수 있다.
2A (g) + bB (g) → 4C (g) + 6D (g)
1-2. 반응전 A와 B의 몰수
반응 후 C와 D가 각각 계수와 같은 4 [mol], 6 [mol] 생성되었다는 것은 반응 전, A가 2 [mol], B가 b [mol] 반응했다는 뜻이다. 반응 전 전체 몰수는 15 [mol], 반응 전 D 몰수는 6 [mol] 이므로, B의 몰수는 15 - 2 - 6 = 7 [mol]이다. 그리고, B의 계수 b = 7 이다.
2A (g) + 7B (g) → 4C (g) + 6D (g)
2-1. 반응전 질량 = 반응후 질량
반응 후 (나) 실린더 내부 기체 C, D의 총 질량은 9w/14 + 66 [g] 이다. 이 질량은 반응전 A, B, D의 질량의 합과 같아야 한다. 질량보존 법칙이 성립해야 한다.
2-2. 반응전 B의 질량 [x] 구하기
반응 전, A는 w [g] 존재했으며, B는 알 수 없다. 우리가 알고 있는 것은 A와 B의 분자량 [g/mol] 비 7 : 4 이다. 그리고, 반응 전 존재했던 A와 B의 몰 [mol] 비가 2 : 7 이었다는 것을 알고 있다. 반응 전 존재했던 A, B의 질량을 분자량으로 나누면, 해당 분자의 몰비를 구할 수 있다. [g / [g/mol]] 초기 존재한 b의 질량을 x라 하면,
[몰비] A : B = 2 : 7 = [w/7] : [x/4]
7 * [w/7] = 2 * [x/4] , x = 2w
반응 전 B의 질량이 2w 임을 알았다.
2-3. 질량 보존 법칙
반응 전 A, B, D 질량의 합 = 반응 후 C, D 질량의 합으로 식을 세워서 w를 구하자.
w [g, A 질량] + 2w [g, B 질량] + 33 [g, 반응전 D 질량] = 9w/14 [g, C 질량] + 66 [g, 반응후 D 질량]
3w - (9w / 14) = 33 , w = 14
3. 마무리
문제에서 요구하는 b, c, w 를 모두 구했다. b = 7 , c = 4 , w = 14 이다. 따라서 bc / w = 2 이다.


정답 : ④ 0.1
풀이 :
도대체 문제는 무엇을 알아보려고 한 실험이었을까? 2가 산 용액에 1가 염기와 2가 염기를 마구잡이로 넣고, 결론은 중화되어 중성이 되었다는 결론을 내린 이 실험은 무엇을 위해 이런 수고로운 과정을 진행했을까? 잘모르겠다. 현실 어떤 실험 도중에 이런 상황을 맞이할 수 있는지도 잘 모르겠다. 1가인지 2가인지 알수도 없는 염기를 섞은 뒤, 이온의 몰농도 합은 어떻게, 또 왜 측정했는지... 양이온 수와 음이온 수 비율은 왜 측정하였는지... 사실, 이런 의문은 문제를 풀고, 고득점을 받는데 아무 도움이 되지 않는다. 의미없이 시간만 잡아먹을 뿐...
...
0.3 M 2가 산인 H2X 용액 V mL가 적정액(분석 대상)이다. 중화 반응에 사용된 초기 H+ 이온의 수는 0.6V mmol 이다.
0.3 M * V mL * (2가) = 0.6V [mmol]
이후 실험 과정 (가), (나), (다)를 통해 염기 용액 A와 B가 총 3회에 걸쳐 첨가된다. 5 mL의 A, 15 mL의 B, x mL의 B가 첨가되어 결국 혼합 용액 III이 중성이 되었으니, 총 첨가된 염기의 몰수는 초기 산의 몰수와 같은 0.6V mmol 이다.
A 용액 5mL + B 용액 (15 + x) mL 에 포함된 OH- 몰수 = 0.6V [mmol]
염기 용액 A와 B가 각각 무엇인지를 찾기 위해서는 혼합 용액에서의 음이온/양이온 비율을 활용해야 한다. 2015 개정 교육과정의 수능 산-염기 중화 반응 문제는 2가 산과 2가 염기를 통해 학생들의 시간을 뺏고자 하는 컨셉인듯 하다. 그닥 반갑지는 않다.
고득점을 목표로 하는 학생의 경우 1가 산에 1가 염기를 첨가한 경우, 1가 산에 2가 염기를 첨가한 경우, 2가 산에 1가 염기를 첨가한 경우, 2가 산에 2가 염기를 첨가한 경우에 대해 전체 이온의 수, 양이온의 수, 음이온의 수가 어떤 식으로 달라지고, 비율은 어떻게 달라지는지를 사전에 연습해두고, 표로 정리해본다면 시험장에서 고민하는 일을 줄일 수는 있겠다.
각 경우에 따라 중화 반응 전후의 전하 균형 관점을 찾아내는 것이 중요하다. (개인적으로는 이렇게까지 해야 하나 싶지만, 학생들 입장에서는 당장 눈앞에 닥친 일이니 그렇게 말하는 것일 뿐이다. 표로 정리해서 학생들에게 결과만 외우라고 할수도 있지만, 직접 시간내어 해보는 것을 권한다. 그래야 자기 기억에 남고, 외운 것에 믿음이 생긴다.)
...
1. 첨가한 염기 종류 A, B 파악하기
문제 상황은 두 가지 염기 A와 B를 차례로 넣었으며, 어느 것이 1가 염기, 어느 것이 2가 염기인지는 알지 못한다. 1가 염기와 2가 염기를 첨가할 때, 용액의 양이온 수와 음이온 수 비율에 차이가 생기게 되며, 이를 통해 어떤 염기가 A, B인지를 찾아나가야 한다.
초기 2가 산 용액의 경우 물에서 완전히 이온화한다. 초기 H2X의 몰농도와 부피를 통해 양이온과 음이온의 몰수를 각각 나타내면, H+ 이온 = 0.3V * 2가 = 0.6V [mmol], X2- 이온 = 0.3V [mmol] 이다. 용액 내 H+ : X2- 개수 비는 2 : 1, 음이온/양이온 = 1/2 이다.
[참고] 1가 산 용액은 양이온(H+) : 음이온(X-) 비율이 1 : 1이다.
1가 또는 2가 염기를 첨가했을 때, 용액 내 양이온, 음이온 수의 변화를 살펴보면 다음과 같다. 염기를 계속 첨가하면, 결국 중화점에 도달할테니 초기 비율과 중화점에서의 비율을 살펴보면, 이해가 쉽다.
2가 산 + 1가 염기 → 음이온/양이온 수 비율 = 초기 산성 용액과 비율 변화없음 (초기 비율 1/2 → 중화점 1/2)
2가 산 + 2가 염기 → 음이온/양이온 수 비율 = 초기 산성 용액 보다 양이온 비율 감소 (초기 비율 1/2 → 중화점 1/1)
혼합 용액 I의 비율은 3/5로 초기 3/6보다 양이온 비율이 감소했다. 따라서 과정 (가)에서 첨가한 염기 A는 2가 염기 Z(OH)2 임을 알 수 있다.
또한, B를 첨가한 뒤 만들어진 혼합 용액 II의 비율은 기존 용액 I의 비율 3/5를 그대로 유지하고 있다. 이는 첨가한 염기 B가 1가 염기인 YOH 라는 것을 알려준다. 문제에서 주어지진 않았지만, 최종 생성된 용액 III(중성)의 이온 비율 역시 3/5일 것이다.
2. 용액 I과 용액 II의 몰농도 비
실험 결과에서 주어진 또하나의 정보는 모든 이온에 대한 몰농도 비가 용액 I : 용액 II = 8 : 5 라는 사실이다. 용액 I은 2가 염기 5 mL 첨가, 용액 II는 2가 염기 5 mL + 1가 염기 15 mL 첨가된 용액이다. 용액 부피만 따져주면 다음과 같다.
용액 I 부피 = V + 5 [mL]
용액 II 부피 = V + 5 + 15 [mL]
염기 첨가시 용액 내 전체 이온수는 어떻게 달라질까?
2가 산에 2가 염기(Z(OH)2)를 첨가한 경우 H+ 이온 2개가 중화반응하여 소모되고, Z2+ 이온 하나로 대체된다. 따라서 용액 내 전체 이온 수는 점차 감소한다. (2H+ → Z2+)
추가되는 염기의 구경꾼 이온 전하(Z2+, Y+)가 중요하다. 추가되는 구경꾼 이온 전하와 중화 반응으로 사라지는 H+ 이온의 전하에 차이가 있으면, 전체 이온수는 감소한다. 반면, 추가되는 염기의 구경꾼 이온 전하가 H+와 같은 1가면, 전체 이온수는 변하지 않는다.
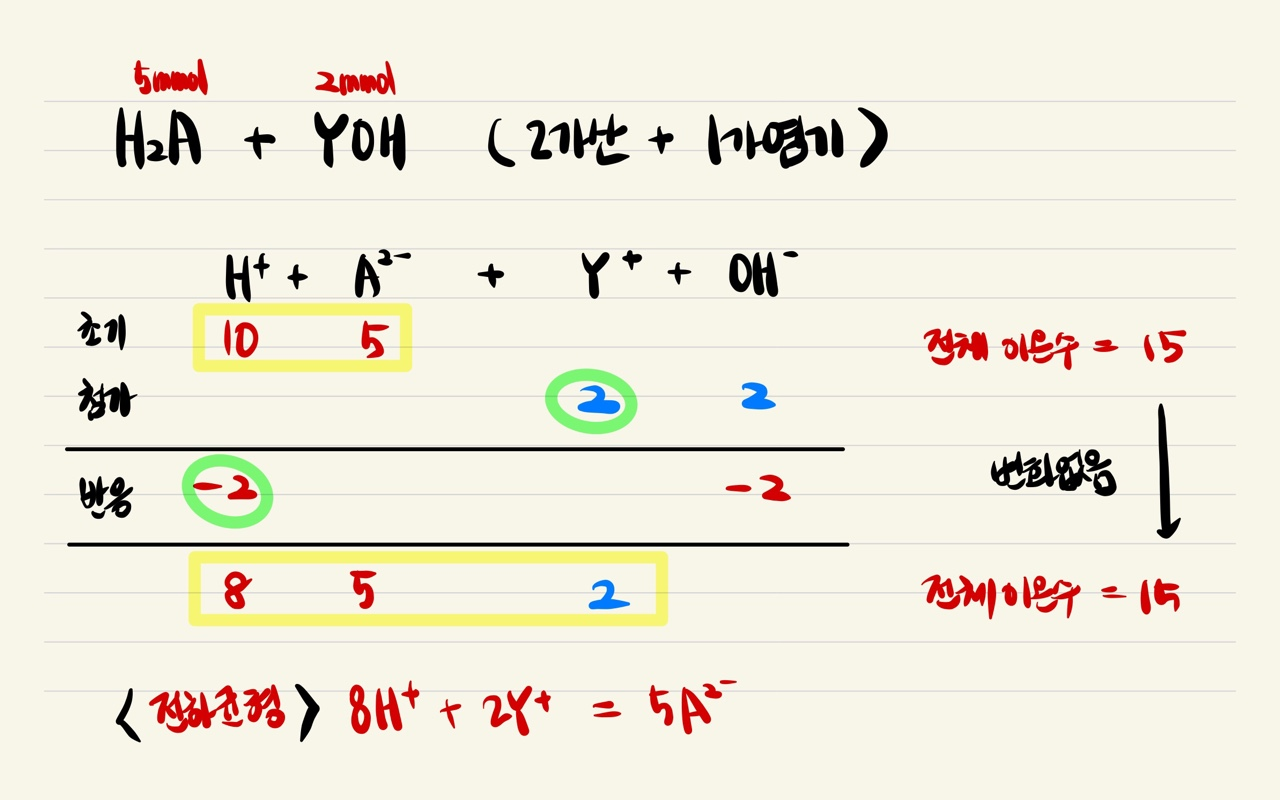
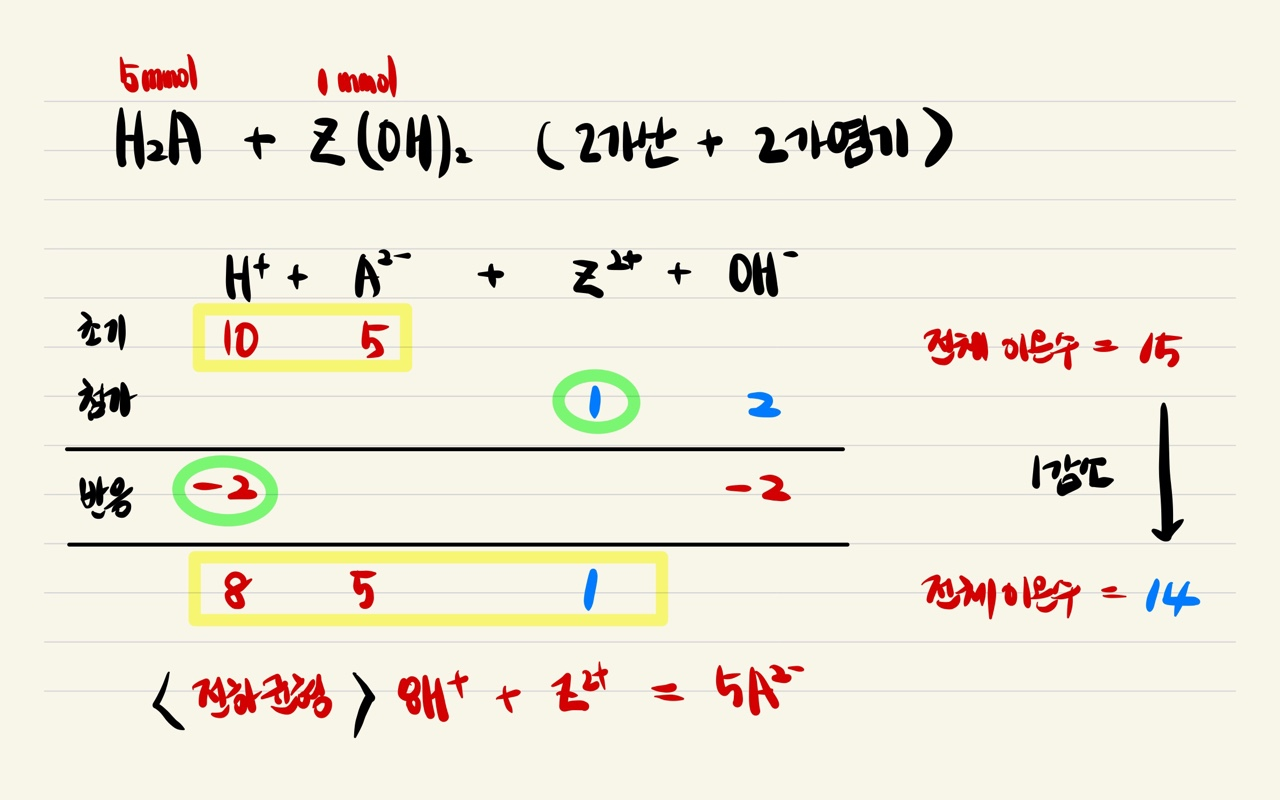
따라서 초기 산 → 용액 I의 과정에서는 전체 이온의 몰수는 감소하지만, 용액 I → 용액 II 과정에서는 1가 염기가 첨가되었으므로, 기존의 용액 I에서의 이온수가 유지된다. 즉, 전체 이온수는 용액 I과 용액 II가 같다. (물론, 양이온의 종류와 H+, Z2+, Y+ 비율은 다르다.)
용액 내 전체 이온수 변화가 없으므로, 용액의 전체 이온 농도 변화는 부피 변화에만 의존한다. 주어진 농도 비를 이용하여 비례식을 세우면 다음과 같다.

초기 산의 부피 V = 20 [mL] 이다. 따라서 초기 H+ 몰수 = 0.6 M * 20 mL = 12 [mmol] 이다.
3. Z(OH)2 농도 a 구하기
초기 H+ 몰수는 12 [mmol], X2- 몰수는 6 [mmol] 이다. 염기를 첨가하면, 중화점 이전까지 OH- 이온은 즉각 중화 반응에 참여하여 음이온 수는 변하지 않는다. 즉, 6 [mmol]이 일정하게 유지된다.
초기 산의 음이온/양이온 비율 = 6 [mmol] / 12 [mmol] = 3/6 이다. 염기를 첨가한 후 용액 I의 음이온/양이온 비율은 3/5로 양이온 비율이 감소한다. 중화점 이전까지 음이온 수는 변화가 없으므로, 반응에 참여한(감소한) H+ 몰수(첨가된 OH- 몰수)가 2 [mmol] 임을 알 수 있다.
Z(OH)2는 2가 염기이므로, 첨가한 Z(OH)2는 1 [mmol]이다.
1 [mmol] = a [M] * 5 [mL] , a = 0.2 M
4. 초기 H+ 몰수 = 첨가한 OH- → 중화
첨가한 염기의 종류 A, B, 부피, 농도를 모두 알아냈기 때문에, 초기 H+ 몰수와 첨가한 전체 OH- 몰수에 관한 등식을 세울 수 있다.
0.6V [mmol] = ( a * 2가 * 5 ) [mmol] + ( 0.4 * 15 ) [mmol] + ( 0.4 * x ) [mmol]
0.6V = 10a + 6 + 0.4x [mmol]
앞서 구한 V = 20 [mL] , a = 0.2 [M] 를 각각 대입해주면,
0.4x = 12 - 2 - 6 , x = 10 [mL]
문제에서 요구하는 xa / V = 2/20 = 0.1 이다.
2022학년도 수능 6월 모의평가 화학1 3점 문항 풀이
- 끝 -
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트하도록 하겠습니다. 위 문제의 출처는 한국교육과정평가원입니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2019학년도 4월(4.10.) 고3 학력평가 화학1 풀이 [10번] (0) | 2021.11.07 |
|---|---|
| 2021학년도 7월(7.7.) 고3 학력평가 화학1 풀이 [19번] (0) | 2021.07.21 |
| 2017학년도 PEET 화학추론(일반화학) 기출문제 5번 풀이 (0) | 2021.06.27 |
| 2017학년도 PEET 화학추론(일반화학) 기출문제 8번 풀이 (0) | 2021.06.25 |
| 2021학년도 3월(3.25.) 고3 학력평가 화학1 3점 문항 풀이 (0) | 2021.04.15 |



