지난 27일 고 3 마지막 학력평가가 시행되었다. 대부분 수시 접수를 마치고, 살짝은 애매한 분위기의 교실 상황이 머릿속을 스친다.
학생들마다 수시 원서 접수 유무, 수시 전형, 지원한 학교 등에 따라 서류 100%, 학업 면접 유무, 논술 고사, 수능 최저 유무 등 처한 상황이 모두 다르다 보니, 일관된 분위기를 유지하기 어렵다. 교실 속 공기에서부터 개개인의 말 못 할 고민들이 복잡하게 얽혀있음이 느껴진다. 극도의 예민함부터 극도의 태평함까지 느낄 수 있다. 고3 교실 치고는 참으로 아이러니하다.
사실, 이번 주에 학력평가가 있는지 몰랐다. 결합 이론 관련 글을 마무리하느라, 아이들 할로윈 생각하느라 학력평가를 봤는지도 몰랐다. 휴직 기간이 길어지면서 나도 긴장감이 덜해졌나 보다.
어쨌든 이번 10월 학력평가는 서울특별시교육청 주관으로 시행되었으며, 3점 문항은 2번, 9번, 10번, 12번, 14번, 16번, 17번, 18번, 19번, 20번으로 10 문항이다. 난이도는 전체적으로 평이했던 것으로 보인다.
그럼! 풀이 시작!
2020학년도 10월(10.27.) 고3 학력평가 화학1 3점 문항 풀이

2번 정답 : ② ㄴ
2번 풀이 :
원자 X, Y, Z의 전자 개수로 해당하는 원소를 찾아보면, X는 전자 6개로 탄소(C), Y는 전자 7개로 질소(N), Z는 전자 8개로 산소(O)입니다.
X는 1s에 전자가 채워지지 않았으므로, 쌓음 원리를 위배한 들뜬상태이며, Z는 홀전자를 최대로 갖는 구조가 아니므로, 훈트의 규칙을 위배한 들뜬상태입니다. 주어진 그림에서는 Y만 바닥상태 전자 배치에 해당합니다.
<보기>를 살펴보면,
ㄱ. X는 탄소로 14족 원소입니다. (거짓)
ㄴ. Y는 질소로 홀전자가 최대가 되는 전자 배치를 가지며, 이에 훈트의 규칙을 만족합니다. (참)
ㄷ. X의 바닥상태 전자 배치는 1s22s22px12py1로, 2개의 홀전자를 가지며, Z의 바닥상태 전자 배치는 1s22s22px22py12pz1로 역시 2개의 홀전자를 갖습니다. 따라서 바닥상태에서의 X와 Z의 홀전자의 수는 같습니다. (채워지는 2p의 전자의 경우 x, y, z 순으로 임의로 배치하였습니다.) (거짓)

9번 정답 : ④ ㄱ, ㄷ
9번 풀이 :
반응물인 과산화수소(H2O2)의 수소(H)는 +1, 산소(O)는 -1의 산화수를 갖습니다. 반면, 생성물인 물(H2O)의 경우 수소(H)는 +1로 산화수 변화가 없지만, 산소(O)는 -2의 산화수를 갖습니다. 따라서 산소 원자 1 개당 산화수 1의 감소가 발생합니다. 즉, 과산화수소는 물로 환원(산화제)됩니다.
계수를 살펴보면, 좌변과 우변의 산소 개수가 보존되기 위해서는 2b = d의 관계식을 만족해야 합니다. b = 1, d = 2 일 때 전체 산소의 수는 2 개이므로, 반응에서의 전체 산화수 감소는 -2입니다.
이 경우 Fe2+는 전체 +2의 산화수 변화를 가져야 하므로, 계수인 a = 2 라는 것을 알 수 있습니다. 끝으로 좌변과 우변의 전하, 질량의 균형을 맞춰주면, 계수 c = 2 임을 알 수 있습니다. (반응 전과 후의 수소 개수, 전체 전하가 유지되어야 합니다.)
<보기>를 살펴보면,
ㄱ. H의 산화수는 변하지 않습니다. (참)
ㄴ. H2O2는 산화제입니다. (거짓)
ㄷ. (b + c) / (a + d) = 3 / 4 입니다. (참)

10번 정답 : ③ ㄱ, ㄷ
10번 풀이 :
주어진 그림의 오비탈은 (가) 3s , (나) 2py , (다) 2pz 입니다. 오비탈의 모양을 통해 s 오비탈과 p 오비탈을 구분한 뒤, (가)의 에너지 준위가 가장 높다는 제시 조건을 통해 (가)가 3s임을 결정할 수 있습니다. '다전자 원자'의 오비탈 에너지는 주양자수(n)과 부양자수(l)의 합에 의해 결정됩니다.
(나)와 (다)는 오비탈의 배향을 바탕으로 py와 pz로 구분할 수 있습니다. <보기>를 살펴보면,
ㄱ. 주양자수는 3s > 2py 입니다. (참)
ㄴ. 나트륨은 11번으로 전자 배치는 1s22s22p63s1으로 p오비탈이 모두 채워져 있습니다. 따라서 2py에 채워진 전자수는 2 입니다. (거짓)
ㄷ. (나)와 (다)는 모두 2p 오비탈로 에너지는 같고, 배향만 다릅니다. 이런 상태를 오비탈의 축퇴 상태(degenerate state)라고 합니다. p 오비탈은 3중 축퇴 상태(-1, 0, +1)입니다. (참)

12번 정답 : ⑤ ㄱ, ㄴ, ㄷ
12번 풀이 :
용액의 pH는 용액 내 존재하는 H3O+ 농도에 대해 알려줍니다. pH는 -log [H3O+] 이기 때문입니다. 또한 물의 자동 이온화 상수(Kw)와 [H3O+] 사이의 관계를 이용하면, [OH-]에 대해서도 알 수 있습니다.
(가) 용액의 [H3O+] = 10-3 M 이며, (나) 용액의 [H3O+] = 10-5 M, (다) 용액의 [H3O+] = 10-10 M 입니다. 해당 몰농도 [mol/L]에 전체 부피 [mL]를 곱해주면, 용액 내 존재하는 화학종의 몰수 [mmol]을 알 수 있습니다.
<보기>를 살펴보면,
ㄱ. 용액 내 [H3O+]가 [OH-] 에 비해 많은 경우 용액의 액성이 산성입니다. 물의 이온화 상수 Kw가 10-14, 즉, pKw가 14이므로, pH = 7 을 기준으로 산성과 염기성이 구분됩니다. (가), (나) 용액은 산성, (다) 용액은 염기성입니다. (참)
ㄴ. (다) 용액의 [OH-]는 다음과 같습니다. (참)
Kw = 1 * 10-14 = [H3O+][OH-] = 10-10 [OH-] [OH-] = 10-14 / 10-10 = 10-4 M
ㄷ. (가) 용액에 포함된 H3O+의 양은 50 * 10-3 [mmol], (나) 용액에 포함된 H3O+의 양은 100 * 10-5 = 1 * 10-3 [mmol] 입니다. 따라서 (가) 용액이 (나) 용액에 비해 50 배 많은 H3O+를 포함합니다. (참)

14번 정답 : ④ ㄱ, ㄷ
14번 풀이 :
주어진 결합 모형을 통해 W2+와 X2-는 등전자 이온이며, 각각 W = Mg, X = O 임을 알 수 있습니다. 그리고, YXZ2의 경우 모든 원소가 2주기 원소로 옥텟 규칙을 만족하고 있습니다. 결합 모형의 원자가 전자를 통해 X = O 이므로, 중심 원소 Y = C, Z = F 임을 알 수 있습니다. 중심 원소가 Y 입니다.
<보기>를 살펴보면,
ㄱ. 원자가 전자 수는 산소(X)는 6개, 탄소(Y)는 4개입니다. 따라서 X > Y 입니다. (참)
ㄴ. 마그네슘(W)은 3주기 원소, 탄소(Y)는 2주기 원소입니다. 따라서 주기가 같지 않습니다. (거짓)
ㄷ. VSEPR을 통해 COF2(YXZ2) 분자의 기하구조를 살펴보면, COF2 중심 원자 탄소의 입체수는 3입니다. (VSEPR에서는 다중 결합은 고려하지 않습니다.) 공유 전자쌍의 수 3 개, 비공유 전자쌍의 수 0 개로, AX3E0 type입니다. 따라서 평면 삼각형 구조를 가지며, 모든 원자는 동일 평면에 존재합니다. (참)


16번 정답 : ⑤ ㄱ, ㄴ, ㄷ
16번 풀이 :
혼합 과정에서의 농도를 파악하기 위해서는 '포함된 용질의 양(질량 또는 몰)'을 쫓아야 합니다. 주어진 농도가 퍼센트(%) 농도인지 몰농도인지에 따라 얻는 정보는 달라지겠지만, 결국은 용질의 양은 변하지 않습니다. <보기>의 문장을 하나씩 해결하면, 자연스럽게 문제가 풀릴 듯합니다.
ㄱ. (가) 용액의 농도는 3% 이므로, 100 [g] 의 용액 중에 3 [g]의 용질 A가 포함되어 있다는 뜻입니다. 즉, 50 [g] 용액에는 1.5 [g]의 A가 포함되어 있습니다. A의 화학식량이 60 [g/mol] 이므로, A의 몰수는 1.5 [g] / 60 [g/mol] = 0.025 [mol] 입니다. (참)
ㄴ. (나) 용액의 농도는 0.75 [mol/L] 이며, 용액의 부피는 100 [mL] 입니다. 따라서 이 용액에 포함된 A의 몰수는 0.75 [mol/L] * 100 [mL] = 75 [mmol] 입니다. A의 화학식량이 60 [g/mol] 이므로, A의 질량은 75 [mmol] * 60 [g/mol] = 4500 [mg] = 4.5 [g] 입니다. (참)
ㄷ. (가)와 (나) 용액을 섞으면, 결국 1.5 + 4.5 = 6 [g] 의 A가 부피 플라스크에 첨가되었습니다. 몰수로는 0.1 [mol] 입니다. 전체 용액의 부피가 200 [mL] 이므로, 몰농도는 0.1 [mol] / 0.2 [L] = 0.5 [mol/L]입니다. (참)

17번 정답 : ④ ㄴ, ㄷ
17번 풀이 :
난이도와 별개로 '개인적으로' 빨리 사라졌으면 하는 유형의 문제입니다. p오비탈의 전자 수와 s오비탈의 전자 수 비율(이하 p/s 비율로 표현)은 화학에서 아무 쓸모가 없습니다. 모의고사 외에는 화학에서 만날 일 없는 내용입니다. 이에 '개인적으로' 이런 유형의 문제를 화학 문제라 생각하지 않습니다. (출제 위원들도 현실적으로 어쩔 수 없다는 것을 잘 압니다. 그냥 변별을 위한, 문제를 위한 문제가 싫은 개인의 푸념입니다.)
현실의 고3들을 생각하며 다시 본연의 목적으로 돌아와 문제를 풀어보면,
일단, B에 주어진 n + l = 3을 만족하는 전자 수가 6 개로 주어져 있는데, 이는 2p(=2+1) 오비탈과 3s(=3+0) 오비탈에 채워진 전체 전자 수가 6 개라는 뜻입니다.
그런데, 2p 오비탈에 전자가 부분적으로 채워지고, 3s 오비탈에 전자가 채워지는 바닥상태는 존재할 수 없습니다. 따라서 원소 B는 2p에만 전자가 6개 채워져 있고, B는 2주기 비활성 기체인 네온(10Ne)이라는 것을 알 수 있습니다. 네온의 p오비탈 전자 수는 2p6 = 6개, s오비탈 전자수는 1s22s2 = 4개이므로, (ㄱ) p/s 비율은 3/2 입니다. (보기 ㄴ, 참)
원소 A의 p/s 비율은 3/2 입니다. 2주기 3주기 원소가 가질 수 있는 분모항 값은 4 또는 6입니다. 분모가 4인 경우, p오비탈에 6개의 전자가 채워진 네온(10Ne) 일 것이며, 분모가 6인 경우, p 오비탈에 전자가 9개 채워진 인(15P)일 것입니다. 원소 B가 네온이므로, 원소 A는 인(P) 임을 알 수 있습니다. 인의 n + l =3을 만족하는 전자수(ㄴ)는 2p6, 3s2로 총 8개입니다.
원소 C의 p/s 비율은 5/3입니다. 분모항 3의 배수를 만족하는 원소는 3 주기(=분모항 6) 외에는 없습니다. 즉, 채워진 p오비탈 전자 수가 10이라는 것을 뜻하며, 바닥상태에서 2p63p4 전자 배치를 가져야 합니다. 즉, 16족 원소인 황(16S)임을 알 수 있습니다. 황의 n + l = 3을 만족하는 전자 수(ㄷ)는 앞선 인과 마찬가지로 sp6, 3s2로 총 8개입니다. 따라서 A와 C의 n + l = 3 전자 수는 동일합니다. (보기 ㄷ, 참)
결과적으로 A는 인(P), B는 네온(Ne), C는 황(S)으로, 3주기 원소는 A, C 총 2가지입니다. (보기 ㄱ, 거짓)

18번 정답 : ⑤ ㄱ, ㄴ, ㄷ
18번 풀이 :
산과 염기의 반응, 중화 반응에 관한 문제입니다. 용액의 액성과 반응 후 용액 내 존재하는 양이온의 몰농도를 통해 과량 첨가된 용액의 몰농도를 알 수 있습니다.
문제를 풀기 전에 산과 염기가 반응하여 생성된 용액의 액성에 따라 존재하는 이온들이 어떤 의미를 갖는지 알고 있으면, 풀이가 용이합니다.
[참고] 중화반응 후 혼합 용액 액성에 따른 이온의 몰수 관계
* 혼합 용액의 액성에 따른 이온 관계
HA + BOH → H2O + B+ + A-
1) 반응에 참여하지 않는 이온들은 '초기' 산 또는 염기 용액의 몰수를 알려준다.
- 염기의 B+, 산의 A- 몰수 = 첨가한 염기(BOH) 또는 산(HA)의 '초기 몰수'와 같다.
2) 따라서 반응 후의 혼합 용액이 산성이면, A-(산) > B+(염기) 이고, 염기성이면 A-(산) < B+(염기) 이다.
- 이는 달리 생각하면, 초기 몰수가 많은 화학종이 혼합 후 용액의 액성을 결정한다는 뜻이기도 하다.
3) 중성이면, A-(산) = B+(염기) 이다.
4) 반응 후 '산성' 용액이라면? 'H+가 남았다'
a) 반응한 H+ + 남은 H+ = 초기 HA = 초기 A-
b) 반응한 H+ = 반응한 OH- = 초기 BOH = 남은 B+
5) 반응 후 '염기' 용액이라면? 'OH-가 남았다'
a) 반응한 OH- + 남은 OH- = 초기 BOH = 초기 B+
b) 반응한 OH- = 반응한 H+= 초기 HA = 남은 A-
용액의 액성을 바탕으로 용액 (가), (나), (다)의 상태를 정리해봅시다. (아랫 첨자 전=반응전, 후=반응후)
1) 용액 (가)는 중성으로 초기 산의 몰수와 염기의 몰수가 같습니다. 초기 농도*부피 값이 서로 같다는 뜻입니다. 또한 혼합 후 중성이라는 것은 [H+] = 0 이며, [Na+]=3 입니다. 따라서 초기 NaOH 용액 농도의 묽힘 효과만 고려하면 됩니다. NaOH의 초기 농도는 7.5 M 입니다.

2) 초기 농도 관계 30*[HCl] = 20*[NaOH] 에 따라 HCl의 초기 농도는 5 M 이 됩니다.
3) 용액 (나)는 산성이므로, 첨가한 산이 남습니다. 따라서 [Na+] + [H+]는 혼합 용액의 [Br-] 와 같습니다. 역시 (가) 용액과 마찬가지로 HBr 용액의 묽힘 효과만 고려하면 됩니다. HBr의 초기 농도는 10 M 입니다.

3) 용액 (다)는 염기성이므로 첨가한 염기가 남습니다. 따라서 [Na+] + [H+]는 혼합 용액의 [Na+] 와 같습니다. NaOH 용액의 묽힘 효과만 고려하면 됩니다.

4) 결국 x = 40 mL 임을 알 수 있습니다.
<보기>를 살펴보면,
ㄱ. [HBr] : [NaOH] = 4 : 3 입니다. (참)
ㄴ. x = 40 mL 입니다. (참)
ㄷ. 생성된 물의 양은 반응한 수소 이온 또는 수산화 이온을 통해 알 수 있습니다. (가)에서는 7.5*20 = 150 [mmol]의 산과 염기가 반응하며, 마찬가지로 (다)에서도 5*10 + 10*10 = 150 [mmol] 이 반응하므로, 두 반응에서 생성된 물의 양은 같습니다. (참)

19번 정답 : ② ㄴ
19번 풀이 :
표에 주어진 비공유 전자쌍/공유 전자쌍 비율이 5, 6, 10으로 주어졌습니다. 일단, 주어진 값들이 너무 큽니다. 상댓값이라고 주어졌으므로, 아마도 일정수가 곱해진 값이라 생각하는 것이 좋습니다. 왜냐하면, 비공유 전자쌍/공유 전자쌍 수를 극대화시킬 수 있는 CF4와 같은 물질을 예로들어도, 12/4 = 3 정도를 갖습니다. 주어진 값에 너무 얽매이지 않고, 가능한 분자를 먼저 찾는 것이 중요합니다.
(가)를 통해 접근해보면, 세 가지 서로 다른 원소 하나씩만을 사용하여 만들 수 있는 분자는 F-C≡N, O=N-F 정도 밖에는 될만한 것이 없습니다. 그 외의 경우는 대부분 옥텟규칙을 만족하지 못합니다.
만약, (가)의 화합물이 F-C≡N의 경우 4/4 = 1의 값을 가지며, O=N-F의 경우 6/3 = 2의 값을 갖습니다. 자연스럽게 (나)와 (다)는 F-C≡C-F (6/5 = 1.2), F-N=N-F (8/4 = 2) 조합과 F-N=N-F (8/4 =2), F-O-O-F (10/3) 조합으로 나뉘어 집니다.
따라서 1: 1.2 : 2 = 5 : 6 : 10 의 비율을 만족하는 (가)는 F-C≡N이며, X = F, Y = C, Z = N 임을 알 수 있습니다. 주어진 <보기>를 살펴보면,
ㄱ. (가)의 분자 모양은 직선형입니다. (거짓)
ㄴ. 무극성 공유 결합이 있는 것은 F-C≡C-F, F-N=N-F 두 가지입니다. (참)
ㄷ. (가), (나), (다) 세 분자 모두 다중 결합을 포함하고 있습니다. (거짓)

20번 정답 : ③
20번 풀이 :
1) 양적 관계에 대한 문제입니다. 결국은 질량, 부피, 몰수를 변환하여 필요한 정보를 얻어낼 수 있는가가 핵심입니다. 일정 온도와 압력이므로, 실린더의 부피(V)는 기체의 몰수(n)에 의존합니다.
2) 또한 상대적인 밀도(d=w/V)와 반응전 질량(w)이 주어졌습니다. 즉, 밀도(d)와 주어진 질량(w)을 이용하면, 부피(V) 정보를 알 수 있습니다. 1)에서 말했듯이 부피(V)는 곧 입자수(n) 정보를 줍니다.
3) 실험 I, 반응 전 질량은 4 + 3 = 7 [g] 이고, 밀도가 4k입니다. 실험 III, 반응전 총 질량은 12 + 2 = 14 [g] 이며, 밀도가 5k입니다. 실험 I의 전체 몰수(n_I)가 7 / 4k 일 때, 실험 III의 전체 몰수(nIII)는 14 / 5k 입니다. 즉, 간단한 자연수 형태로 만들면 nI : nIII = 5 : 8 입니다.

4) 즉, 실험 I의 반응전 기체 몰수가 5k' 라면, 실험 III의 반응전 기체 몰수는 8k' 입니다. A와 B의 분자량을 각각 MA, MB라고 하면, 각 실험에서의 A와 B의 몰수(n_A, n_B)는 다음과 같이 나타낼 수 있습니다.

5) 즉, 실험 I과 실험 III에 대한 몰수 관계식이 만들어집니다.

6) k'은 단지 비례상수이므로, k'=1이라 가정하면, nA=2 , nB=3 의 결과를 얻을 수 있습니다. 즉, 실험 I의 4 g의 A는 2 [mol], 3 g의 B는 3 [mol]이라 생각할 수 있습니다. 실험 I~III 까지의 몰수 정보를 채워보면, 다음과 같습니다.

7) A와 C의 계수는 a로, 1보다 크거나 같은 자연수이기 때문에 실험 I, II는 A가 한계 반응물, 실험 III은 B가 한계 반응물임을 알 수 있습니다. 실험 I과 II의 반응 후 부피비를 이용하여 a를 결정합니다. 마찬가지로 k''는 비례상수 이므로, 편한 값인 1로 놓고 풀었습니다.
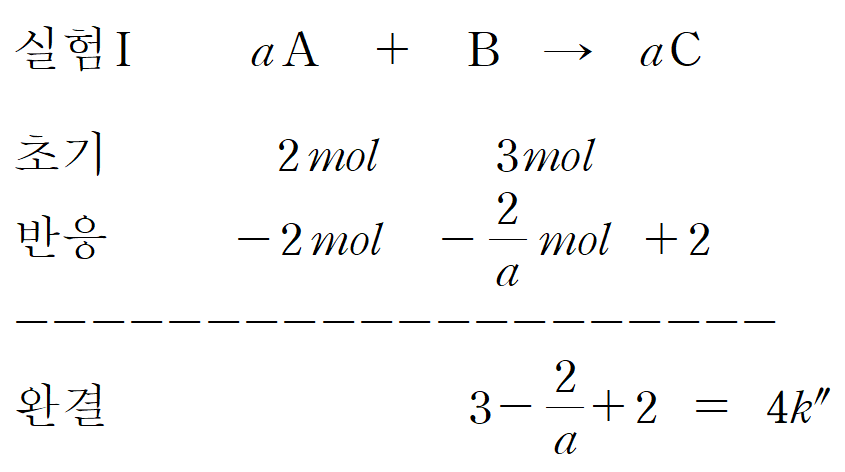
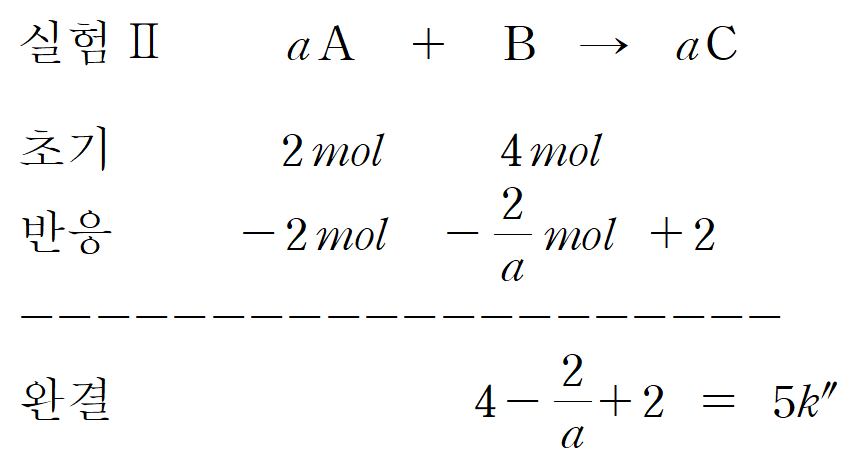
8) 반응후 부피비를 만족하는 a = 2 입니다. 마지막으로, 이를 실험 III에 대입하여 풀면, x = 6 임을 알 수 있습니다. x/a = 3 입니다.

* 본문 설명 중 잘못된 부분에 대해 지적해주시면 참고하여 수정, 업데이트 하도록 하겠습니다. 문제의 출처는 서울특별시교육청과 EBSi 사이트입니다.
'화학 > 기출풀이' 카테고리의 다른 글
| 2018 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 [14번] (0) | 2020.12.21 |
|---|---|
| 2021학년도 PEET 화학추론(일반화학) 기출문제 풀이 (21번~25번) (5) | 2020.11.11 |
| 2021학년도 PEET 화학추론(일반화학) 기출문제 풀이 (16번~20번) (3) | 2020.10.20 |
| 2021학년도 PEET 화학추론(일반화학) 기출문제 풀이 (11번~15번) (0) | 2020.09.20 |
| 2021학년도 수능 9월 모의평가(2020.9.16.) 화학1 풀이 [18번] (0) | 2020.09.18 |



