산-염기 지시약의 작용 원리
1. 지시약(Indicator)
대학생 시절, 알코올 인디케이터로 불리던 친구가 있었다. 이유는 술을 아주 조금이라도 마시면, 얼굴이 심각해 보일 정도로 빨갛게 변했기 때문이다. 얼굴 색변화만으로 주위 사람들에게 알코올 흡수 유무를 즉각적으로 알려주었기에 알콜 검출에 있어서는 아주 좋은 지시약이라고 할 수 있었다.
화학에서 말하는 지시약도 의미적으로는 그 친구 몸에서 일어나는 반응과 별반 다르지 않다. 화학 반응 또는 물질의 상태를 알려주는 물질을 지시약이라고 지칭하기 때문이다. 지시약을 이용하면 물질의 상태 또는 변화를 판단할 수 있다.
지시약도 종류가 다양하다. 산-염기 지시약(pH indicator), 산화-환원 지시약(redox indicator), 흡착 지시약(adsorption indicator), 착물 지시약(complexometric indicator) 등이 있으며, 화학 반응 또는 물질의 상태를 알려주는 방식도 다양하지만, 일반적으로는 색이 달라진다.
우리에게 익숙한 것은 브로모티몰 블루(BTB), 페놀프탈레인(phph), 양배추 지시약과 같은 산-염기 지시약이다. 이번 글을 통해서는 산-염기 지시약이 작동하는 원리에 대해 알아보자.

2. 산-염기 지시약의 변색 원리
산-염기 지시약은 용액의 pH 상태를 색깔로 알려준다. 단순히 용액의 액성이 산성인지, 염기성인지 알아보기 위해 쓰이기도 하지만, 산-염기 중화 적정 실험에서는 중화점을 찾기 위해 사용된다.
산-염기 지시약은 주로 약한 유기산(또는 약한 유기염기)들인데, 한 가지 공통된 특징을 갖는다. 약한 산-염기인 동시에 짝산(HIn) 구조와 짝염기(In-) 구조의 겉보기 색깔이 다르다는 것이다.
예를 들어, 너무나도 친근한 지시약인 브로모티몰 블루(BTB)의 짝산 구조 HIn는 노랑색, 짝염기 구조 In-는 파랑색을 나타낸다.

지시약의 색 변화는 지시약이 포함된 용액의 pH에 의존하여, 지시약의 짝산-짝염기 구조 비율이 달라지면서 나타난다.
지시약은 그 자체로 약한 산 또는 약한 염기이므로, 어떤 액성의 용액 환경에 넣어지든, 주어진 온도에 해당하는 산-염기 이온화 상수(Ka, Kb) 값을 언제나 유지해야 한다. 지시약은 언제나 용액 내 존재하는 (비교적) 과량의 H3O+, OH-에 영향을 주지 못할만큼의 소량만 첨가되기 때문에, 용액 액성에 의존하여 지시약의 평형이 이동한다.
그리고 평형 이동의 결과에 따라 지시약의 짝산 또는 짝염기가 많아지기도 하고, 자연스레 비율이 변하며, 그 결과로 용액 색깔이 결정된다.
H3O+ 이온이 풍부한 산성 용액에서는 지시약의 평형이 역반응(←)으로 이동(HIn이 많아지는 방향)
H3O+ 이온이 부족한 염기 용액에서는 지시약의 평형이 정반응(→)으로 이동(In-이 많아지는 방향)
3. 용액 액성에 따른 지시약의 짝산-짝염기 비율 변화
브로모티몰 블루(Bromotymol Blue, BTB) 지시약을 이용하여, 용액 액성에 따른 지시약 짝산-짝염기 구조 비율 변화를 살펴보자. BTB의 평형 반응식과 산 이온화 상수는 다음과 같다.

pH가 각각 5(산성), 7(중성), 9(염기성)로 다른 세 가지 용액에 소량의 BTB 지시약을 넣자. 그리고 BTB의 짝산-짝염기 구조 비율과 용액의 색 변화 사이 관계를 알아보자. 헨더슨-하셀바흐 식을 이용하면, 지시약의 색변화, 용액의 pH, 지시약의 Ka 사이 관계를 알아보기에 편하다.
가. pH = 7 (중성)
pH = 7, 중성 용액은 수소 이온의 농도가 [H3O+] = 10-7이다. 물의 자동 이온화를 통해 생성된 수소 이온 외에는 별다른 것이 존재하지 않는다. 헨더슨-하셀바흐 식의 좌변인 pH = 7인 상태이다. 해당 온도 조건에서 이 용액에 첨가된 BTB의 산 이온화 평형은 Ka = 10-7를 만족해야 한다.

이므로, log 안의 짝염기/짝산의 비율 값은 [In-]/[HIn] = 1이 된다.
이는 [In] = [HIn]이라는 뜻이며, 용액은 파랑색의 In-과 노랑색의 HIn 비율이 1 : 1로 혼합된 색인 초록색이 된다.
나. pH = 5 (산성)
pH = 5, 산성 용액에서의 수소 이온 농도 [H3O+] = 10-5으로, 헨더슨-하셀바흐 식으로 나타내면 다음과 같다.

이므로, log 안의 짝염기/짝산 비율 [In-]/[HIn] = 10-2 = 1/100이 된다.
이는 파랑색의 In-과 노랑색의 HIn 비율이 1 : 100 이라는 뜻이며, 전체 용액은 짝산 HIn 색인 노란색이 된다.
다. pH = 9 (염기성)
pH = 9, 염기성 용액에서의 수소 이온 농도 [H3O+] = 10-9으로, 헨더슨-하셀바흐 식으로 나타내면 다음과 같다.

이므로, log 안의 짝염기/짝산 비율 [In-]/[HIn] = 102 = 100이 된다.
이는 파랑색의 In-과 노랑색의 HIn 비율이 100 : 1 이라는 뜻이며, 따라서 전체 용액은 짝산 In- 색인 파란색이 된다.
-
결국, 용액의 pH에 의존하여 지시약 분자의 짝산/짝염기의 비율이 달라지며, 이 비율 변화가 용액의 색 변화를 일으키는 원인이 된다.

4. 변색 범위와 중화 적정 지시약의 선택
용액의 색깔은 산-염기 지시약의 비율에 따라 결정된다. 특정 형태의 구조가 나머지 구조에 비해 과량 존재하면, 용액의 색깔을 결정한다. 일반적으로 짝산 혹은 짝염기 중 하나의 형태가 다른 것에 비해 10배 이상(과량)이 되는 경우 특정 색으로 관찰된다고 말한다.
앞서 확인한 것과 같이 pKa = 7인 BTB 지시약이 pH = 5인 용액에 들어갔을 때, 노란색의 HIn 구조가 파란색의 In- 구조에 비해 100 배 많이 존재하므로, 우리는 용액 전체가 노랗다고 분명하게 느낄 수 있다. 반대로 pH = 9인 용액에 BTB 지시약을 넣었다면, 파란색 In-가 노란색 HIn에 비해 100배 많으므로, 용액이 파랗게 보이는 것이 자연스럽다.
그러나 pH가 6.0 ~ 8.0 사이에서는 BTB의 한가지 구조가 나머지 구조보다 지배적으로 존재한다고 말하기 어렵다. 해당 범위의 극단인 6.0과 8.0이라 해도, 두 화학종의 존재비는 10배 안쪽이기 때문이다. 즉, pH 변화에 따라 명확하게 어떤 색이라고 확정하기 어려운 연속적인 색깔 변화가 나타나는 구간이 존재하게 된다. 이런 구간을 지시약의 변색 범위 (indicator range)라 한다. 우리에게 친숙한 BTB(Bromothymol Blue)의 지시약 변색 범위는 6.0 ~ 7.6 정도이다.
많이 노르스름한 녹색, 노란빛을 띠는 녹색, 탁한 녹색, 녹색 느낌의 푸르스름한 색, 푸른 느낌의 녹색 처럼...
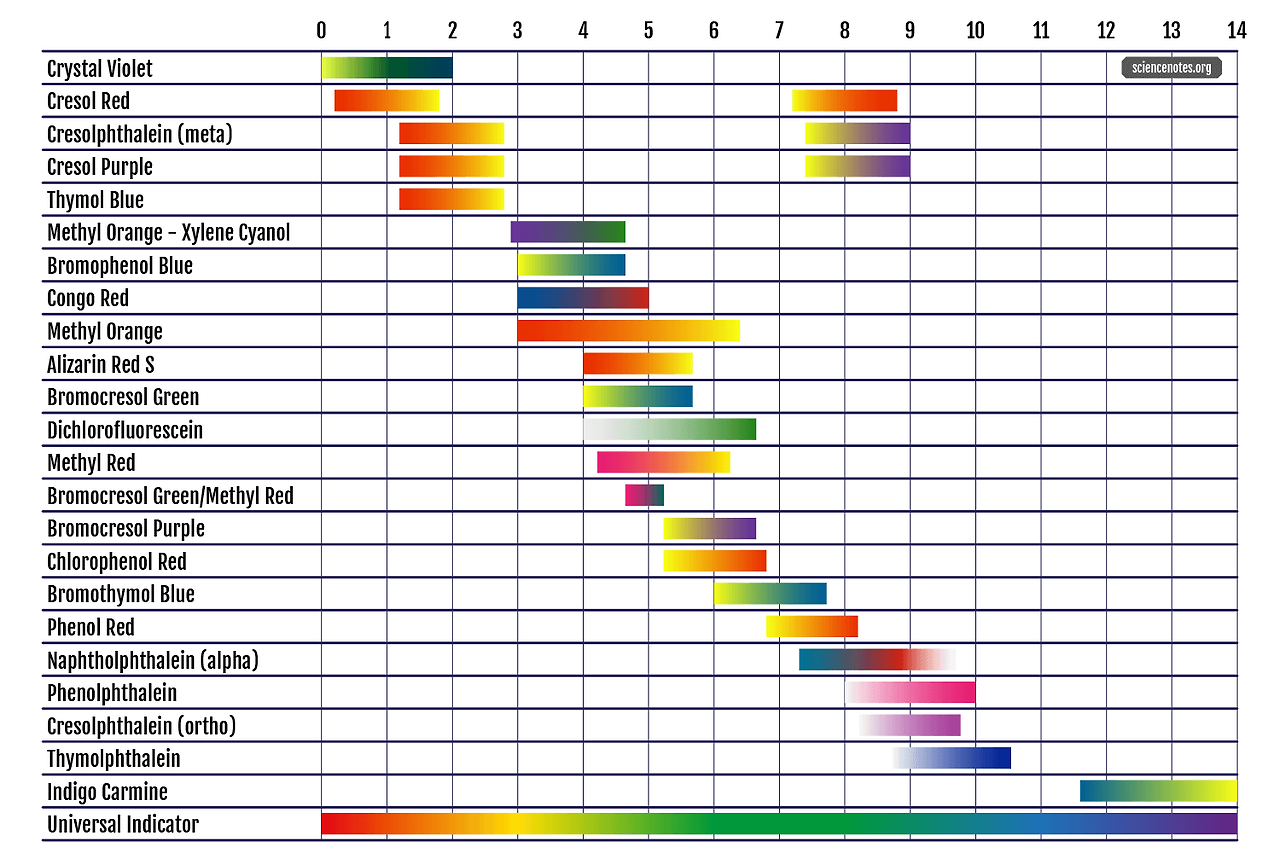
지시약의 변색 범위는 산-염기 중화 적정에 사용될 지시약을 선택할 때, 활용된다. 산-염기 중화 적정의 pH Jump 구간에 해당하는 pH 구간에 지시약의 변색 범위가 포함되는 것이 좋다.
예를 들어, 강산-강염기의 중화 적정 과정에서의 pH Jump 구간은 약 3 ~ 11 부근까지 넓게 나타나고, 약산-강염기 적정의 경우 5 ~ 11 부근으로 좁게 나타난다.
이 경우 8.0 ~ 9.6의 변색 범위를 갖는 페놀프탈레인이나 6.0 ~ 7.6의 변색 범위를 갖는 BTB는 중화 적정을 위한 지시약으로 사용하기에 적합하지만, 3.1 ~ 4.4의 변색 범위를 갖는 메틸 레드는 그렇지 않다. 약산-강염기 중화 반응에서 사용하기에는 적합하지 않으며, 이는 메틸 레드가 중화점 도달 이전에 변색 구간을 거치기 때문이다. 메틸 레드는 pH = 4.4 이상의 용액 환경이면 이미 짝염기 구조의 짝산 구조에 비해 10배 이상 많아지며, 용액의 색깔이 짝염기형 구조의 주황색으로 대부분 변해버리기 때문에 이후 나타날 중화점을 색변화로 판단할 수 없다.
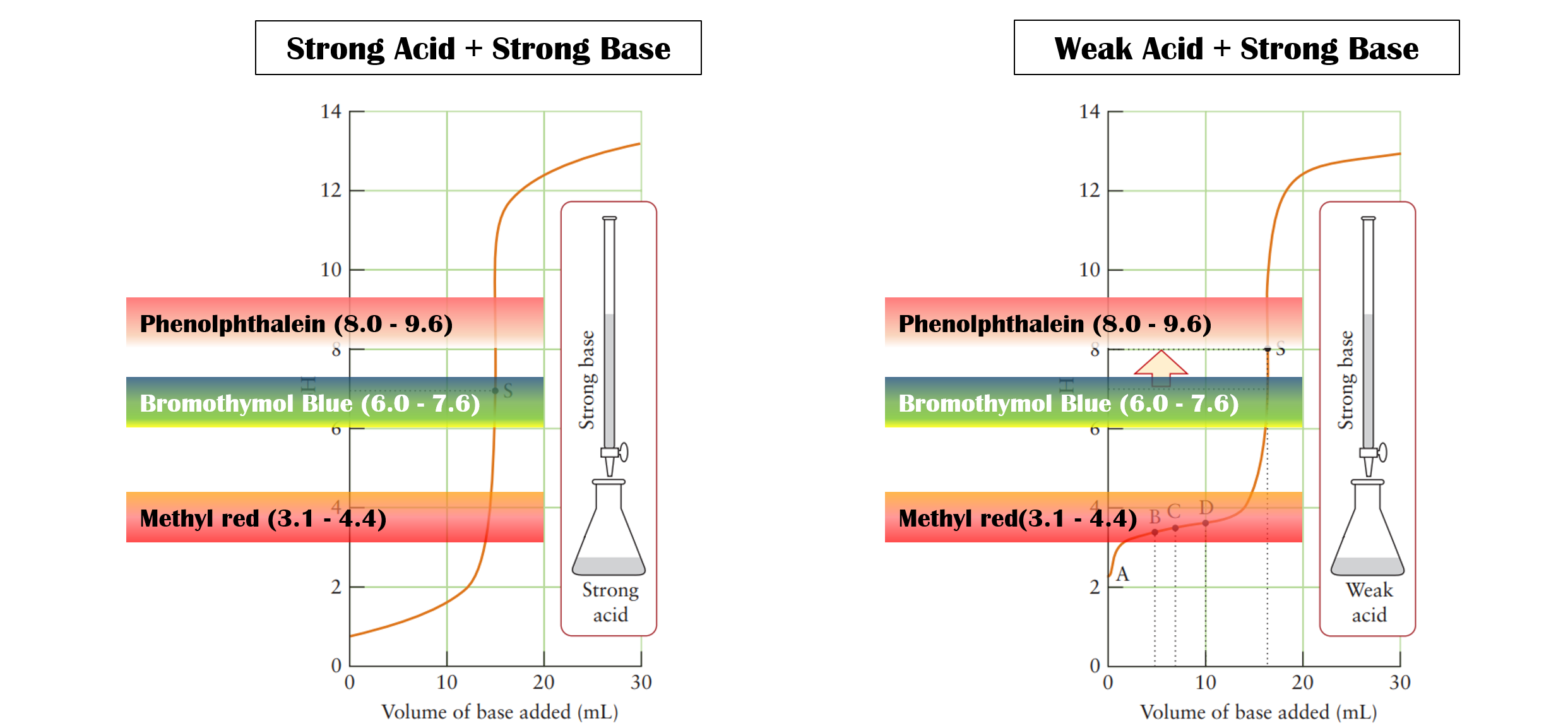
여기서 하나, 생각해볼 것이 강산-강염기, 혹은 약산-강염기 중화 적정에서 지시약의 변색 범위로만 생각했을 때는 BTB가 페놀프탈레인보다 더 나은 선택으로 보이지만, 실제로는 페놀프탈레인이 더 선호되는 경향이 있다. 왜 그럴까?
이는, 중화점 전후의 pH 변화가 매우 급격하게 일어나는데, BTB 지시약은 중화점에서 노랑색 → 파랑색으로 매우 빠르게 색 변화를 나타내므로 그 중간 지점 청록색 부근을 관찰자가 구별하여 잡아내는 것이 거의 불가능하기 때문이다. 오히려 산성 및 중성 pH 환경에서 색이 없다가, 중화점을 지나는 직후에 무색 → 분홍색으로의 색 변화를 관찰하는 것이 훨씬 용이하며, 이런 까닭으로 중화 적정 과정에서 선호된다.
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
[참고] 분광광도계를 활용한 지시약의 pK_a 결정 실험 https://stachemi.tistory.com/318
지시약의 pKa 결정 (feat. 분광광도법)
흡광도 측정을 통한 지시약의 pKa 결정 0. 들어가기 산-염기 지시약(Acid-Base Indicator)은 일반적으로 약한 산 또는 약한 염기의 성질을 갖는다. 그렇다고 해서, 모든 약한 산과 약한 염기를 지시
stachemi.tistory.com
'화학 > 화학이야기' 카테고리의 다른 글
| 이온의 선택적 침전 (Selective Precipitation) (0) | 2024.09.30 |
|---|---|
| 상자 속 입자 (The Particle in a Box, PIB) (5) | 2024.08.03 |
| [교과서 읽기] 생체 내 완충 작용 (4) | 2024.06.09 |
| 용액의 완충 효과를 높이는 방법 (feat. 완충 용량) (13) | 2024.06.08 |
| 완충 용액 (buffer solution) (0) | 2024.05.26 |



