이전글 : 2021 PEET 화학추론(일반화학) 기출문제 풀이 (1번~5번)
2021 PEET 화학추론(일반화학) 기출문제 풀이 (1번~5번)
2021 PEET 화학추론(일반화학) 기출문제 풀이 (1번~5번) 정답 : ② 0.5*(a - b + c ) 풀이 : 서술형 문제에서 헤스의 법칙을 적용하는 경우에는 생각할거리가 생기는 일이 종종 생기지만, 선다형 문제에서
stachemi.tistory.com
2021학년도 PEET 화학추론(일반화학) 기출문제 풀이 (6번~10번)

정답 : ③
풀이 :
온도 T 에서 (가)의 순수 A의 증기압(PA*)은 75 mmHg이다. 반면, (나)의 혼합 증기압(Ptot)은 60 mmHg이다. (나)에서 A의 부분압이 B의 5 배라고 했으므로, PA = 5PB 이다. 즉, PA = 50 mmHg, PB = 10 mmHg 이다.

(나) 용액은 이상용액이므로, 라울의 법칙을 이용하여 용액 내 A의 몰분율(XA)을 구할 수 있다.
PA = XA * PA* , 60 50 mmHg = XA * 75 mmHg , XA = 2/3
자연스럽게 (나) 용액 내 B의 몰분율(XB)은 1/3 이 된다. 따라서 용액 내 존재하는 A와 B의 몰 비는 2 : 1이다.
몰수[mol] = 질량[g] / 몰질량[g/mol] 이므로 식을 변형하면, 질량 [g] = 몰수[mol]*몰질량[g/mol]으로 나타낼 수 있다. A의 몰질량(MA)이 B의 몰질량(MB)의 a 배 이므로, MA = aMB 관계식도 성립한다.
▶ A 질량 : x [g] = 2 [mol] * aMB [g/mol] ▶ B 질량 : y [g] = 1 [mol] * MB [g/mol]
따라서 x/y = 2a 이다.
* [2021-03-06 오타 수정] : (나) 용액에서의 A 증기압 PA = 60 mmHg → 50 mmHg 로 오타 정정


정답 : ⑤
풀이 :
아세트산(CH3COOH, 이하 AcOH), 프로피온산(CH3CH2COOH, MeAcOH), 플루오로아세트산(FCH2COOH, FAcOH)에 대한 문제이다. 모두 1 양성자성 산이며, 구조적으로는 아세틸기(CH3CO-)의 수소가 메틸기(-CH3)와 플루오르기(-F)로 치환된 형태이다.
산의 세기를 비교하면, FAcOH > AcOH > MeAcOH 순으로 나타난다. 판단 근거는 치환기의 유발효과(전자끌어당김 효과)이다. 치환기가 좋은 전자끌개그룹(Electron Withdrawing Group, EWG)으로 작용할수록 산의 세기가 강해진다. 수소와 비교했을 때, 메틸기(-CH3)는 전자주개그룹, 플루오르기(-F)는 전자끌개그룹으로 작용한다.
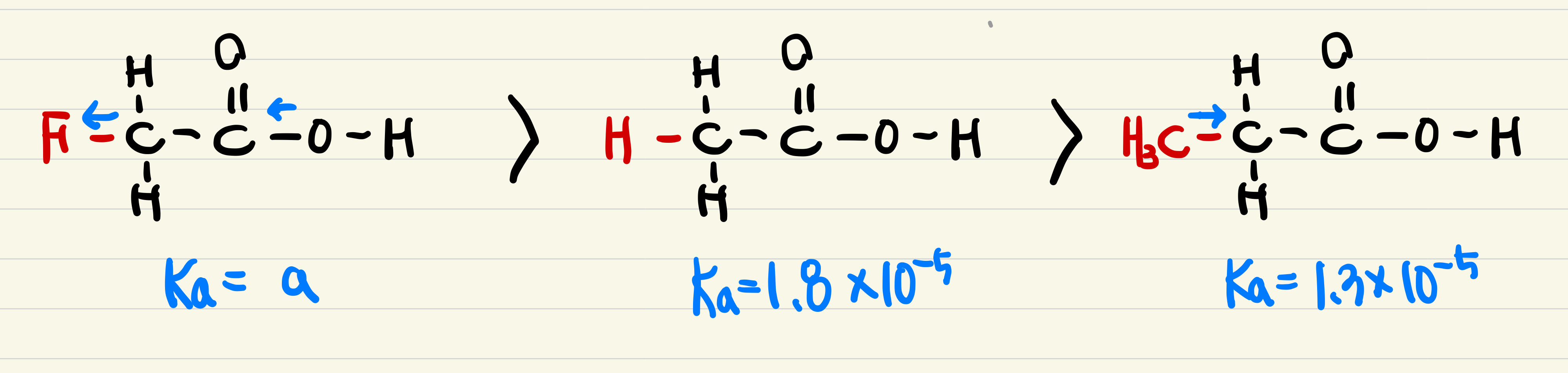
따라서 (1) FAcOH의 Ka 는 AcOH의 Ka = 1.8 * 10-5 보다 클 것이다. (거짓)
바로 이어 (5) 짝염기의 세기를 비교해보면, 산의 세기와 짝염기의 세기는 반비례한다. 따라서 짝염기 화학종의 세기는 MeAcO- > AcO- > FAcO- 순으로 나타나며, 동일한 0.1 M 농도의 짝염기 수용액이 만들어내는 OH- 의 양 역시 짝염기 세기와 동일한 경향성을 갖는다 (참)
수용액 (가) ~ (다)를 살펴보면, 각각의 산 1.0 mol에 NaOH가 각기 다른 양 첨가된 상태이다. 이론적으로 세 용액은 모두 NaOH가 1.0 mol이 첨가된 시점이 중화점이므로, 모두 중화점에 도달하지 못한 상태이다.
중화점에 도달하는 순간(첨가한 NaOH = 1.0 mol)을 반응이 100% 진행된 지점이라 한다면, (가)는 80%, (나)는 50%, (다)는 20% 반응이 진행된 지점이다. 반응이 진행된만큼 초기 산의 짝염기를 생성한다. (가)는 0.8 mol의 AcO- 이온, (나)는 0.5 mol의 MeAcO- 이온, (다)는 0.2 mol의 FAcO- 이온이 용액 내 존재한다. 전체 용액의 부피는 1 L로 동일하므로, (2) 짝염기 화학종의 농도는 (가) [AcO-] > (나) [MeAcO-] > (다) [FAcO-] 순으로 나타난다. (거짓)
(가) ~ (다) 용액의 상태를 중화적정 곡선을 통해 나타내면, 다음과 같다.
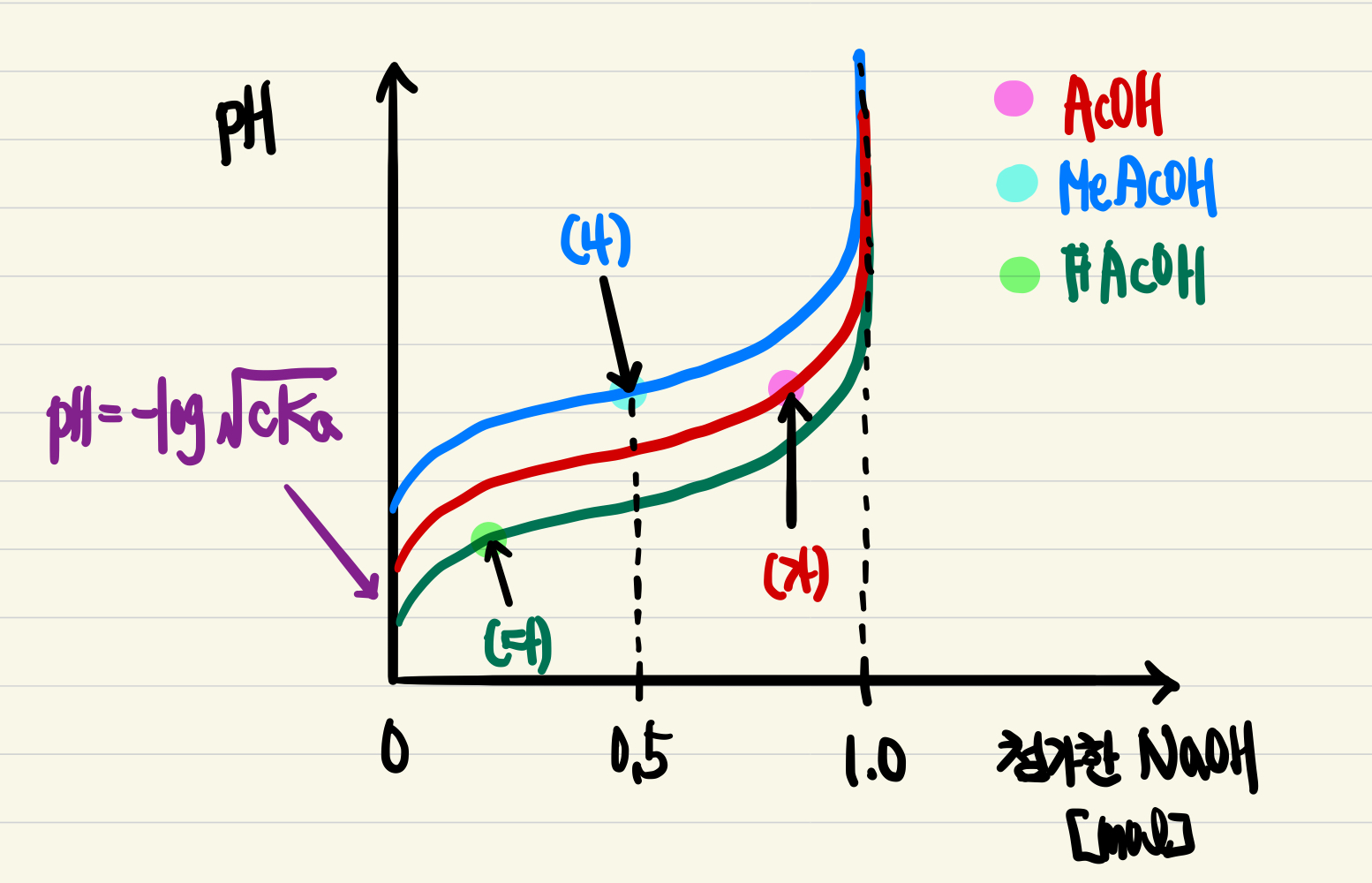
중화적정곡선의 반당량점의 pH는 초기산의 pKa와 같기 때문에, 산의 세기가 약할수록 반당량점에서의 pH가 높다.(NaOH 0.5 mol 첨가시 pH = MeAcOH > AcOH > FAcOH) 초기 pH 또한 -log√(cKa) 이므로, 초기 산의 몰수가 1 mol로 동일한 조건일 때는 Ka 값이 클수록 낮은 pH를 갖는다.
(3) 용액 (가) ~ (다)의 pH를 비교해보자. 위의 적정곡선만으로도 pH는 (가) > (다)임을 알 수 있지만, 풀이를 위해 헨더슨-하셀바흐 식을 통해 대략적인 pH를 구해보자. (거짓)
(가) 용액 pH = pKa,AcOH(4.75) + log(0.8/0.2) = 5.35
(나) 용액 pH = pKa,MeAcOH(4.89) + log(0.5/05) = 4.89
(다) 용액 pH = pKa,FAcOH + log(0.2/0.8) = pKaa,FAcOH - 0.6
(4) 용액의 pH를 1만큼 변화시키기 위해 필요한 염기(또는 산)의 몰수에 해당하는 개념은 완충 용량이다. 필요한 염기(또는 산)의 몰수가 많을수록 그 용액은 큰 완충 용량을 갖는다. 완충 용량은 용액 내 짝산과 짝염기의 비율이 비슷하고, 절대적인 농도가 진할수록 커진다. (가) ~ (다) 용액의 절대적 농도는 모두 동일하므로, 짝산-짝염기의 비율이 용액의 완충용량을 결정한다. 완충 용량이 가장 큰 용액은 짝산-짝염기 존재비가 1인 (나)이다. 적정 곡선이 주어졌다면, 그래프 기울기가 가장 편평한 구간을 찾거나, 비교하면 된다. (거짓)
정답 : ②
풀이 :
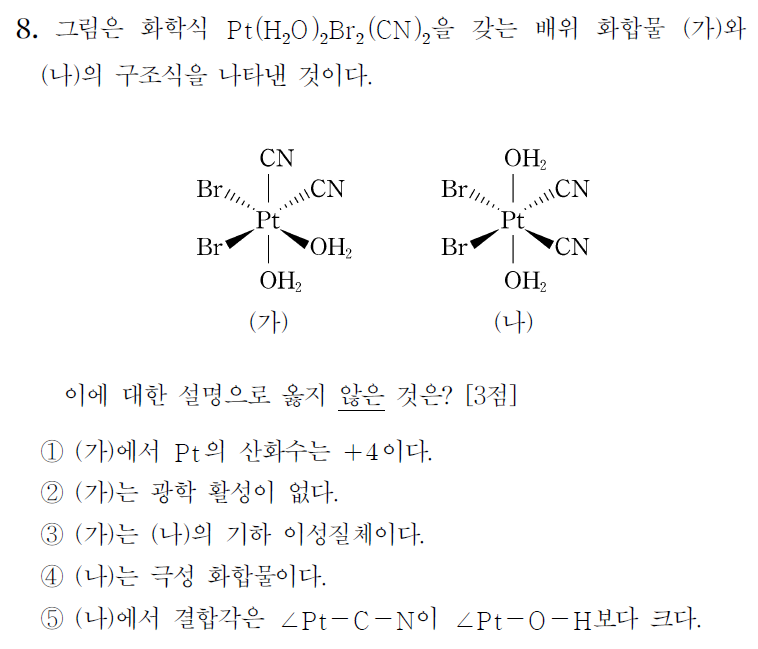
(가)와 (나)는 모두 Ma2b2c2 타입의 배위화합물이며, 리간드의 종류, 화학식 또한 같다. 이성질체 관계이다. H2O 리간드 위치를 기준으로 비교했을 때, (가)는 cis, (나)는 trans 타입으로 분류할 수 있으며, 기하이성질체 관계에 놓여있다고 할 수 있다. (참고로 Ma2b2c2 타입의 전체 이성질체는 6개, 거울상 이성질체는 1쌍 존재한다.)
(1) CN- 과 Br- 는 음이온 리간드, H2O는 중성 리간드이므로, 착화합물이 전기적 중성을 갖기 위해서는 백금의 산화수 +4 이어야 한다. (참)
(2) (가)는 거울상 이성질체(enantiomer)를 가지며, 광학 활성이 있다. 아래의 (거짓)
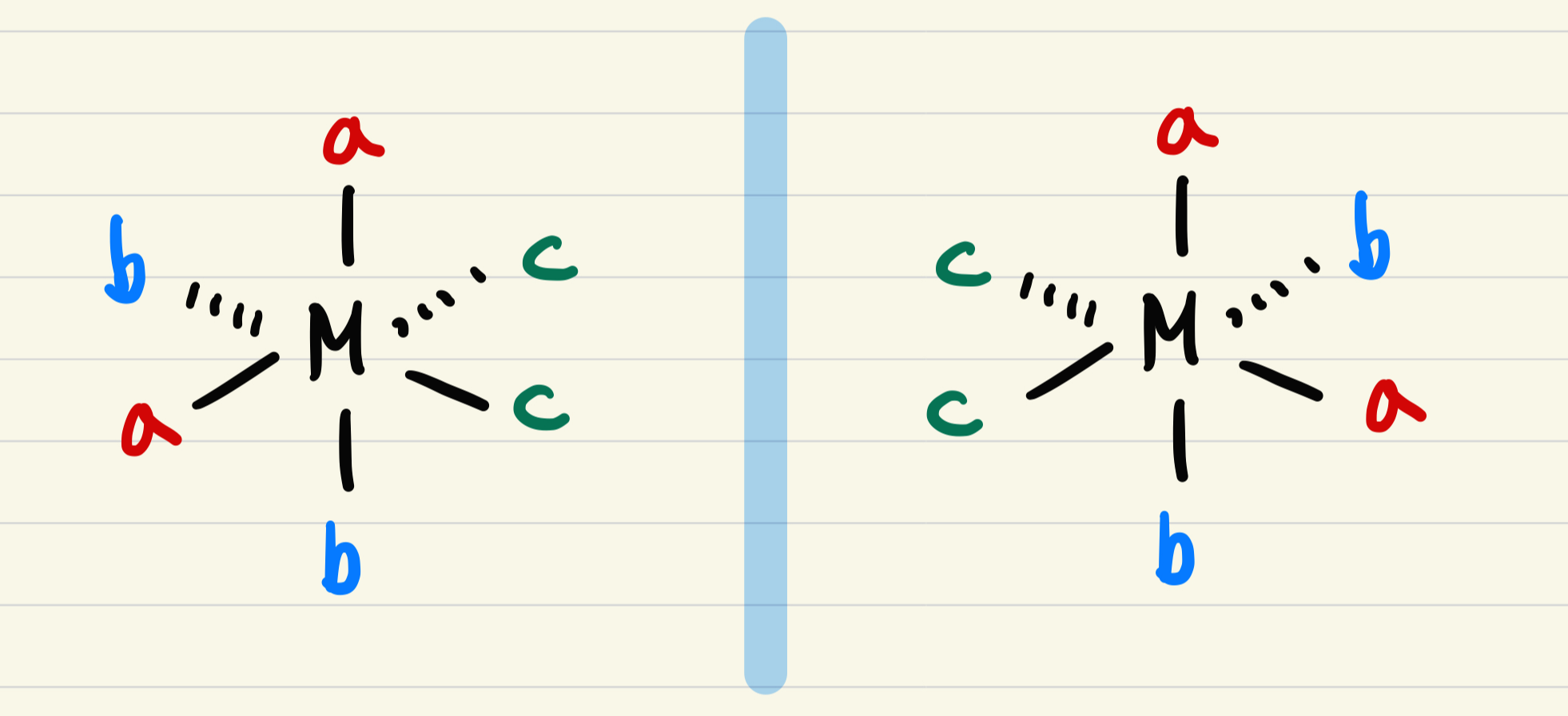
(3) (가)는 (나)의 기하 이성질체이다. (참)
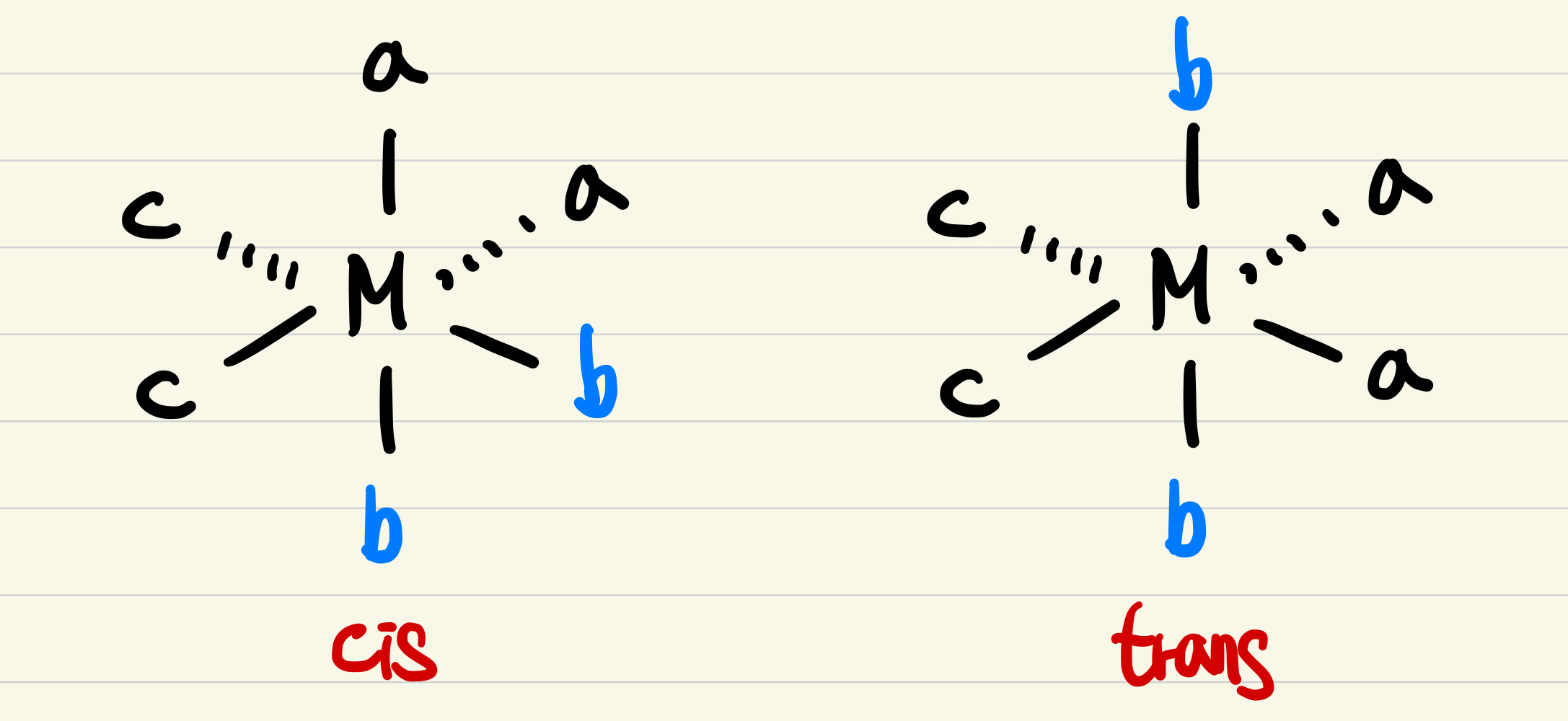
(4) 무극성 분자가 되기 위해서는 알짜쌍극자모멘트가 0이 되어야 한다. (나)의 구조는 대칭구조를 갖지 않으므로, 쌍극자 모멘트가 상쇄되기 어렵다. (참)
(5) (나)에서의 결합각은 금속과 직접적으로 결합하는 원소의 VSEPR과 혼성오비탈을 통해 대략적으로 예상할 수 있다. Pt-C-N의 결합각은 180도이며, Pt-O-H의 결합각은 약 104.5도 ~ 109.5도 사이의 값을 가질 것으로 예상할 수 있다. (참)
정답 : ③
풀이 :
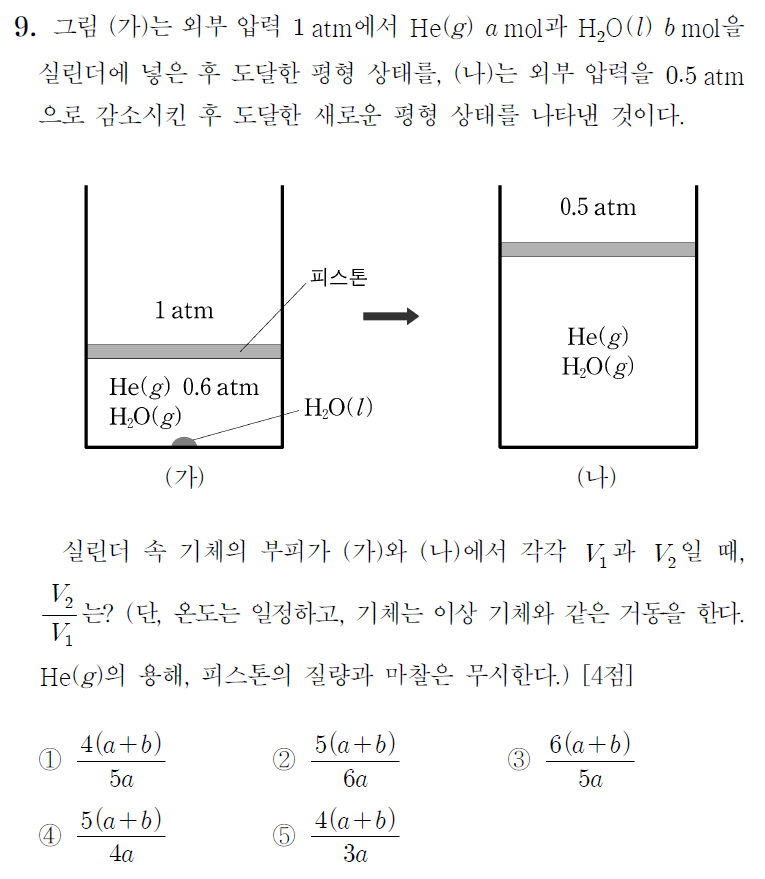
문제 조건을 살펴보자.
실린더에 넣은 물질은 He(헬륨) a mol과 H2O(물) b mol이다. 전체 입자수는 a + b mol이다. 계가 닫혀있는 한 전체 몰수는 변하지 않는다. 실린더 내의 물은 일부 기화하여 수증기를 만들어내고, 생성된 수증기와 헬륨 압력의 합이 1 atm이다. 이 상태가 그림 (가)이다. 헬륨의 부분압이 0.6 atm이므로, (가)의 수증기압은 0.4 atm이다.
일정 온도에서 기체의 압력은 몰수에 비례한다. 헬륨 0.6 atm이 a mol이므로, 0.4 atm의 수증기는 2a /3 mol이다. (가)의 전체 기체 몰수는 5a /3 mol 이다.
그림 (나)는 일정 온도 하에서 외부압이 0.5 atm으로 감소한다. 외부압이 낮아지고, 남아있던 물은 모두 수증기로 기화하였다. 따라서 이 때 기체 전체 몰수는 초기에 넣어준 것과 같이 헬륨 a mol, 수증기 b mol, a + b mol이다. 이 몰수에 해당하는 압력은 0.5 atm이다.
(가)와 (나)의 온도(T ), 기체상수(R )는 같으므로, 상수 취급할 수 있다. 우리는 압력과 기체의 몰수를 부피에 관해 표현할 수 있다.
V1 = n(가)RT / P1 = (5a/3)RT / 1atm V2 = n(나)RT / P2 = (a + b)RT / 0.5 atm
따라서 이를 정리하여 V2 / V1 을 구해보면, 2(a + b) / (5a/3) = 6(a + b) / 5a 임을 알 수 있다.


정답 : ④
풀이 :
20 mmol의 BaCl2와 40 mmol의 K2SO4의 혼합을 통해 침전인 BaSO4을 형성하는 반응이다. Ba2+와 SO42- 는 1:1로 반응하며, 이에 한계 반응물은 Ba2+ 이온이다. 예상되는 이론적 수득량은 20 mmol이다. 실험과정 (가)와 (나)는 혼합 전 수용액 제조 과정이며, (다)는 혼합 과정이다. (라)는 혼합 후 생성된 BaSO4 침전을 거르는 과정이다. (마)는 분리된 고체(침전, BaSO4)을 세척한 뒤 건조하는 과정이다. 주어진 (1) ~ (5)의 제시문을 살펴보자.
(1) 침전을 거르는 데 깔때기는 적합한 기구이다. (참)
(2) (다)에서 생성된 침전의 알짜 이온 반응식은 Ba2+ + SO42- → BaSO4 이다. (참)
(3) (다)에서 포타슘 이온(K+)는 침전 반응에 참여하지 않으며, 구경꾼 이온이다. (참)
(4) 침전물인 BaSO4가 거름종이 위에 걸려졌으므로, 여과액에는 구경꾼 이온만이 들어있다. 구경꾼 이온의 몰수는 초기 몰수와 같다. Cl- 이온은 2*20 = 40 mmol, K+ 이온은 2*40 mmol = 80 mmol이다. 용액의 부피는 동일하므로, 농도비 [Cl-] / [K+] = 1/2 이다. (거짓)
(5) 침전 생성 반응의 퍼센트 수득률은 18 mmol / 20 mmol = 90 % 이다. (참)
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트하도록 하겠습니다. 위 문제의 출처는 http://www.kpeet.or.kr 한국약학교육협의회 사이트입니다.
* 2021 PEET 화학추론(일반화학) 기출문제 풀이 (11~15번) : stachemi.tistory.com/162
2021 PEET 화학추론(일반화학) 기출문제 풀이 (11번~15번)
이전글 : 2021 PEET 화학추론(일반화학) 기출문제 풀이 (1~5번) (링크) 2021 PEET 화학추론(일반화학) 기출문제 풀이 (6~10번) (링크) 정답 : ④ ㄱ, ㄴ 풀이 : 물-에탄올 수용액 A, B, C가 있고, 이를 모두 혼��
stachemi.tistory.com
'화학 > 기출풀이' 카테고리의 다른 글
| 2021학년도 수능 9월 모의평가(2020.9.16.) 화학1 풀이 [18번] (0) | 2020.09.18 |
|---|---|
| 2021학년도 수능 9월 모의평가(2020.9.16.) 화학1 3점 문항 풀이 (0) | 2020.09.17 |
| 2021학년도 PEET 화학추론(일반화학) 기출문제 풀이 (1번~5번) (2) | 2020.09.07 |
| 2021 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 (16번-20번) (6) | 2020.08.23 |
| 2021 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 (11번-15번) (2) | 2020.08.21 |



