2025 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 (1번-10번)
2025 MEET/DEET 자연과학2(일반화학) 기출문제 풀이
1번~10번
0. 들어가기
8월말, 3학년 생기부 쓰기 싫어서, 현실 도피용으로 풀이를 작성하다가 임시저장 해두고 미뤄두었던 것을 마무리 해보려 한다. 생기부 쓰기 싫을 때는 별 게 다 재밌다. 각잡고 풀려고 할 때보다, 더 잘풀린다는 것은 함정이다. 현재, PEET는 역사 속으로 사라졌고, MDEET도 소멸 직전이기에 관심은 적겠지만, 재미를 위해 혹시나 하는 마음에 남겨 둔다.

1번 정답: ①
1번 풀이:
주어진 그래프는 방사 방향 확률 분포 함수이다. 위 그래프를 통해 알 수 있는 것은 방사형 마디의 개수이다. 방사형 마디는 핵으로부터 떨어진 거리에 따라 나타나는 마디이다. n - l - 1 개의 방사형 마디를 갖는다. n + l = 4 이고, n - l - 1 값은 그래프를 통해 알 수 있다. (가)는 n - l - 1 = 1개, (나)는 n - l - 1 = 3개이다. n + l = 4로 같고, 최대로 가질 수 있는 n 값이 4이므로 (가)는 3 + 1 = 3p, (나)는 4 + 0 = 4s이다.
① 전체 마디수는 n - 1 이며, (가)는 3p 이므로, 3 - 1 = 2 이다. (거짓)
② (나)는 s오비탈이며, 확률밀도함수 f(r)는 핵으로부터의 떨어진 거리에만 의존한다. (참)
③ 수소 원자의 에너지 준위 절댓값은 n2에 반비례 한다. E = - k/n2 형태이므로 절댓값은 (가) = k/9, (나) = k/16이다. (가)는 (나)의 16/9 배이다. (참)
④ 전체 마디수 n - 1은 (가)는 3 - 1 = 2, (나)는 4- 1 = 3이므로, (가)가 (나)보다 작다. (참)
⑤ 각운동량 양자수(l)는 (가) = 1, (나) = 0 이므로, (가)가 (나)보다 크다. (참)

2번 정답: ②
2번 풀이:
2주기 원자의 반지름은 원자번호가 커질수록 작아진다. 그래프에서 (나) - (가) - (다) - (마) - (라) - (바) 순으로 원자 반지름이 작아지므로, Be - B - C - N - O - F 이다. 순서대로 선으로 연결해보면, (나)-(가) 사이(Be - B), (마)-(라) 사이(N - O)에서 제1 이온화 에너지 역전이 일어나는 것도 손쉽게 확인할 수 있다.
① (가)는 붕소(B)로 13족 원소이다. (거짓)
② 2차 이온화 에너지는 (가) 붕소(B)가 (다) 탄소(C)보다 크다. 2차 이온화 에너지는 1가 양이온의 이온화 에너지이다. B+와 C+의 이온화 에너지를 비교하는 것인데, 이는 전자 배치상으로 B+ = 베릴륨(Be), C+ = 붕소(B)와 비슷하기 때문에 Be와 B의 1차 이온화 에너지의 예외적 경향을 따른다. (참)
③ 바닥 상태에서 홀전자 개수는 (나) 베릴륨(Be) = 0, (다) 탄소(C) = 2개 이므로, (나) < (다) 이다. (거짓)
④ 원자가 전자의 유효 핵전하는 같은 주기에서 원자 번호가 커질수록 커진다. 핵전하가 1만큼 증가하는 것에 비해 가리움 효과는 그에 못미치기 때문이다. 따라서 (라)의 산소(O)가 (마)의 질소(N)보다 유효 핵전하가 크다. (거짓)
⑤ 전기음성도는 (마)=질소(N) < (바)=플루오린(F) 이다. (거짓)

3번 정답: ④
3번 풀이:
(나)의 공명 구조부터 찾아야 한다. 옥텟 규칙을 만족하면서 가능한 구조는 2가지 정도 생각해볼 수 있는데, 문제에서 제시된 가운데 질소(N(3))가 형식전하 -1을 갖는 경우는 하나 뿐이다. N(3) 질소가 양쪽 질소와 단일 결합으로 연결되어야 형식전하 -1을 갖는다.
[ :N≡N─N≡N─N ]+ (X) , [ :N≡N─N─N≡N: ]+ (O)
① (가)에서 N(2)의 형식 전하는 5 - 4 = +1 이다. (참)
② (나)에서 형식 전하가 0인 원자의 개수는 2이며, N(1), N(5) 이다. (참)
③ (나)에는 이중 결합이 없고, 단일 결합과 삼중 결합만으로 이루어져 있다. (참)
④ N(2)-N(3)-N(4)의 결합각은 (가) > (나) 이다. (가)는 직선형 구조를 갖는 반면, (나)의 N(3) 질소는 공유전자쌍 2쌍, 비공유 전자쌍 2쌍을 가지며, 굽은형 구조를 갖는다. (거짓)
⑤ 전하 분리 관점에서 (가)는 양 끝단 1, 5 질소는 -2의 형식전하를 갖고, 가운데 2,3,4 질소는 +1의 형식 전하를 연속으로 갖는다. (나)는 2, 3, 4 질소가 +1, -2, +1의 형식 전하를 갖는다. 형식 전하의 분리가 작고, 전하 배치 관점에서 구조 (나)가 (가)보다 공명 구조에 대한 기여도가 더 클 것으로 예상할 수 있다. (참)

4번 정답: ②
4번 풀이:
이핵 이원자 분자의 MO이다. (가)는 N, (나)는 F이다. 같은 주기의 원소로 원자 번호가 더 큰 F의 원자 오비탈이 N 보다 낮게 표현된다.
① (가)는 N이다. (거짓)
② N의 2p 오비탈에는 3개의 전자가 배치되고, F의 2p 오비탈에는 5개의 전자가 있다. 따라서 두 2p 오비탈에 의해 생성된 NF의 분자오비탈(MO)에는 3 + 5 = 8개의 전자가 순차적으로 채워져야 한다. 가장 낮은 에너지의 π2p 에 4개의 전자가 채워지고, σ2p 에 2개의 전자가 채워지며, π2p* 각각에 1개씩의 전자가 채워지므로, 홀전자 수는 2이다. (참)
③ 1차 이온화 에너지는 N은 2p, NF는 π2p* 전자가 제거될 때 필요한 에너지이므로, 에너지가 낮은 질소의 전자를 떼어내는 것이 더 어렵다. 이온화 에너지의 크기는 N > NF 이다. (거짓)
④ 바닥 상태 분자의 결합 길이는 결합 차수를 통해 예상할 수 있다. 결합 차수는 0.5(결합성 궤도함수 전자수 - 반결합성 궤도함수 전자수) 이므로, NF+는 결합성 궤도함수에 6개, 반결합성 궤도함수에 1개 전자가 있으므로, 결합 차수를 구하면, 0.5(6-1) = 2.5 이고, NF는 0.5(6-2) = 2 이므로, NF+ > NF 이다. (NF+가 생성될 때, 반결합성 궤도함수 전자가 제거되므로, 결합 차수가 더 커진다고 판단해도 무방하다.) (거짓)
⑤ π2p 오비탈은 (나)의 2p 원자 오비탈과 에너지적으로 더 유사하며, (나)의 2p 원자 오비탈 성분이 (가)의 2p 원자 오비탈 성분보다 많다고 할 수 있다. (거짓)

5번 정답: ①
5번 풀이:
이온 결정 구조이다. 양이온과 음이온이 각각 어떠한 배열을 하고 있는지, 어떤 구멍을 점유하고 있는지를 묻고 있다. 점유하고 있는 구멍은 각 이온의 배위수와도 연관되어 있다.
① (가)는 양이온과 음이온 모두 면심 입방 구조로 배열되어 있으며, (나)는 양이온은 면심 입방, 음이온은 단순 입방 구조로 배열되어 있다. (참)
② (가)는 음이온 배열(또는 양이온)에 의해 만들어진 팔면체 구멍(배위수 6)에 양이온(또는 음이온)이 채워진 구조이며, (나)는 양이온 배열에 의해 만들어진 사면체 구멍(배위수 4)에 음이온이 채워진 구조이다. (거짓)
③ (나)에서 음이온의 배위 구조가 무엇을 뜻하는 걸까? 개인적으로는 '배위 구조'라는 용어가 생소하다. 음이온 주변 가장 가까운 음이온이 만드는 구조가 무엇인지를 묻는 것이라면, 팔면체(배위수 6)라고 말할 수 있을 것 같고, 음이온을 둘러싼 가장 가까운 양이온 기준으로 만들어지는 구조를 말하는 것이라면 사면체(배위수 4)라고 할 수 있다. 어쨌든 (거짓)
④ (나)에서 단위 세포당 양이온의 수는 4개, 음이온의 수는 8개이다. (거짓)
⑤ 양이온의 배위수는 (가)는 6, (나)는 8이다. (거짓)
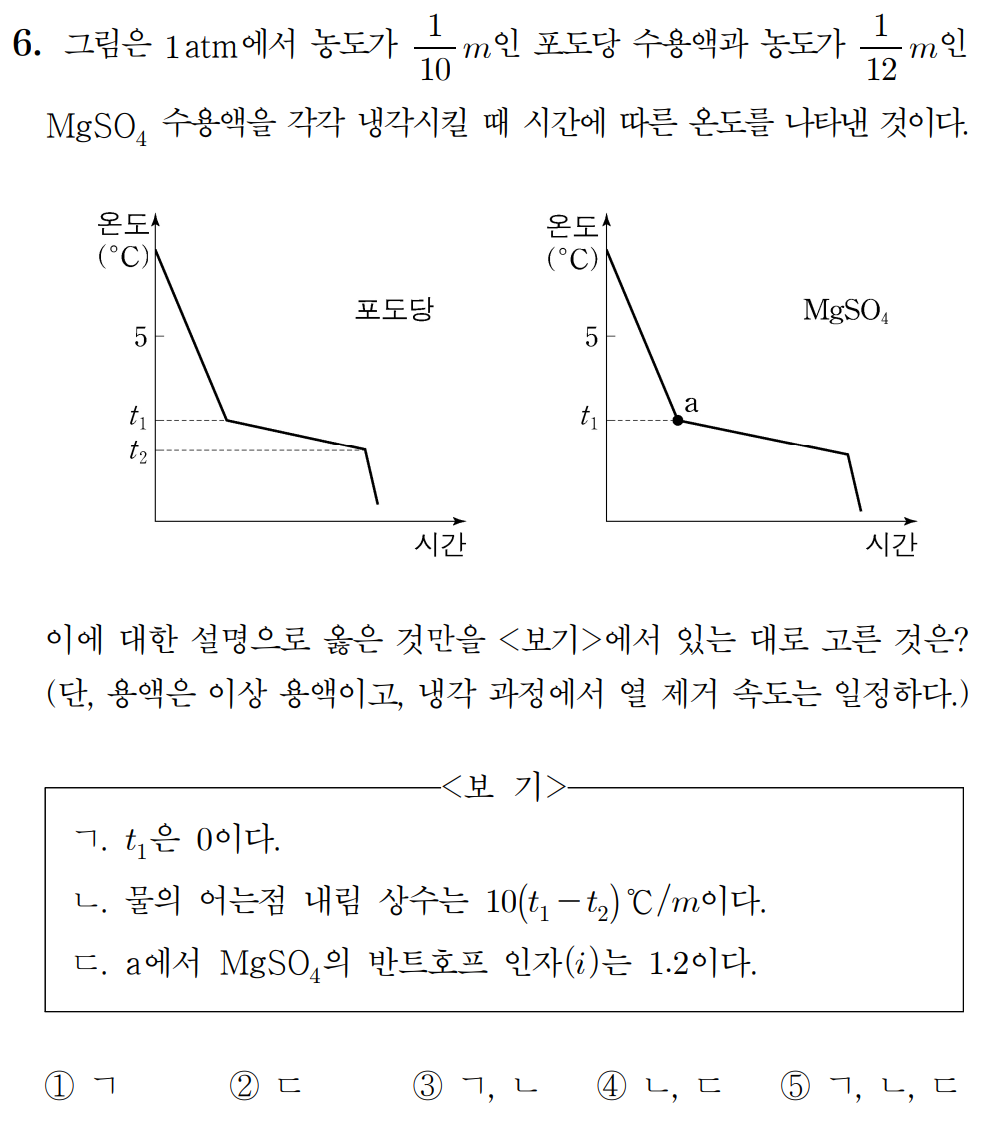
6번 정답: ② ㄷ
6번 풀이:
용액의 어는점 내림에 관한 문제이며, 총괄성에 대해 개념을 묻고 있다. 포도당 용액과 황산 마그네슘 용액의 용매는 모두 물(H2O)로 동일하므로, 같은 어는점 내림 상수(Kf)를 가지며, 순수한 물보다 어는점이 낮아진다. 따라서 두 용액의 어는점 t1은 0보다 작을 것이다. (ㄱ, 거짓)
포도당 수용액이 얼기 시작하는 온도는 t1이다. 어는점 내림(ΔTf) = (Kf)*용액의 몰랄 농도(m)*반트호프 인자에 의존한다. 포도당은 비해리성 용질이므로 반트호프 인자는 1이고, 다음과 같이 Kf를 나타낼 수 있다.
t1 = Kf * (1/10) * 1 이며, K_f = 10 * t1 이다. (ㄴ, 거짓)
같은 방식으로, 몰랄농도가 1/12 m 인 황산 마그네슘 용액의 어는점 내림(ΔTf)도 t_1으로 같으므로, 다음과 같이 식을 세워 표현할 수 있다.
t1 = Kf * (1/12) * i = 10 * t1 * (1/12) * i , i = 12/10 = 1.2 이다. (ㄷ, 참)

7번 정답: ③ ㄱ, ㄷ
7번 풀이:
상당히 재미있는 문제였다. 조건이 너무 부족한 것은 아닐까 생각했지만, 100 ℃로 온도를 지정해 준 것이 힌트였다. 100 ℃에서 물의 증기압은 1 atm이다.
따라서 평형 상태 (가)를 구성하는 기체는 헬륨(He) = 9 atm, 수증기 = 1 atm임을 알 수 있다. 온도가 일정한 상태이므로, PV = nRT에서 RT = 1이라 생각했을 때, He = 9 mol 이라면, 수증기 = 1 mol 이라고 생각할 수 있다.
문제에서 초기 넣어준 헬륨과 물의 몰수가 같다고 주어져 있으므로, 초기 9 mol의 물 중에 1 mol은 기화하여 수증기가 되고, 8 mol은 여전히 액체인 물로 남아있다고 할 수 있다.
ㄱ. (가)의 평형 상태에서 물은 8 mol, 수증기는 1 mol이므로, 물이 수증기의 8배이다. (참)
이제 콕을 열어 전체 부피가 3 L가 되었다. 온도가 일정하게 유지되고 있으며, 헬륨의 몰수는 변화가 없으므로, 압력이 1/3로 감소한다. 헬륨의 압력은 3 atm이 된다. 수증기 또한 압력이 1/3로 감소하게 되지만, 물과 수증기 사이의 평형이 깨지고, 100 ℃에서의 증기압 1 atm이 될 때까지 물이 기화하여 수증기를 생성한다. 수증기가 1 atm이 될 때까지 물의 기화가 일어나며, 1 atm * 3 L = 3 mol RT 를 만족해야 한다.
즉, (나)의 평형 상태에서 수증기의 몰수는 3 mol이 되어야 하며, 2 mol의 물이 더 기화해야 한다. 초기 9 mol의 물에서 3 mol은 수증기, 6 mol은 물로 남아 있는 상태이므로,
ㄴ. (나)에서 몰수는 물이 6 mol, 수증기가 3 mol로 물이 수증기의 2배이다. (거짓)
ㄷ. (나)에서 혼합 기체의 전체 압력은 He = 3 atm, 수증기 = 1 atm으로 4 atm 이다. (참)

8번 정답: ⑤ ㄱ, ㄴ, ㄷ
8번 풀이:
초기에 고체 (NH4)2CO3만 존재하던 상황에서 (가)의 평형 상태에 도달한 것이므로, 생성된 NH3, CO2, H2O 의 몰비는 2 : 1 : 1을 따른다. 전체 압력이 0.4 atm이라고 했으므로,
부분 압력은 NH3 = 0.4*(2/4) = 0.2 atm, CO2 = 0.4*(1/4) = 0.1 atm, H2O = 0.4*(1/4) = 0.1 atm이다. 해당 값으로 압력 평형 상수(Kp)를 구하면,
ㄱ. Kp = (0.2)2(0.1)(0.1) = 4 x 10-4 이다. (참)
이후 기체 CO2를 첨가했다. 얼마를 넣었는지 모르지만, 새로운 평형 상태에서의 CO2 부분 압력이 0.8 atm이다. 온도 변화가 없고, 외부에서 CO2가 첨가된 상황이므로, 평형은 역반응 쪽으로 이동하며, NH3, CO2, H2O가 소모되어 (NH4)2CO3를 만든다. 반응 비가 NH3 : H2O는 2 : 1이므로, NH3가 2x 감소하는동안 H2O는 x 감소한다. 이를 바탕으로 Kp 식에 대입하면,
0.0004 = (0.2 - 2x)2 * 0.8 * (0.1 - x) = 4(0.1 - x)2 * 0.8 * (0.1 - x)
0.0001 = (0.1 - x)3 * 0.8
(0.1)3 = (0.1 - x)3 * 8 = (0.2 - 2x)3
0.1 = 0.2 - 2x , x = 0.05
ㄴ. 즉, (나) 평형에서의 부분 압력을 구하면, NH3 = 0.2 - (2*0.05) = 0.1 atm, CO2 = 0.8 atm, H2O = 0.1 - 0.05 = 0.05 atm 이다. 따라서 혼합 기체에서 H2O의 몰분율 = 수증기 부분 압렵/전체 압력 = 0.05/0.95 = 0.1/1.9 = 1/19 이다. (참)
(다)는 기존의 (나)의 평형 상태에서 부피를 1/2로 감소시켰다. 온도는 일정하게 유지되고 있다. 단순히 부피 감소 효과만 따져주면, NH_3는 보일 법칙에 의해 압력이 2배 증가할 것이며, 0.2 atm의 압력을 가져야 한다. CO2는 1.6 atm, H2O는 0.1 atm이 되어야 하겠지만, 반응 지수 Q > K 가 되어 버리므로, 평형 상태가 깨지게 된다.
ㄷ. 부피 감소에 의한 역반응 평형 이동을 고려해주면, (다)의 NH_3의 압력은 0.2 atm 보다 작아진다. (참)

9번 정답: ③ ㄱ, ㄴ
9번 풀이:
침전 평형 문제에 대한 개인적인 생각
ㄱ. (가)는 AgCl 수용액으로, 용액 내 Ag+가 공통 이온으로 작용하므로, AgSCN의 몰용해도가 감소한다. 따라서 순수한 물에서의 몰용해도가 더 크다. (참)
ㄴ. (가)에 충분한 양의 AgSCN을 녹여 평형에 도달하면, AgCl과 AgSCN의 평형 상수를 모두 만족하며, Ag+ 양이온은 공통 이온으로 작용한다. 따라서 용해도곱상수로 나타내보면,
[Ag+][Cl-] = 1.0 x 10-12
[Ag+][SCN-] = 1.8 x 10-10
[Ag+]가 같으므로, 10-12/[Cl-] = (1.8x10-10)/[SCN-]로 식을 나타낼 수 있고, [Cl-]/[SCN-] = 180 이다. (참)
ㄷ. (나) 용액에 AgSCN을 첨가한 상황을 반응식으로 나타내면,
AgSCN → Ag+ + SCN- , K = 1.0 × 10-12
Ag+ + S_2O_3- → AgS2O3 , K = (2/3) × 109
---------------------------------------------------------------------------------------
AgSCN + S2O3- → AgS_2O3 + SCN- , K = (2/3) × 10-3
여기서 S2O3 농도가 0.01 M이고, SCN- 농도는 오로지 AgSCN의 몰 용해도(x)에만 의존하므로, 다음과 같다.
x/0.01 = (2/3) × 10-3, x = (2/3) × 10-5
Ag+는 0.01*[Ag+] = 1.5 × 10-9 이다.
[Ag+] = 1.5 × 10-7 이다. AgSCN의 몰 용해도는 1.0 × 10-12 = [Ag+][SCN-] = (1.5 × 10-7) * [SCN-] = 1.0 × 10-12 이므로, [SCN-] = 2/3 * 10-5 M 이다. (거짓)

10번 정답: ③ ㄱ, ㄴ
10번 풀이:
298K에서의 표준 기화 자유 에너지가 +5.2 kJ/mol이다. 즉, 순수한 기체 상태 벤젠이 순수한 액체 상태 벤젠에 비해 5.2 kJ만큼 G ˚ 가 높음을 의미한다. 표준 기화 자유에너지가 0보다 크다는 것(ΔvapG ˚ > 0)은 반응의 평형이 반응물 쪽에 치우쳐 있음을 뜻한다.
그래프는 기체 벤젠(생성물)의 부분 압력(분율)에 따른, 반응 자유에너지 변화량(ΔG )를 나타낸 것이며, y값(ΔG )이 0이라는 뜻은 해당 지점에서 혼합된 기체 벤젠과 액체 밴젠 사이의 평형이 이루어졌음을 말한다. 298K에서의 평형 벤젠 증기압은 a [atm]이며, T 1에서는 a 보다 크다.
ㄱ. y = 0일 때, x의 값이 평형에서의 벤젠 증기압이므로, 298 K에서의 벤젠의 증기압은 a 이다. 평형 상태의 ΔG = 0이므로, 자유 에너지 식에 값을 넣어보면,
ΔG = ΔG ˚ + RT lnQ
0 = + 5200 + (8.31*298)ln(a) [J]
ln(a) = - 5200/(8.31*298) 이다. (참)
ㄴ. 기화 반응의 평형 상수 K 는 평형 상태에서의 기체 벤젠의 증기압에 의해 결정된다. 평형 상태에서의 ΔG = 0 이므로, y축 값(자유 에너지 변화량)이 0일 때의 증기압이 곧 평형 상수다. 298 K일 때보다, T 1에서의 증기압이 크며, 평형상수 또한 크다. (참)
ㄷ. 온도가 일정할 때, ΔG ˚는 고정된 값이다. 298 K에서는G gas - G liquid = +5.2 kJ이며, T 1 그래프도 일정 온도에 대한 것이니 ΔG ˚도 어떤 고정된 값을 가질 것임은 분명하다.
그래프를 통해 x축 값을 비교해보면, 298 K일 때보다 T 1 온도에서 x축 값이 더 크다. 이는 평형이 더 생성물 쪽에 치우쳐 있고, 평형 상수 K 가 더 크다는 것을 뜻하며, ΔG ˚가 + 5.2 kJ보다는 더 작은 값을 갖는다는 것을 알 수 있다.
온도 T 1에서의 표준 기화 자유에너지 ΔG ˚ 값을 x라 한다면, x < 5.2 kJ/mol 이며, 증기압이 1 atm일 때의 식은 다음과 같이 나타낼 수 있다. (거짓)
b = x +RTln(1)
b = x (x < 5.2)
* 본문 설명이나 풀이가 잘못된 부분에 대해 지적해주시면, 참고하여 수정 및 업데이트 하도록 하겠습니다. 위 문제의 출처는 mdeet.org 의치의학교육입문검사 사이트입니다.
