DPPH를 이용한 항산화능 분석
0. 들어가기
고등학교에서 화학을 주제로 제대로 된 탐구를 하기에는 이런저런 어려움이 많다. 실험실 환경, 시간 제약, 물질의 제한 등으로 인해, 잘해봐야 간단한 일반화학실험 수준을 넘어서기 어렵다. 그나마 동아리 활동 등에서 시도해 볼 수 있는 기초 실험으로 아스피린 합성하고, 나일론 합성하고, 녹차, 커피, 에너지 드링크 속에서 카페인을 추출하는 정도이다.
그러나, 이마저도 너무 보편화되어 학생들의 과학 활동으로 너무 흔하게 되다 보니, 욕심 있는 학생들은 한 단계 더 높은 탐구를 찾아 이것저것 시도하면서 자신의 열정과 우수성을 어필하려 한다.
블로그에 고등학생을 위한 자외선-가시광선 분광광도법에 대한 글(129)을 작성한 때가 2020년인데, 이후 지능형 과학실 도입과 맞물려 무선 센서 형태의 분석 기기들이 일반계 고등학교에도 많이 보급되었고, 학생들이 분광광도계를 접할 수 있는 기회도 많이 늘다 보니, 분광광도계를 활용한 실험들도 이전보다 주목받는 것 같다.
오늘은 학생들이 과제연구 등에서 많이 활용하려고 하고, 관심은 있지만 막상 설명은 못하는 "DPPH를 이용한 물질의 항산화능 분석"에 관한 이야기를 해보려 한다.
* 중고등학생들을 위한 본문 3줄 요약
1. DPPH는 홀전자를 가지며, 보라색(자주색)을 나타냄.
2. DPPH의 홀전자가 사라지면, 옅은 노란색으로 변함.
3. 후보 물질과 DPPH가 반응하여 보라색이 사라지는 정도를 517 nm 부근의 흡광도 변화를 통해 판단할 수 있음.
* 긴 글 주의
DPPH를 이용한 항산화능 분석 (DPPH Assay)
1. DPPH란?
DPPH는 비교적 안정한 자유 라디컬 분자로, IUPAC 이름은 2,2-diphenyl-1-picrylhydrazyl이다. 이름 앞글자만 따서 DPPH라 부른다.
짙은 보라색 결정이며, 물질의 항산화능 분석에 자주 사용된다. 예전에는 파우더나 용액으로 구입할 수 있었던 것 같은데, 무슨 이유인지 현재는 파우더 형태로 구입하기 쉽지 않은 것 같다. 대부분 0.2mM 용액으로 판매되고 있었다.

DPPH의 라디컬 구조는 1922년, 슈테판 골트슈미트(Stefan Goldschmidt, 1889-1971)와 코야드 렌(Konard Renn)에 의해 보고되었다.[1] 그리고 안정한 라디컬 분자를 이용하여 항산화 활성을 판단하는 아이디어는 1958년 마스덴 스콧 블로이스(Marsden Scott Blois, 1919-1988)에 의해 제안되었다.[2]
가. 자유 라디컬(free radical)
DPPH의 분자 구조를 보면, 중심 질소에 짝짓지 않은 홀전자가 있다. 이런 홀전자를 갖는 분자를 자유 라디컬 분자라 하는데, 라디컬 분자 대부분은 큰 반응성을 보이거나 자체 반응을 통해 이합체(dimer)를 형성하는 경우가 많다. DPPH는 라디컬 분자 치고는 비교적 안정한 편이어서 이합체를 형성하지 않는다.

DPPH가 비교적 안정할 수 있는 주된 이유는 자유 라디컬이 존재하는 중심 질소 주위의 입체적 방해와 함께, 다이페닐아미노 그룹(-NPh2)과 피크릴 그룹(2,4,6-TNP) 사이의 푸시-풀(push-pull) 효과* 때문으로 설명된다. 이 효과는 분자 전체에 걸쳐 전자를 비편재화(delocalization)시켜 구조를 안정화하는 데 중요한 역할을 한다.
* 푸시-풀 효과는 화합물에서 전자를 제공하는(donating) 그룹과 전자를 끌어당기는(withdrawing) 그룹이 함께 작용하여 전자 밀도를 조절하는 현상을 말한다. DPPH의 경우 다이페닐아미노 그룹이 전자 주개(EDG), 피크릴 그룹이 전자받개(EWG)로 작용한다.
나. DPPH의 보관
DPPH는 비교적 안정한 분자로 취급되지만, 보관에 유의해야 할 필요가 있다. DPPH는 빛, 온도, 산소, 용매, pH 등에 영향받으며,[3] 특히 빛에 민감하다. 이에 갈색병에 담아 알루미늄 포일로 감싸서 냉장 보관하는 것이 좋다.
2. DPPH를 이용한 항산화능 분석
DPPH를 이용한 항산화능 분석은 시간과 절차면에서 간단하고, 효율적이기 때문에 흡광도를 측정할 수 있는 환경만 갖춰져 있다면, 고등학교 실험실에서도 충분히 활용될 수 있다.
가. 분석 원리
DPPH는 자유 라디컬 형태일 때 짙은 보라색(핑크와 보라 사이)을 나타낸다. 그리고 분자 내 홀전자가 사라지면, 무색 또는 옅은 노란색이 된다. 겉으로 드러나는 색 변화는 DPPH· 라디컬이 얼마나 소거되었는지를 가늠할 수 있는 하나의 척도가 되어준다.

DPPH· 라디컬은 500 ~ 600nm 부근에서 광범위하게 흡수가 일어나고, 가시광선 영역 내의 최대 흡수 파장은 515 ~ 520 nm 부근에서 나타난다. 우리 눈에는 보라색(자주색)으로 보인다. 라디컬이 소거될수록 겉보기 색인 보라색은 점점 연해지고, 흡수 봉우리의 높이도 함께 줄어든다. 만약, DPPH· 라디컬의 흡수 파장이 517 nm이고, 일정 시간(30분 정도)이 지난 뒤 측정한 흡광도가 초기값의 50% 밖에 되지 않는다면, DPPH· 라디컬의 절반이 사라져 농도가 절반이 되었음을 뜻한다.
반응이 진행될수록 용액은 보라색에서 옅은 노란색으로 확연한 색깔 변화를 갖기 때문에 DPPH· 라디컬의 소거 여부를 눈으로 관찰 가능할 뿐만 아니라, 흡수 스펙트럼의 봉우리 높이 변화를 측정하여 정량적인 판단도 가능한 것이다.
나. 준비물
- 시약 및 용매: DPPH 분말 또는 용액, 에탄올 또는 증류수, 샘플(식물 추출물 등) 등 (선택: 아스코르브산)
- 기기 및 소모품: UV-Vis 분광광도계, 큐벳, 피펫 및 피펫 팁, 플라스크 류, 알루미늄 포일 등
다. 분석 방법
[1] DPPH 용액을 준비: 1.0 mM의 DPPH· 스탁 용액을 에탄올로 묽혀 0.1 ~ 0.5 mM DPPH 용액을 만든다. 예를 들어 0.2 mM 용액 50 mL를 만들고자 하는 경우, 스탁 용액 10 mL와 에탄올 40 mL를 혼합하면 된다. 제조한 DPPH 용액은 빛에 민감하므로, 알루미늄 포일로 감싸 어두운 환경에서 보관한다.
[2] 샘플 시료 준비: 항산화 활성을 확인하고자 하는 샘플(예: 식물 추출물)을 에탄올 또는 물에 녹여 일정한 농도의 용액을 준비한다. 색이 있는 추출물의 경우, DPPH 흡광도에 간섭을 줄 수 있으므로, 너무 진하지 않은 농도로 희석한다.
[3] 반응 혼합물 준비 및 반응: DPPH 용액 3 mL와 샘플 시료 용액 0.5 mL를 혼합한다.* 대조군에는 DPPH 용액 3 mL에 샘플 시료 용액의 배경이 되는 용매(에탄올 또는 물)만 0.5 mL 넣는다.** 만들어진 샘플들과 대조군을 30분간 어두운 환경에서 반응시킨다.
* 3.5 mL 큐벳 기준으로 DPPH와 샘플 시료의 혼합 비율이 3 : 0.5로 정해져 있는 것은 아니지만, 샘플 내 항산화제가 과도하여 라디컬이 지나치게 빠르게 소거되거나 포화상태에 도달해 버리는 것을 방지하기 위해, DPPH 농도가 샘플 시료보다는 높은 비율로 포함되도록 하는 것이 좋다. 만약, 샘플 용액이 DPPH 용액과 비슷한 색을 가지고 있어 간섭 우려가 있는 경우에는 샘플 용액 비율을 더욱 낮춰 흡광도 값에 영향을 주는 것을 최대한 억제해야 한다.
** 이미 항산화 활성이 검증된 물질을 추가 대조군으로 설정하여 비교하고 싶은 경우에는, 보통 아스코르브 산(비타민 C)을 사용한다. DPPH에 샘플 시료 대신, 같은 농도의 아스코르브산 용액 0.5 mL를 혼합하여 반응시켜 비교하면 된다. 항산화 활성 효과 정도를 비교하는 양성 대조군(positive control)으로 사용할 수 있다.
[4] 분광광도계 준비: 자외선-가시광선 분광광도계를 예열한 후, 측정 파장을 517 nm*로 설정하고 배경이 되는 용매(에탄올 또는 물)를 큐벳에 넣고, 영점(background, 기준선)을 잡는다.
* 흡수 파장은 기기마다 조금씩 차이가 있을 수 있기 때문에, 전체 가시광선 영역(400 ~ 700 nm)에서 스펙트럼을 스캔하여 사전에 정확한 흡수 파장을 확인해 두는 것도 좋다. 보통은 515 ~ 520 nm 부근을 크게 벗어나지는 않는다.
[5] 반응 후 흡광도 측정: 암실에서 30분간 반응한 샘플 용액과 대조군 용액의 흡광도를 각각 측정한다. 대조군 DPPH 용액의 흡광도와 샘플의 DPPH 용액의 흡광도 차이를 바탕으로 샘플의 라디컬 소거 능력을 계산한다. 반복 실험을 통해 결과의 신뢰성을 확보할 수 있다.
3. 항산화능 표현 방법
DPPH 용액의 흡광도 변화를 통해 물질의 항산화능을 표현하는 지표로 '라디컬 소거 활성(Radical Scavenging Activity, RSA)'과 '50% 억제농도(Inhibitory Concentration 50%, IC50)'가 있다.
가. RSA
반응 이후, 대조군과 샘플 용액의 흡광도 차이가 크다는 것은 샘플 시료가 DPPH· 라디컬을 효과적으로 제거할 수 있음을 뜻한다. 샘플 시료의 라디컬 소거 활성(Radical Scavenging Activity, RSA)은 다음과 같이 나타낸다.
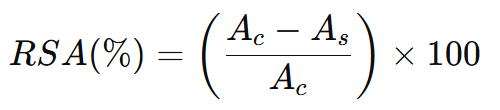
Acontrol = 대조군(DPPH + 용매) 흡광도
Asample = 샘플(DPPH + 샘플) 흡광도
반응 시간(30분) 동안 샘플 시료가 반응하여 DPPH· 라디컬을 많이 소거했다면, 샘플 시료 흡광도(As)는 대조군 흡광도(Ac)에 비해 작게 측정되고, 높은 RSA 값을 갖게 된다. 예를 들어 대조군 DPPH 흡광도(Ac)가 1.0이고, 샘플 흡광도(As)가 0.2라면, %RSA는 ((1.0 - 0.2) / 1) * 100 = 80%으로 계산된다.
라디컬 소거능(RSA)이 높다는 것은 생물학적 시스템에서 세포 손상과 노화, 질병을 초래하는 것으로 알려진 대표적인 자유 라디컬(슈퍼옥사이드(O2-·), 하이드록시 라디컬(OH·), 과산화 라디컬(ROO·) 등)의 소거에도 효과적일 수 있기에, 항산화 활성이 높다고 평가될 수 있다.
나. IC50
RSA는 어떤 샘플의 항산화 효과(라디컬 소거능)를 확인할 수 있는 간단한 지표이지만, 서로 다른 두 가지 이상의 샘플 A, B를 정량적으로 비교하려면, 두 샘플 농도를 같게 맞춰주어야만 정량적인 비교가 가능하다.
예를 들어 1.0 mM 농도의 A 샘플과, 0.2 mM 농도의 B 샘플을 각각 DPPH와 반응시켰을 때, 얻은 RSA 값이 A는 60% B는 40일 때, RSA 값 비교만으로 A 샘플의 라디컬 소거 능력이 우수하다고 무조건 주장하기는 어렵다.
이에, 서로 다른 둘 이상의 샘플 시료의 라디컬 소거 능력을 정량적으로 비교하고자 할 때는 IC50(Inhibitory Concentration 50%) 지표를 사용하는 것이 좋다.
IC50은 초기 대비 50%의 라디컬의 소거되는 효과를 보이기 위해 필요한 샘플 농도를 뜻한다. 따라서 IC50 값이 작을수록 항산화 능력은 뛰어나다. 적은 농도의 샘플 시료만으로도 자유 라디컬의 50%를 제거할 수 있음을 뜻하기 때문이다.
IC50 값은 일정 비율로 묽힌, 샘플 시료 여러 개(최소 4개 이상)를 동일한 조건(보통은 30분 반응)에서 DPPH와 반응시켜 흡광도 값을 각각 측정한 뒤, 시료 농도-RSA 그래프를 도시*하여 RSA가 50%가 되는 시점의 농도를 찾는 방법으로 얻을 수 있다.
* 소거되지 않은 라디컬 형태의 DPPH 농도는 흡광도에 선형으로 비례한다. 대조군인 0.1 mM DPPH 흡광도가 1.0이라면, 50% 소거된(RSA=50%) 지점에서의 시료 농도를 찾기 위해서는 흡광도가 0.5일 때의 샘플 시료 농도를 알아야 한다.
단순하게 생각했을 때 가장 좋은 방법은, 매우 촘촘한 농도 간격으로 다수의 샘플을 만들어 반응시킨 후, 흡광도가 대조군 대비 50% 감소한 샘플 농도를 직접 찾는 것이다. 예를 들어 1 mM, 0.5 mM, 0.2 mM, 0.1 mM, 0.05 mM, 0.02 mM, 0.01 mM의 샘플 시료를 각각 DPPH와 동일 조건에서 반응시킨 후, 흡광도를 측정하고, 50% 흡광도를 갖는 농도 샘플을 찾는 것이다. 그런데 만약, 측정한 7개 샘플 중에 RSA=50에 해당하는 농도가 없다면 어떻게 해야 할까? 만약, 0.1 mM과 0.2 mM 사이라는 것만 알 수 있다면 어떻게 해야 할까?
결국, 우리는 샘플 농도에 따른 RSA 추세선을 통해, 50% 지점에서의 농도를 찾아야 한다.
만약, 샘플 농도와 라디컬 소거능(RSA) 사이에 선형 관계가 성립한다면, 최소 세 개 농도의 샘플만 있어도 직선 추세선(y = ax +b)을 그릴 수 있겠지만, 보통은 샘플 농도와 라디컬 소거능 사이에는 로그형 커브(S자 커브, logistic curve)에 더 잘 대응된다.(사실은 이러한 이유 때문에 IC50, LD50 등에서 50% 지점을 의미 있는 값으로 보고, 지표로 사용하는 것이긴 하다.)
이에, 되도록 넓은 농도 범위를 커버하면서도, 최소 4개 이상(되도록 8 ~ 10개)의 샘플 시료에 대한 RSA 값을 바탕으로 추세 곡선을 그려서 IC50 값을 구해야 한다.
표준화된 환경에서 물질 A와 B의 IC50 값이 10 μM, 50 μM으로 얻어졌다면, 물질 A는 B의 1/5 농도만으로도 DPPH· 라디컬의 50%를 소거할 수 있다는 뜻이다. 이 경우, 물질 A의 항산화 능력이 B보다 2배 강력하다고 평가할 수 있다. 이와 같이 IC50 값은 여러 물질의 항산화 능력을 같은 선상에서 비교하고 평가하는 데 중요한 지표가 되어준다.
4. DPPH 분석법의 한계
DPPH 분석법은 여러 면에서 간단하고, 재현성이 높아 항산화 활성을 평가하는데 유용하게 사용되지만, 다음과 같은 한계점이 있다.
[1] DPPH· 라디컬은 생체 내 환경에서 발생하는 활성 산소나 자유 라디컬과는 구조적으로 다르다. 이에 DPPH· 라디컬이 소거되는 메커니즘은 생체 내 항산화 메커니즘과 차이가 있고, DPPH 분석법의 결과인 RSA와 IC50 값이 실제 생리적 환경에서의 항산화 효과와 직결된다고 생각하면 안 된다.
[2] DPPH 분석법은 시료의 색 변화를 통해 라디컬 소거(농도 변화)를 판단하기 때문에, 시료에 포함된 색소나 흡광 특성으로 인해 결과가 왜곡될 수 있는 가능성이 있다. 특히, 천연 추출물의 경우 다양한 색소를 포함하기 때문에 흡광도 결과를 처리하는 과정에서 유의해야 한다.
[3] DPPH 분석법은 시료의 산화 억제 능력을 전자 제공 능력만으로 판단하는 것이므로, 다른 항산화 메커니즘을 통한 억제 효과를 평가하지는 못한다.
5. 참고
[1] Goldschmidt, S.; Renn, K. Zweiwertiger sticlstoff: Über das α,α-diphenyl-β-trinitrophenyl hydrazyl. Ber. Dtsch. Chem. Ges. B 2022, B55, 628–643
[2] Blois, M.S. Antioxidant determinations by the use of a stable free radical. Nature 1958, 181, 1199–1200.
[3] Ozcelik, B.; Lee, J.H.; Min, D.B. Effects of light, oxygen, and pH on the absorbance of 2,2-diphenyl-1-picrylhydrazyl. J. Food Sci. 2003, 68, 487–490.
[4] Gulcin, İ.; Alwasel, S.H. DPPH Radical Scavenging Assay. Processes 2023, 11, 2248.
- 끝 -
* 끝까지 읽어주셔서 감사합니다.
* 2024-12-11 DPPH 라디컬의 가시광선영역 최대흡수파장에 대한 색상 표현 오류 수정
