2025학년도 대학수학능력시험(2024.11.14.) 화학2 풀이 [11번]
2025학년도 대학수학능력시험(2024.11.14.) 화학2 풀이 [11번]

11번 답: ①
11번 풀이:
11번은 상평형 문제인데 개인적으로는 괜찮은 것 같다. 다수 학생들이 단순히 온도가 일정하니까 단연히 증기압은 일정하지... 하면서 풀었다면, 그것도 좋다. 오히려 상평형과 증기압 개념이 적절하게 연결되어 있고, 별다른 고민 없이 확신을 가질 수 있다는 뜻일테니 말이다. 물론, 그런 학생들에게는 아래 이어질 설명이 너무 구구절절하다고 느낄 수 있겠다.
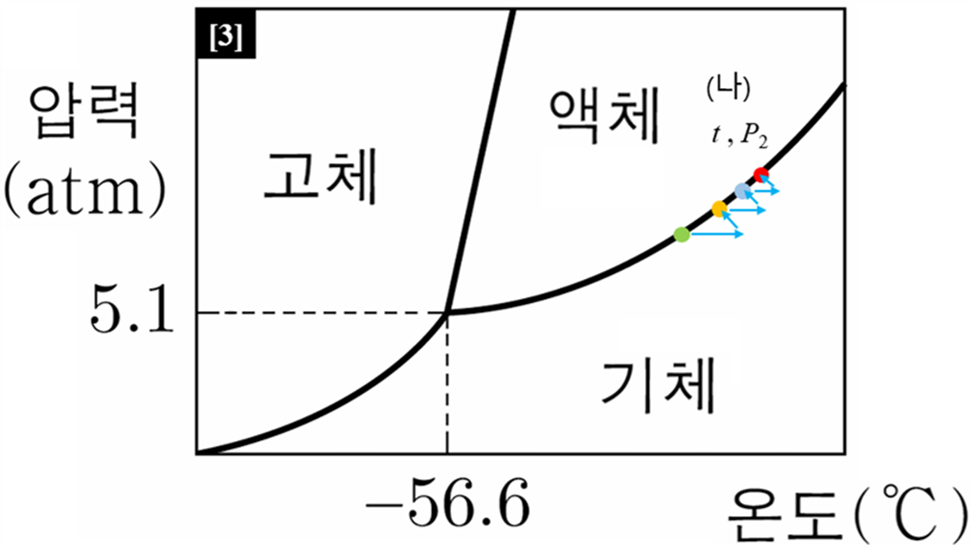
상평형 그림은 물질의 안정한 상을 파악하게 해줄 뿐만 아니라, 압력과 온도가 변할 때 물질이 어떤 방향으로 변할지에 대한 정보를 제공한다. 물질은 궁극적으로는 안정한 상을 찾아 이동한다. 안정한 상이 두 종류라면, 평형을 이루는 방향으로 이동하며, 안정한 상이 한 종류라면, 하나의 균일한 상을 이루 방향으로 상변화가 지속된다. 이 문제에서는 실험 결과에서 꼭지를 연 뒤 온도가, 꼭지를 열기 전, 즉 (가)와 동일하다는 조건이 중요했다.
[요약]
온도가 일정하면, 물질의 증기압력은 일정하다.
상평형 그림에서 액체와 기체가 공존하기 위해서는 온도 t > - 56.6 이어야 하며,
온도 t 에 해당하는 증기압은 P1 = P2 이다.
꼭지를 열어 전체 부피가 커졌음에도 기체의 압력은 왜 변하지 않았을까? 단계별로 알아보자.
[1]
(나)에서 꼭지를 열면, 부피가 2배 증가하고, 전체 압력은 절반으로 떨어진다.
액체와 기체가 평형인 상태에서 기체 압력(P )만 떨어지면(①), 상도표에서 물질은 기체 영역에 위치하게 된다. 해당 영역에서는 기체만이 안정한 상이며, 액체는 불안정한 상으로 간주된다.
따라서 남아있던 액체는 안정한 기체로 변하려고 상변화를 시한다. 자연스럽게 기체 몰수가 늘어나고, 기체 압력도 증가(↑)한다. 그런데, 기체 입자가 생겨나는 기화 과정은 흡열 반응(ΔH > 0)이므로, 주위 온도는 감소하게 된다(←).
결과적으로 온도는 감소하고 압력은 증가하는 방향(↖)을 향해 위치가 이동(②)한다. 그 결과 초기 온도(t )와 압력(P1)보다는 낮은 온도(t ')와 압력(P ')의 새로운 액체-기체 평형인 [지점 1]으로 이동했다. 미처 기체로 변하지 못하고 남아있던 액체도 다시 기체와 함께 안정한 상이 되었다.


[2]
그런데 [지점 1]은 (나)의 평형 상태가 아니다. 왜냐하면, 문제 조건에서 (나)의 평형 상태 온도가 t 로 일정하다고 했기 때문이다. [지점 1]의 온도는 t 보다 낮다. 온도만 조금 올려보자(→). 어떤 일이 일어날까?
온도만 조금 높이면, 다시 상평형 그림의 평형 지점을 수평 방향으로 벗어나게 되며(③), 다시 기체 영역에 놓이게 된다. 가장 안정한 상이 기체하나 뿐이라는 뜻이다.
따라서 용기에 남아있는 액체 CO2 는 안정한 상이 아니게 되고, 또 기화하여 기체 CO2를 만드는 반응이 진행된다. 기화 과정에서 온도는 감소하고, 동시에 압력은 증가하는 방향(↖, ④)으로 또다시 이동한다. [지점 1] 보다 조금 더 온도와 압력이 조금씩 높은 평형 상태인 [지점 2]에 도달했다.

[3]
위와 같은 방식으로 온도를 조금씩 조금씩 올려 초기 t 와 같아질 때까지 상변화를 지속하면, 결국 초기 T, P1 지점으로 돌아오게 된다. 물론, 지속적으로 기화 반응이 일어났기 때문에, 이전보다 액체의 양은 줄고, 기체 양은 늘었을 것이다. [실험 결과]에서 CO2의 안정한 상의 수가 2라는 조건이 없다면, P2를 어떤 한 지점으로 지정할 수 없게 된다.
위 설명과 별개로, 단순 이상 기체라는 가정하에 P, V, n, T 관계만 살펴보자. 기체 몰수(n )가 일정한 상태에서 부피(V )가 늘어나게 되면, 일정량의 기체 충돌 횟수가 감소하기 때문에 압력(P )이 떨어지는 것이 어찌 보면 당연하다. 기체만 존재하는 상황이라면 아무런 문제가 없다.
그러나 문제 조건은 액체와 기체가 공존하고 기화를 통해, 또는 액화를 통해 기체 몰수가 변할 수 있는 상황이다. 액체 입장에서는 외부 압력이 낮아지는 효과가 발생했으니, 증발과 응축의 균형이 깨진다. 액체를 누르는 외부 압력(기체의 압력)이 낮아졌다는 것은 '액체 증발 속도가 기체 응축 속도보다 빠른' 상황이 되었다는 것이며, 결국 기화가 우세하게 일어나 기체 몰수가 증가하고, 압력이 상승하게 된다. 언제까지? 주어진 온도 t 에 해당하는 증기압을 가질 때까지...
이전에도 의치대편입시험에서도 비슷한 문제가 있었다. 관심 있으면 읽어보는 것도 재미있을 듯하다.
2015 MEET/DEET 자연과학2(일반화학) 5번 : https://stachemi.tistory.com/47
2015 MEET/DEET 자연과학2(일반화학) 기출문제 5번 풀이
2015 MEET/DEET 자연과학2(일반화학) 기출문제 풀이 [5번] 개요 처음 문제를 접했을 때, 도대체 무엇을 묻고자 하는지에 감이 오지 않을 수 있습니다. 물의 상평형 그림과 함께 상전이 과정에서의
stachemi.tistory.com
* 위 문제의 출처는 한국교육과정평가원이며, 정답 및 해설 강의는 EBSi 사이트에서도 확인하실 수 있습니다.
