용액의 완충 효과를 높이는 방법 (feat. 완충 용량)
용액의 완충 효과를 높이는 방법
완충 용량(buffer capacity, β )
0. 들어가기
이전 글(320)을 통해 완충 용액은 외부에서 첨가된 소량의 강산 또는 강염기에 의해 pH가 급격하게 변하는 것을 막고, pH가 유지될 수 있음을 알아보았다.
용액의 완충 효과는 용액을 구성하는 약산과 짝염기 비율, 절대 농도 등에 따라 달라지며, 되도록 진한 용액이면서 1:1 비율을 갖추는 것이 좋은데, 이번 글을 통해서는 약산 짝염기 비율, 절대 농도 진하기에 따라 pH 변화율이 얼마나 달라지는지를 직접 계산해 보고 완충 효과를 높일 수 있는 요인들을 직접 확인해 보고자 한다.
1. 산 첨가에 따른 용액의 pH 변화
'순수한 물'과 '완충 용액'에 같은 양(mol)의 강산을 소량 첨가하면 두 용액의 pH는 어떻게 다를까?
가. 순수한 물
pH가 7인 순수한 물 10 mL에 0.1 M HCl 수용액 1 mL를 첨가하면,
물의 pH는 얼마나 변할까?
순수한 물에 첨가된 H+의 양은 0.1 M * 1 mL = 0.1 mmol 이다. 산 첨가 이후 전체 용액 부피는 10 mL + 1mL = 11 mL 이며, 용액의 H+ 농도는 0.1 mmol / 11 mL = 0.0091 M 이다.
산 첨가 이후 용액의 pH = - log(0.0091) = 2.04 이다. 초기 물의 pH = 7이었고, 0.1 M HCl 1 mL 첨가만으로, pH는 2.04까지 감소했다. 약 4.96 만큼 pH가 낮아졌으며, 무려 70.9 %의 pH 변화를 겪었다.
즉, 순수한 물은 외부에서 첨가된 산으로부터 pH가 변하는 것을 거의 막아내지 못했다고 할 수 있다.
나. 아세트산/아세트산 나트륨 완충 용액
pH가 4.75인 0.1 M 아세트산/아세트산 나트륨 용액 10 mL에
0.1 M HCl 수용액 1 mL를 첨가하면, pH는 얼마나 변할까?
일단, 초기 아세트산/아세트산 나트륨 용액의 pH를 알아보자. 아세트산의 pKa = 4.75이고, 아세트산(HA)과 아세트산 이온(A-) 농도가 각각 0.1 M로 같으므로, 헨더슨-하셀바흐 식의 log 안 [A^-]/[HA] 농도 비가 1이 되어, 용액의 초기 pH는 pKa와 같은 4.75이다.

여기에 0.1 M의 HCl 1 mL, 즉 H+ 0.1 mmol을 첨가하자. 용액의 pH는 얼마나 변할까?
초기, 아세트산/아세트산 나트륨 용액 10 mL 에는 1 mmol (=0.1 M*10 mL)의 HA와 A-가 공존하며, 평형 상태를 유지하고 있다. 그러나 외부에서 첨가된 0.1 mmol의 H+ 이온은 아세트산/아세트산 이온의 기존 평형을 깨뜨리고, 갑자기 용액 내 H^+ 농도를 급격하게 높인다. (Q ≠ Ka)

첨가된 외부 자극(H+)을 해소하기 위해서는 수소 이온을 제거할 수 있는 역반응(←)이 진행되어야 하며, 주어진 온도의 Ka 값을 다시 만족할 때까지 이동이 일어난다. 역반응을 통해 도달한 새로운 평형 상태에서는 짝산인 아세트산(HA)이 약간 늘고, 짝염기인 아세트산 이온(A-)이 약간 줄어든다.
근사하면, 새로운 평형에서의 아세트산(HA) = 약 1.1 mmol, 짝염기인 아세트산 이온(A-) = 약 0.9 mmol이다.
[HA] ≒ 1.1 mmol/11 mL , [A-] ≒ 0.9 mmol/11 mL
이전과 달라진 것은 짝산, 짝염기의 몰(mol) 수와 그에 따른 비율이다.
해당 비율을 헨더슨-하셀바흐 식에 대입하여 새로운 평형에서의 pH를 계산해 보면 약 4.67이다. 초기 pH 값 4.75 보다 대략, 0.08 정도 pH 값이 감소했으며, % 비율로 따지면 약 1.7 %에 해당한다.
앞선 순수한 물과 동일한 부피의 용액에 동일한 1 mmol의 HCl을 첨가했음에도, 순수 물에 비해 pH 변화가 확연하게 적어짐을 알 수 있다. 아세트산/아세트산 나트륨 용액의 완충 효과가 물보다 컸다고 할 수 있다.
2. 완충 용량 (buffer capacity, β )
순수한 물보다는 아세트산/아세트산 나트륨으로 만들어진 완충 용액의 pH 변화가 적었다. 물론, 아무리 완충 용액이라도 pH가 전혀 변하지 않는 것은 아니었다. 약간은 변했다.
완충 용액도 외부에서 산을 첨가하면 pH가 약간 떨어지고, 염기를 첨가하면 pH가 약간 오른다. 외부 자극에 의해 새로운 평형으로 이동하고, 그에 따라 용액 내 수소 이온 수가 달라져 pH는 변한다. 완충계를 구성하지 않았을 때보다 변화 폭이 많이 감소할 뿐이다.
외부 자극(산 또는 염기)에 대한 pH 변화의 폭이 작을수록 완충 효과가 좋다고 말할 수 있다. 그리고 이러한 완충 용액의 pH 방어 능력, 외부 자극에 저항하는 능력, 효과를 정량적으로 나타낸 것을 완충 용량(buffer capacity, β )이라 한다. 완충 용량이 큰 용액일수록 외부 산-염기 자극에 더 잘 저항하며, pH 변화가 적다.
완충용량이란, "완충 용액 1L 를 pH 1만큼 변화시키기 위해 필요한 강산 또는 강염기의 몰수"
완충 용량(β )은 다음과 같이 표현된다.

여기서 dCb는 완충 용액 1 L에 첨가된 강한 염기의 몰수이고, dCa는 완충 용액 1 L에 첨가된 강산의 몰수이다. 강산의 첨가는 용액의 pH를 낮추기 때문에(dpH < 0), 완충 용량 식에 음의 부호를 붙여 식을 정의하면, 결과적으로 완충 용량은 언제나 양의 값으로 표현될 수 있다.
* 위의 [1-나]의 0.1 M 아세트산/아세트산 이온 완충 용액의 예시로 완충 용량을 계산해 보자. 완충 용액 10 mL에 0.1 mmol의 산이 첨가되었으므로, 1 L의 완충 용액에 0.01 mol의 H+가 첨가된 것과 같다.(dCa = 0.1/10 = 0.01) 이때, pH 변화는 -0.08 이므로, 완충 용량 β = 0.01/0.08 = 0.125 이다.
3. 완충 용량에 영향을 주는 요인
완충 용량의 크기는 용액을 구성하는 '짝산-짝염기의 농도 비'와 구성 '짝산-짝염기의 전체(절대) 농도'에 의존한다. 용액의 완충 용량은 짝산/짝염기 농도비가 1에서 멀어질수록 급격하게 감소하기 때문에, 적절한 완충 용량을 갖는 용액을 제조하기 위해서는 선택한 약산의 pKa 값이 만들고자 하는 완충 용액 pH의 ±1 범위 안에 있는 것이 좋다.

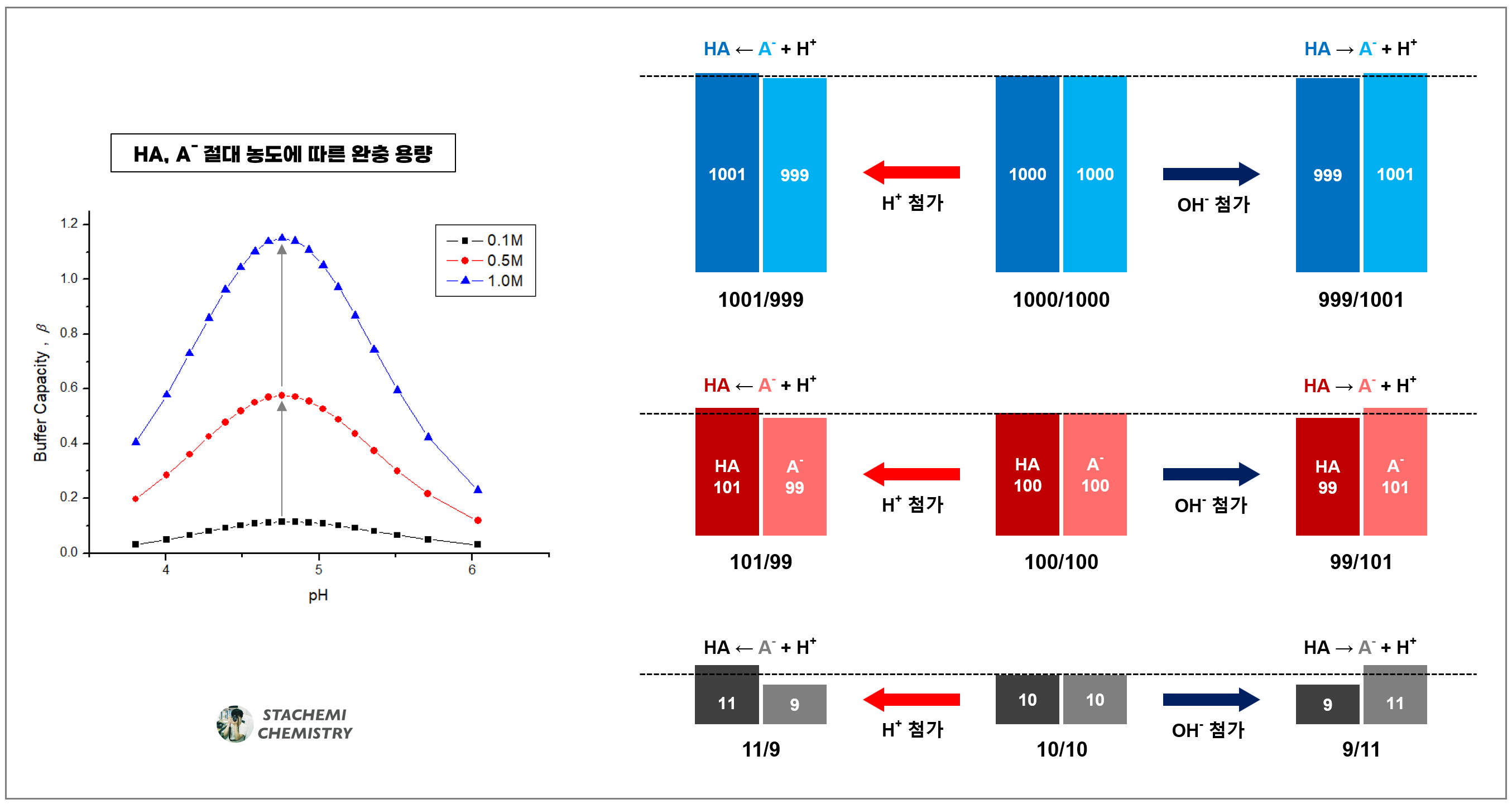
다음으로 완충 용량이 '구성 짝산-짝염기의 전체 농도'에 의존한다는 뜻은 짝산/짝염기 농도 비율이 같은 두 용액이 있을 때, 절대 농도 값이 진한 용액일수록 완충 효과가 크다는 뜻이다. 짝산/짝염기 농도비가 똑같이 1 : 1인 용액이라도, 용액 내 짝산과 짝염기의 농도가 각각 0.1 M인 용액보다는 각각 1.0 M, 2.0 M 용액의 완충 효과가 더 크다는 뜻이다.
가. 짝산-짝염기 비율
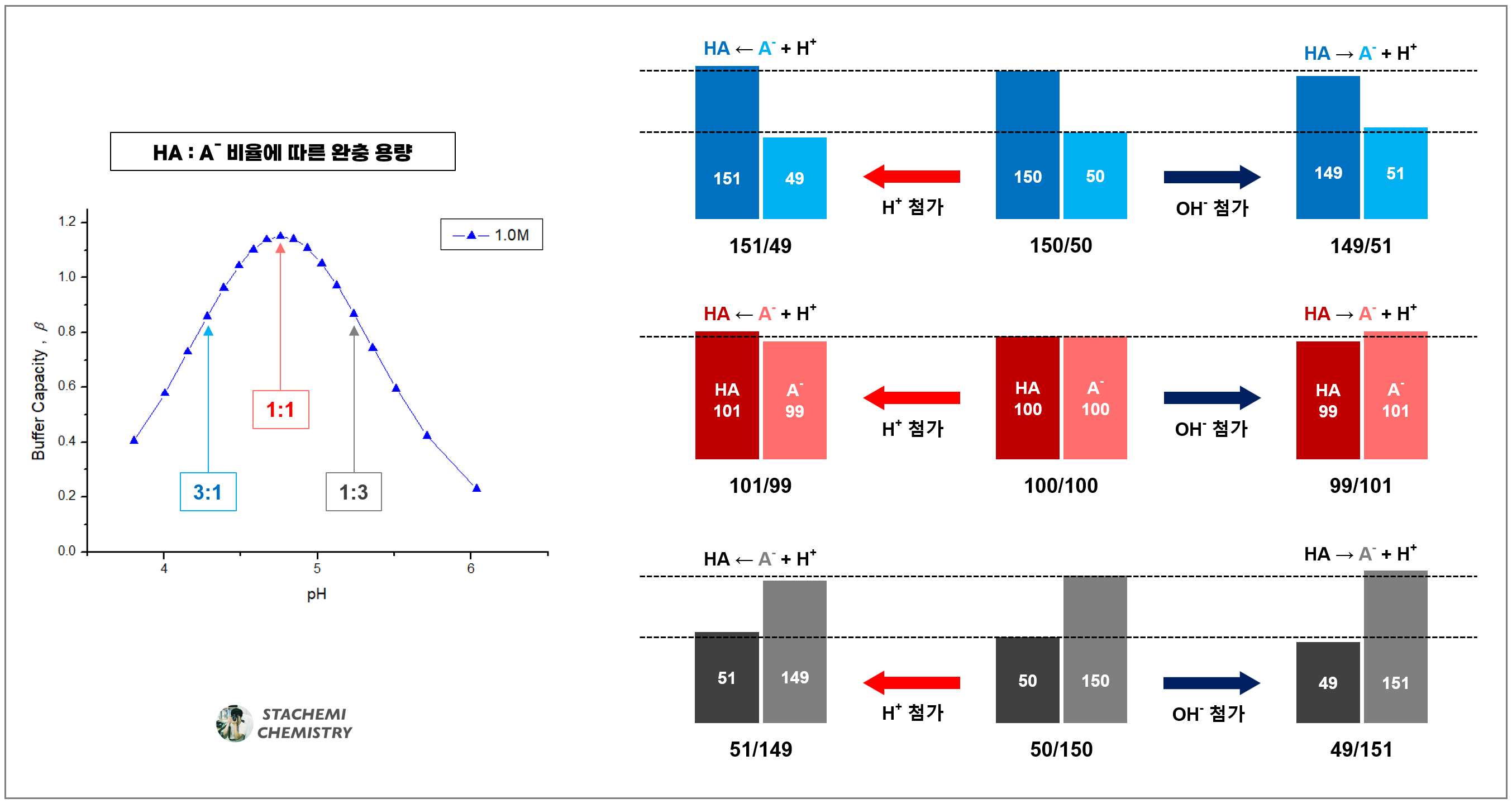
약산과 그 약산의 짝염기를 같은 농도가 되게 첨가하여 만드는 것이 완충 용액 제조에 유리함을 지속적으로 언급했다. 정말, 초기 용액의 약산과 짝염기 비율이 완충 효과에 어떤 차이를 가져오는지를 직접 확인해 보고자 한다.
아세트산(CH3COOH, 이하 HA)과 아세트산 이온(CH3COO-,이하 A-)의 비율을 달리 한 완충 용액 A ~ E 용액 100 mL를 만들자. 비율은 달리하되, HA와 A- 합이 20 mmol이 되도록 하여 절대 농도는 모두 같게 맞춰 주었다.
용액 A = 1:9 , 용액 B = 1:3 , 용액 C = 1:1 , 용액 D = 3:1 , 용액 E = 9:1
다섯 용액의 초기 pH 값을 계산해 보면, 5.704에서 3.796의 분포를 갖는다. 용액의 초기 pH는 헨더슨 하셀바흐 식의 pKa 값과 용액 내 초기 짝산과 짝염기 비율에 의해 결정되는 값이기에 5.704에서부터 3.796에 걸쳐 다른 값을 갖는다. 비율이 1:1인 용액 C의 초기 pH는 pKa와 같은 4.75를 갖는다.

다섯 용액에 모두 똑같이 1 mmol H+ 이온을 가했을 때의 용액에서 일어나는 변화를 비교해 보자. <표 1>

산 첨가에 따라 용액 내 짝염기인 A-는 첨가된 H+ 이온 1 mmol과 즉각 반응하여 1 mmol의 HA를 생성한다. 용액 내 HA와 A-의 몰수가 달라지고, 짝산/짝염기 농도 비율이 달라지게 되면서 헨더슨-하셀바흐 식의 log([A-]/[HA]) 항이 변화하고, 그만큼 pH는 감소한다.

pH 변화 폭은 '초기 짝산/짝염기 비율'에 따라 차이가 있으며, 초기 비율이 1 :1인 C 용액을 기준(중앙의 pH=4.75 용액)으로 하여, 농도 비가 1:1에서부터 멀어질수록 산첨가 이후 짝산/짝염기 비율이 초기 값에서 벗어나는 정도가 커지고, 자연스레 pH 변화폭도 커진다.
또한, 초기에 짝산 HA의 비율이 짝염기인 A-의 비율보다 많은 완충 용액 A, B의 경우가 그 반대의 경우인 D, E 용액에 비해 H+ 첨가에 대한 완충 용량이 적게 나타남도 알 수 있다. 반대로 염기를 첨가했다면, D, E의 완충 용량보다 A, B 용액의 완충 용량이 크게 나타났을 것이다.
나. 짝산-짝염기의 절대 농도
짝산과 짝염기의 비율이 같은 완충 용액을 만들어도, 완충 효과 차이를 가질 수 있다. 완충 효과는 완충 용액 내 짝산-짝염기의 절대 농도에 의해 달라진다. 앞선 C 용액과 똑같은 1:1 비율을 가지면서, 동시에 절대 농도 차이가 있는 두 용액을 생각해 보자. F 용액은 C 보다 절대 농도가 10배 진하고, G 용액은 100배 진하다.
세 용액 모두 짝산-짝염기 비율이 1:1이므로, 초기 pH는 4.75로 모두 같다. 이제, 똑같이 세 용액에 H+ 1 mmol을 가했을 때의 변화를 비교해 보자. <표 2>
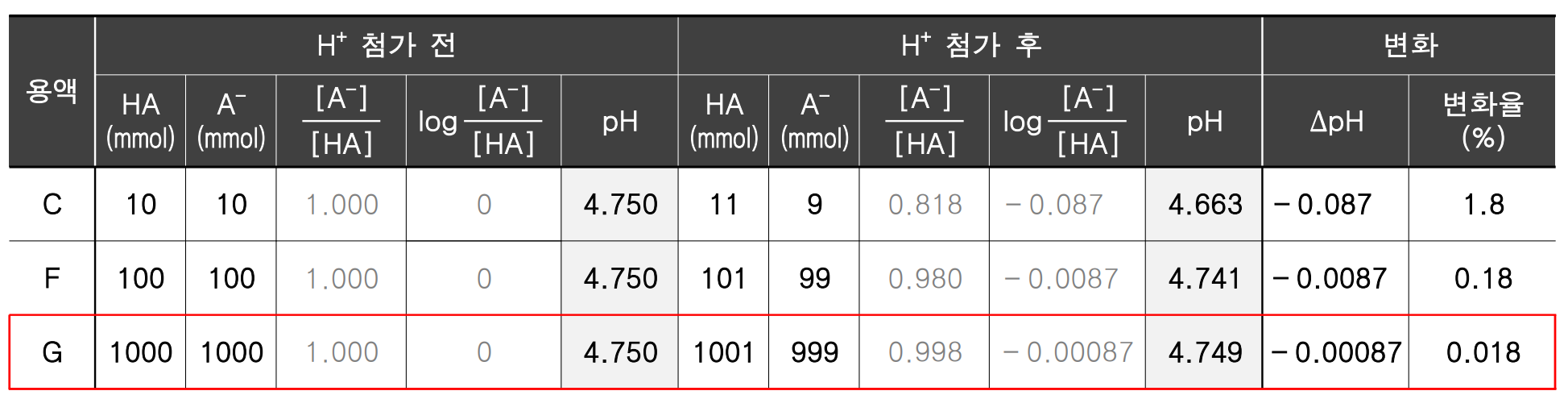
같은 양의 H+ 1 mmol이 첨가된 이후 짝산 HA와 짝염기 A-의 농도 비는 11 : 9 , 101 : 99, 1001 : 999가 되며, 이를 [A-]/[HA] 형태로 나타내면, C = 0.818, F = 0.980, G = 0.998로 절대 농도가 점점 진해질수록, 산 첨가 이후에도 농도 비가 1에 가깝게 유지되는 것을 확인할 수 있다.
그 결과, 절대 농도 값에 따라 H+ 첨가 이후 pH는 C= 4.663, F = 4.741 , G = 4.749이 되었고, 초기 pH인 4.75로부터의 % 변화율로 비교하면 C = 1.8 %, F = 0.18 %, G = 0.018 %만 감소했음을 알 수 있다.
3. 마치며,
완충 용액이란, 외부 산 또는 염기에 의한 pH가 최소화되는 용액으로, 짝산-짝염기의 비율이 1:1이고, 절대 농도가 진할수록 완충 용량이 커진다. 완충 효과 및 완충 용량에 관련된 주요 내용을 정리하여 나타내면 다음과 같다.
- 완충계의 절대 농도(짝산과 짝염기의 농도 합)가 진할수록 완충 용량은 커진다.
- 완충 용액을 구성하는 짝산과 짝염기의 농도 비가 1:1일 때, 완충 용량은 최대가 된다.
- 완충 용액의 짝산/짝염기 농도 비가 초기 1:1에서 점차 벗어날수록 완충 용량은 급격하게 감소한다.
- 완충 용액을 구성하는 짝산이 짝염기보다 많은 경우(HA > A-), 염기 첨가에 대한 완충 용량이 산 첨가에 대한 완충 용량보다 크다.
- 반대로 짝산보다 짝염기 비율이 높은 경우(HA < A-)에는, 산 첨가에 대한 완충 용량이 염기 첨가에 대한 완충 용량보다 크게 나타난다.
- (bonus) 약산(HA)과 강염기(OH-) 중화 적정 과정에서 반당량점 지점은 완충 효과가 가장 크게 나타나는 지점이며, 염기 첨가에 따른 pH 변화율(증가율)이 가장 작은 지점이다.
용액의 완충 효과를 높이는 방법(feat. 완충 용량)
- 끝 -
* 끝까지 읽어주셔서 감사합니다.


