2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (11번~20번)
2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (11번~20번)

답: ② ㄴ
풀이:
ㄱ. 원소 기호는 모두 X로 동일하지만, 질량수는 a, b, c로 다르다. 양성자의 개수는 모두 같지만, 중성자의 개수 차이에 의해 질량수 차이가 발생한다. 중성자 개수는 a < b < c 이며, 동일 원소 기준 질량수가 클수록 원자량(u)도 크다. 따라서 원자 질량은 x < y < z 이다. (거짓)
ㄴ. X의 평균 원자량은 각 원자의 질량과 존재비의 곱으로 나타낼 수 있다. p + q + r = 100이므로, p, q, r 각각은 퍼센트 비율에 해당한다. X의 평균 원자량은 다음과 같이 나타낼 수 있다. (참)
평균 원자량 = (xp + yq + zr)/100
ㄷ. 원자량이 작을수록, 원자 1개 질량이 가벼울수록 1 g을 채우는데 필요한 알맹이 수는 많아진다. 따라서 1 g 당 원자 수는 질량수가 작을수록 크다. a > b > c 이다. (거짓)

답: ① ㄱ
풀이:
ㄱ. ΔH ˚ = ΔU ˚ + Δ(PV )이다. 일정 온도 조건에서 반응 전후 Δ(PV ) 값은 반응 전후 ΔnRT 로 예상할 수 있다. 반응 후 기체 입자수가 전보다 감소하므로, Δ(PV ) < 0 이고, ΔU ˚ > ΔH ˚ 보다 크다고 판단할 수 있다. (참)
ㄴ. H2O(액체)의 기화 엔탈피는 두 번째 식(ΔH ˚ = c )에서 첫 번째 식(ΔH ˚ = a)을 뺀 뒤, 2로 나누면 구할 수 있다. (거짓)

ㄷ. H2O(액체)의 표준 생성 엔탈피는 수증기 생성 반응식(세 번째 식/2, ΔH ˚ = d/2)과 수증기의 액화 반응식(보기 ㄴ H2O(액체) 기화 반응의 역반응, ΔH ˚ = - (c - a)/2)을 더해서 구할 수 있다. (거짓)


답: ④ ㄱ, ㄴ
풀이:
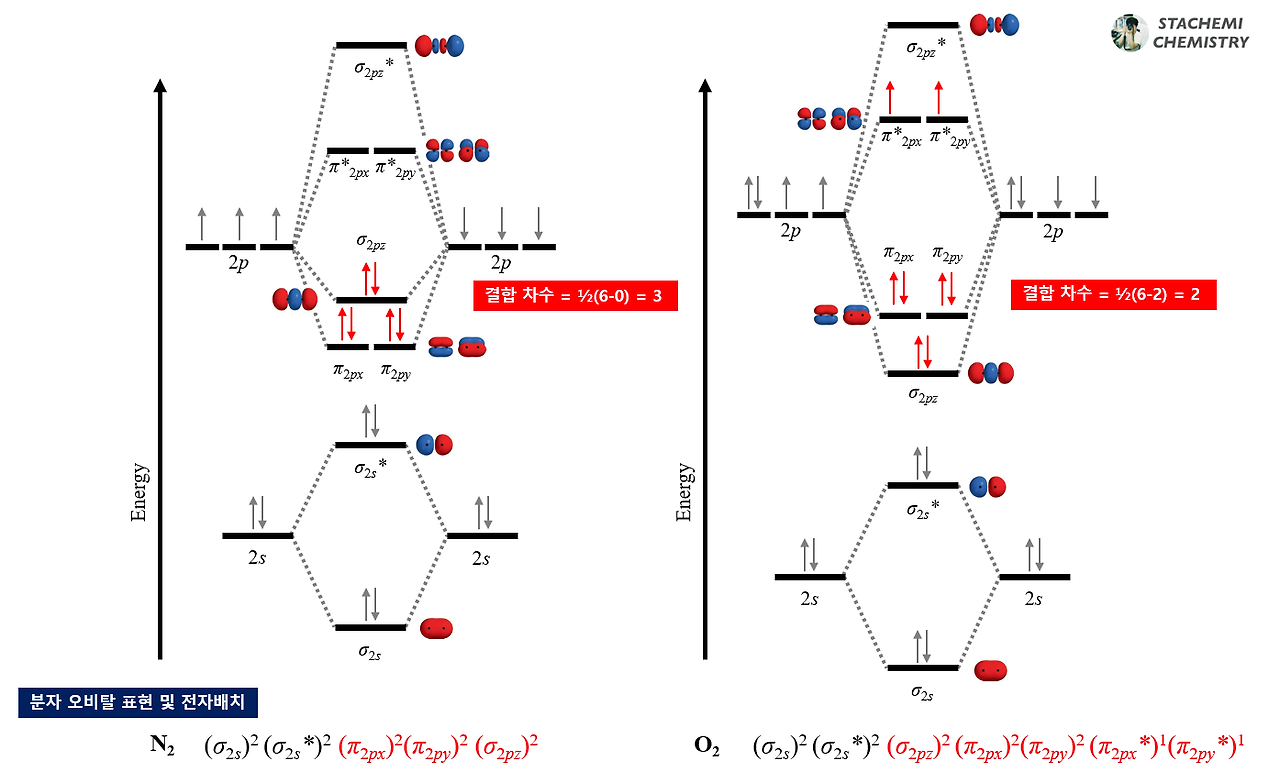
σ2p에 채워진 전자수는 N2와 O2가 모두 2개씩으로 같다. 반면, C2는 σ2p에 전자가 채워지지 않는다. 따라서 Y는 탄소(C)임을 알 수 있으며, Y2는 C2이다. 자연스럽게 X와 Z는 질소(N)와 산소(O) 중 하나에 해당하며, XZ는 NO이다.

두번째 제시문에서 π2p*의 홀전자수/π2p전자수의 값이 X2 > NO 이라고 되어 있으므로, 전자 배치를 바탕으로 크기를 비교해보자.
N2는 π2p*에 채워지는 전자가 없기에 값은 0이며, O2는 π2p*에 채워진 홀전자 2개, π2p에 채워진 전자수는 4개로 2/4 = 0.5이다.
반면, NO는 π2p*의 홀전자수 1개, π2p에 채워진 전자수 4개로 1/4=0.25 이다. 따라서 X2 = O2 이며, X = 산소(O), Z = 질소(N) 이다.
ㄱ. NO는 반결합성궤도함수 π2p*에 홀전자를 1개 가지며, 상자성임을 알 수 있다. (참)
ㄴ. C2에서 전자 배치는 N2와 유사한 순서로 채워지며, 가장 높은 에너지 준위의 오비탈은 π2p 이다. (참)
ㄷ. N2(Z2)의 결합 차수 = 3, N2+의 결합차수 = 2.5, O2(X2)의 결합 차수 = 2, O2+의 결합 차수 = 2.5이다. 따라서 보기의 크기 비교는 반대로 되었다. (거짓)
(N2) 2.5/3 < 2.5/2 (O2)
[참고] 동핵 이원자 분자의 오비탈 https://stachemi.tistory.com/216
동핵 이원자 분자의 오비탈 (2) MO 상관 도표
* 본문은 다음 글과 연결됩니다. [이전 글] 215. 동핵 이원자 분자의 오비탈 (1) σ오비탈, π 오비탈의 형성 동핵 이원자 분자의 오비탈 (1) σ 오비탈과 π 오비탈의 형성 동핵 이원자 분자 오비탈 (1)
stachemi.tistory.com

답: ⑦ ㄱ, ㄴ, ㄷ
풀이:
전체 반응 차수 m + n = 3이므로, 주어진 반응은 3차 반응이다. 제시된 반응 메커니즘의 단계별 빠르기를 통해 속도 결정 단계는 2단계임을 알 수 있다.
따라서 속도식은 d[C]/dt = rate = k[B][P] 이며, P의 농도는 단계 1에서 빠르게 평형에 도달하므로, 사전 평형 근사(PEA)를 통해 근사하면, 단계 1의 평형 상수 K = [P]/(가) 의 관계를 만족하고, [P] = K(가)로 표현할 수 있다.
이를 대입하여 전체 반응식을 나타내면, rate = v = k*K*[B]*(가) 이다.
ㄱ. 전체 반응 차수 3을 만족하기 위해서는 단계 1은 반드시 A를 포함한 2차 반응이어야 하며, A + B 또는 2A가 될 수 있다. (참)
* 만약, (가)가 A + B 이면, (나)는 A + Q이고, 반응 속도식 v = k*K[A][B]2가 되며, (가)가 2A이면, (나)는 B + Q이고, 반응 속도식 v = k*K[A]2[B] 가 된다.
ㄴ. 반응 중간에 생성되었지만, 이후 단계에서 소모되어 전체 반응식에 나타나지 않는 화학종을 반응 중간체(intermediate)라 한다. 반응 중간체는 P, Q 2가지이다. (참)
ㄷ. 만약, m = 1이라면, 전체 속도식에서 [A]에 대한 1차, [B]에 대한 2차 반응이다. 따라서 단계 1의 반응 (가)에는 A에 대한 1차, B에 대한 1차 반응이어야 하며, 전체 반응식의 계수 관계에 비추어 보았을 때, 단계 3의 (나)는 A + Q가 된다. (참)

답: ⑥ ㄴ, ㄷ
풀이:
ㄱ. 단위 세포 내 입자수를 알아보자. 산소 이온(●)은 꼭짓점(1/8)에 8개, 단위 세포 중심(1)에 1개 있으며, 총 2개의 입자가 존재한다. 구리 이온(○)은 단위 세포 중심(1)에 4개 있으며, 총 4개 입자가 존재한다. 즉, Cu와 O의 개수비는 2:1이며, 화학식은 Cu2O이다. 따라서 Cu의 산화수는 +1이다. (거짓)
ㄴ. 산소 이온(●)의 배열은 체심 입방 구조이다. (참)
ㄷ. 구리 이온(○)은 면심 입방 구조를 하고 있다. 따라서 구리 이온 주위 가장 가까운 구리 이온의 개수(면심 입방 구조의 배위수)는 12개이다. (참)
답: ① ㄱ
풀이:
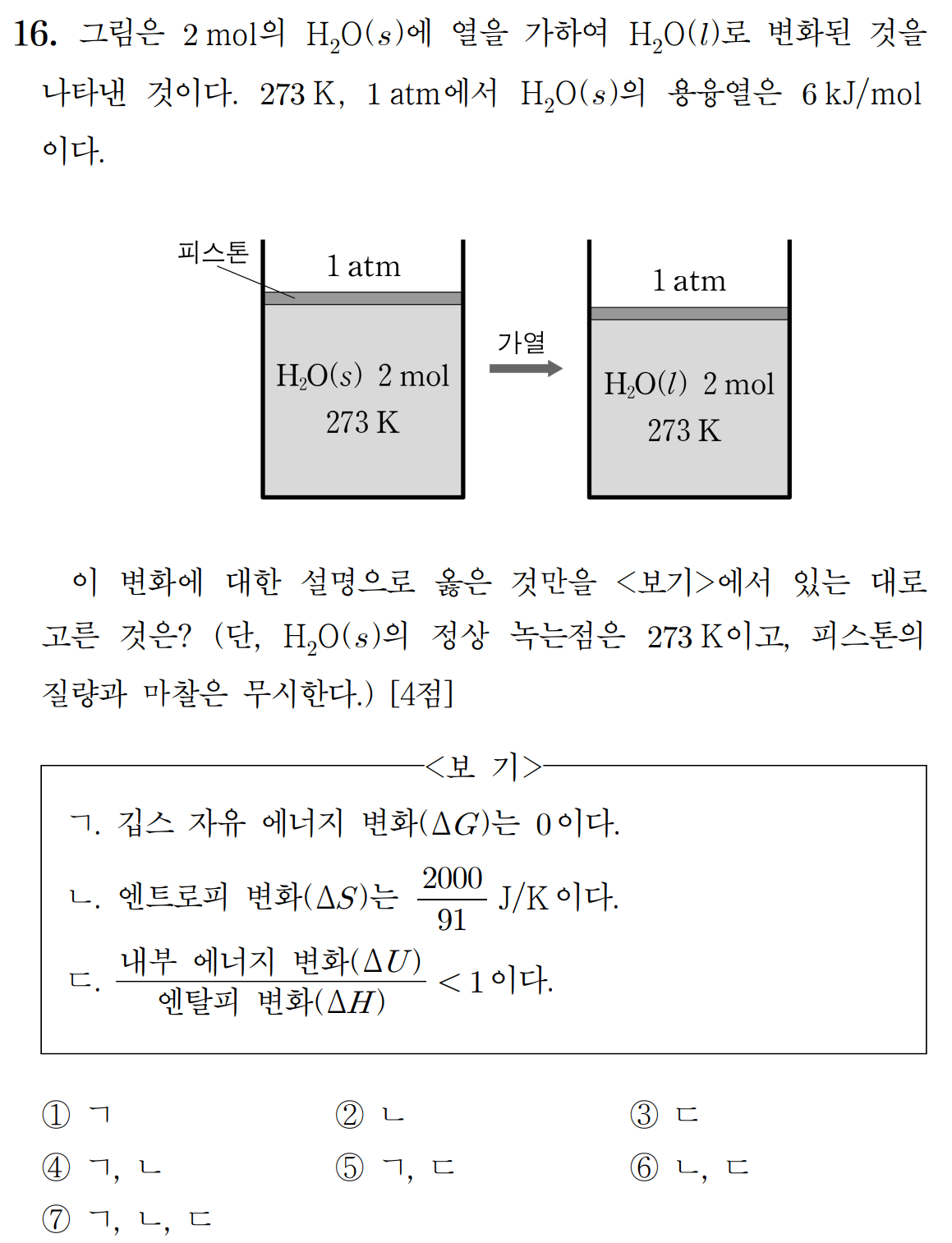
ㄱ. 273 K은 H2O의 정상 녹는점이므로, 액체상과 고체상의 깁스 자유에너지의 크기가 같다. (참)
ㄴ. 일정 압력에서 2몰 H2O(액체)와 H2O(고체) 사이의 엔탈피 차이(ΔH)는 6 [kJ/mol] * 2 [mol] = 12kJ이다. 273 K은 H2O(액체)와 H2O(고체)의 깁스 자유에너지 크기가 같은 정상 녹는점이므로, 해당 변화의 ΔG = 0 이다. 이를 바탕으로 엔트로피 변화(ΔS )를 구하면,
ΔG = 0, ΔH = 12 kJ, T = 273 K 이므로, ΔG = ΔH - TΔS , ΔS = ΔH/T
ΔS = 12000 J / 273 K = 4000/91 [J/K] 이다. (거짓)
ㄷ. ΔH = ΔU + Δ(PV ) 이므로, 일정 압력 조건에서 V가 감소했으며 Δ(PV ) < 0 이고, ΔU > ΔH 이다. (거짓)

답: ⑦ ㄱ, ㄴ, ㄷ
풀이:
그림 (가)는 HA 0.5 L와 B- 0.5 L의 혼합 용액으로 전체 부피는 1 L가 된다. 즉, (가)에서 HA 농도는 1.1 M, B- 농도는 0.1 M이 된다. 혼합된 HA와 B-는 주어진 평형 반응을 만족하며, 평형상수 K 는 103이다.
* 문제 조건에서 전체 부피가 1 L로 고정되어 있으므로, 몰농도와 용액 내 이온의 mol 수를 똑같이 취급할 수 있다.
ㄱ. 평형 상수 값을 통해 반응의 평형은 생성물 쪽에 치우쳐 있음을 예상할 수 있으며, (가)의 초기 B-는 거의 모두 HB로 전환될 것이다.

(가)의 pH = 3이므로, 용액 내 수소 이온의 농도 [H+] = 10-3 M 이며, 평형 상태에서의 짝산/짝염기의 비율 [A-]/[HA] = 1/10 이다. 헨더슨-하셀바흐 식을 통해 HA의 pKa 값을 계산하면, HA의 Ka = 10-4 이다. (참)
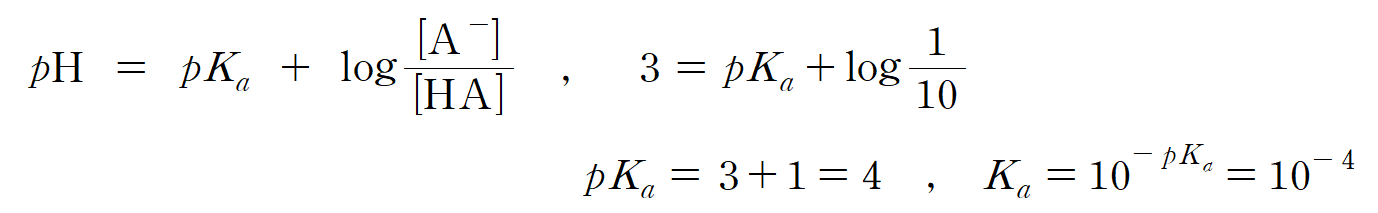
ㄴ. (가)의 평형에서의 HA, B-, A-, HB는 평형상수 K = 103을 만족해야 한다. [HA]와 [A-]의 농도비가 1/10이므로, 평형상수 식을 통해 아래와 같이 [B-]/[HB] 값을 구할 수 있다. (참)
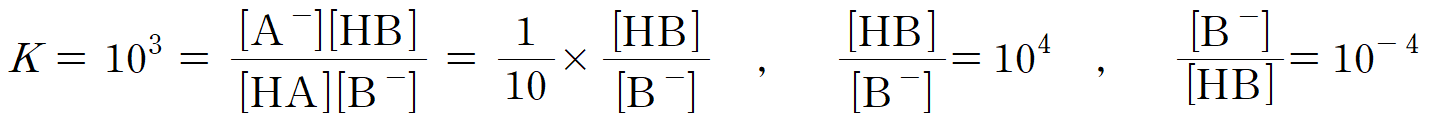
ㄷ. HA의 산 이온 상수(pKa = 4)와 (가) 용액내 존재하는 HA의 몰수(1 mol), A- 이온의 몰수(0.1 mol)를 알고 있는 상황이다. (나) 용액의 pH가 4이므로, HA의 pKa = pH 이며, NaOH x mol 첨가 이후, (나) 용액내 존재하는 HA와 A-의 몰수가 같아졌음을 뜻한다.
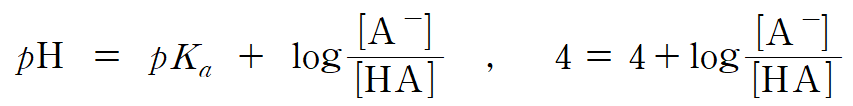
(가)의 HA는 1 mol에서 첨가된 NaOH x mol 만큼 소모되고, A-는 0.1 mol에서 x mol만큼 양이 늘어난다. 0.1 + x = 1 - x 이므로, x = 0.45 이다. (참)
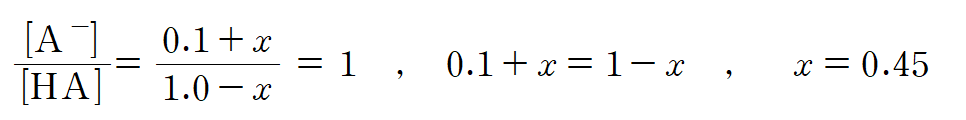
답: ③ ㄷ
풀이:
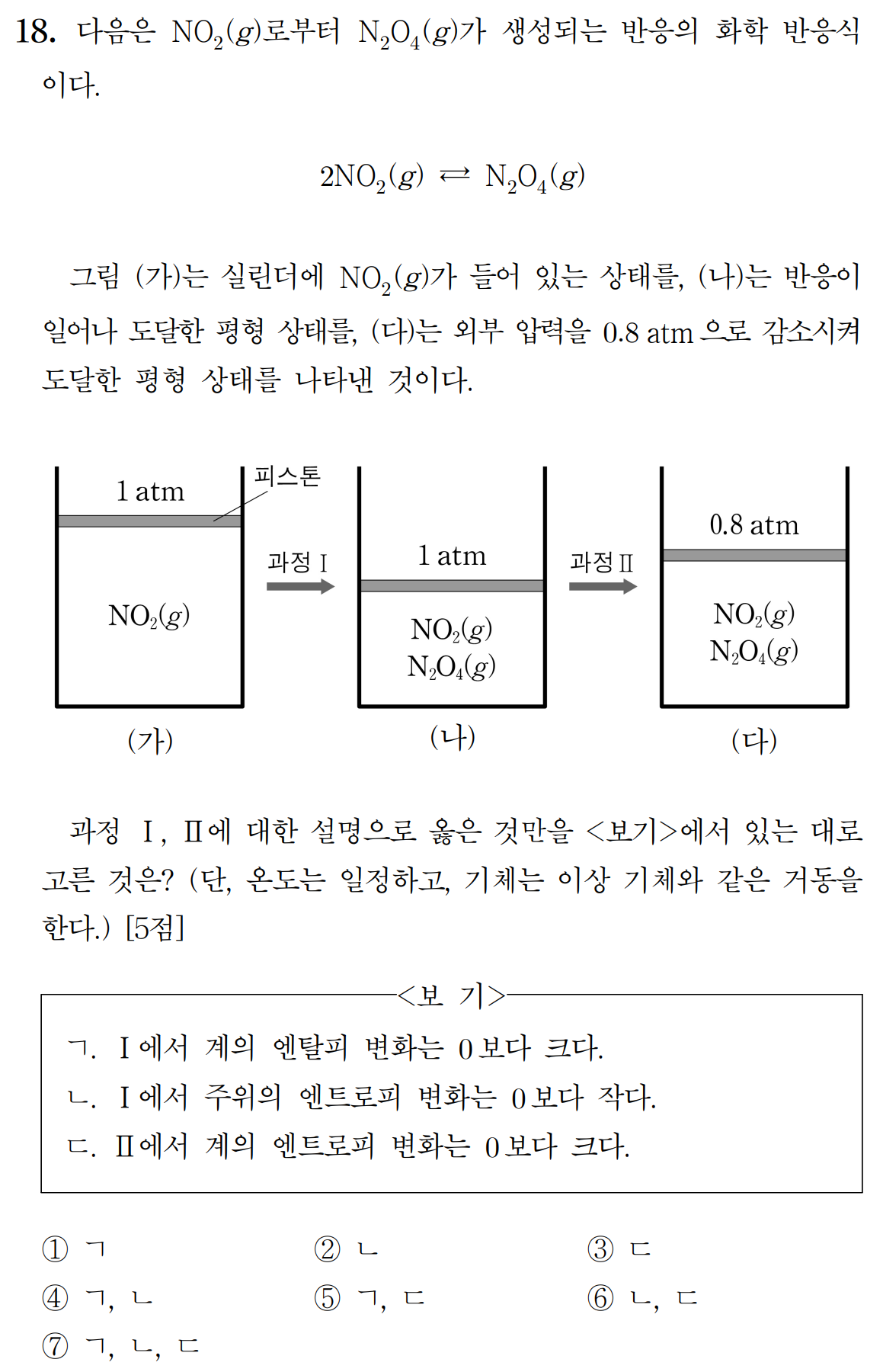
그림 (가)는 초기 상태, 그림 (나)는 첫번째 평형 상태이다. 그림 (다)는 외부압이 변했을 때, 도달한 새로운 평형 상태이다. 세 과정에서 온도는 일정하게 유지되고 있다.
ㄱ. 과정Ⅰ은 일정 압력 조건에서 (가)의 초기 상태에서 (나)의 평형 상태로의 변화이다. ΔG < 0 이며, 이 과정에서 전체 입자수는 줄어들며, 엔트로피(S)는 감소한다.(ΔS < 0) 이러한 반응이 자발적으로 일어나기 위해서는 엔탈피 변화에서 이득이 있어야 하며, ΔH < 0인 발열 반응이다. (거짓)
ㄴ. 과정Ⅰ은 계의 엔탈피가 감소하는 발열 반응(Q > 0)이다. 즉, 일정 압력 조건에서 주위는 열(Q)을 흡수하며, 주위의 엔탈피 변화 ΔS주위 = Q주위/T > 0 이다. (거짓)
ㄷ. 과정Ⅱ에서는 외부 압력이 줄어들었으며, 이에 역반응이 우세해진다. 역반응은 기체 입자 수가 증가하는 반응이며, 흡열 반응(ΔH > 0)이다. 계의 엔트로피는 증가(ΔS > 0)한다. (참)
[참고] 반응의 자발성과 자유에너지 https://stachemi.tistory.com/297
반응의 자발성과 자유에너지
1. 저절로 일어나는 반응 기체는 진공 쪽으로 팽창하지만, 이미 퍼져나간 기체가 저절로 한쪽 방향으로 모여 압축되지는 않는다. 물에 풀어놓은 잉크 한 방울이 점차 퍼져나가는 것은 자연스럽
stachemi.tistory.com

답: ③ ㄷ
풀이:
농도차 전지이다. 염다리를 기준으로 왼쪽 반쪽 전지(0.1 M)가 농도가 묽으며, 오른쪽 반쪽 전지(1.0 M)가 농도가 진하다. 농도차 전지에서 전지 반응은 양쪽 반쪽 전지의 농도가 같아질 때까지 진행된다.
즉, 농도가 진한 오른쪽 전지에서는 아연 이온의 환원이, 농도가 묽은 왼쪽 전지에서는 아연 금속의 산화가 진행된다. 왼쪽이 산화 전극, 오른쪽이 환원 전극이 되겠다. (사실, 전지의 선표시법에서 왼쪽이 산화전극, 오른쪽이 환원전극으로 표시하기 때문에 굳이 위와 같이 따져주지 않아도 바로 알 수 있는 부분이긴 하다.)
ㄱ. 산화 전극과 환원 전극은 모두 Zn/Zn2+ 반쪽 전지로 이루어져 있기 때문에 표준 전지 전위 E ˚ = 0.00 V 이다. 전지 반응에 관여한 전자수 n = 2 이며, 네른스트 식을 통해 농도차 전지의 전위를 구해보면 E = 0.03 V이다. (거짓)
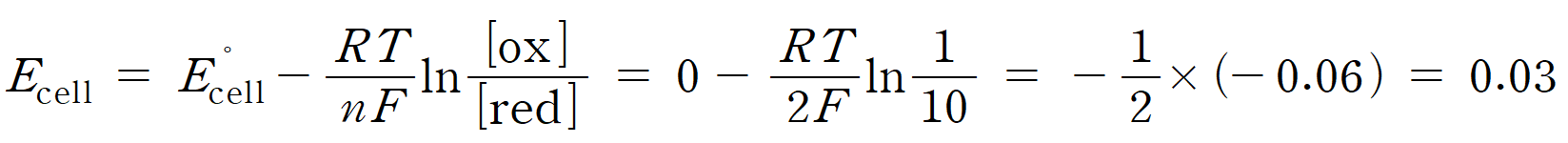
ㄴ. 두 용액의 농도가 같아져 전지 반응이 더이상 일어나지 않게 되는 농도는 0.55 M이다. 즉, 0.2 M의 농도가 될 수 있는 반쪽 전지는 산화 전극의 반쪽 전지(농도가 묽은)이다. 즉, 산화 전극의 농도가 0.2 M이 되었을 때까지 관여한 전자의 양을 계산해야 한다.
산화 전극 초기 Zn2+ 이온의 양은 0.1 M * 100 mL = 10 mmol이며, 용액 부피가 일정한 상황에서 농도가 0.2 M이 되었다는 것은 산화 전극 용액 내 Zn2+의 양이 20 mmol이 되었음을 말한다. 즉, 전지 반응이 진행됨에 따라 반응(Zn → Zn2+ + 2e-)에 관여한 Zn의 몰수는 10 mmol이다.
Zn의 산화 반응에서 한 번에 전자 2 개가 관여하므로, 총 관여한 전자수는 10 mmol * 2 = 20 mmol이다. 페러데이 상수가 f [C/mol] 이고, 전하량은 b [C] 이므로, b = 0.02f 이다. (거짓)
ㄷ. 전지가 작동하는 동안 산화 전극에서 환원 전극 쪽으로 전자가 이동한다. 따라서 왼쪽 반쪽 전지(산화 전극)에서 오른쪽 반쪽 전지(환원 전극)쪽으로 전자가 이동한다. (참)

답: ④ ㄱ, ㄴ
풀이:
20번 풀이에 대해서는 확신은 없다. 리간드의 분광화학적 계열(착물의 d-오비탈 갈라짐 크기)에 영향을 주는 요소는 다양하고, 금속 원소의 종류, 산화수 등에 따라 강한장 또는 약한장으로 작용할 수 있다고는 하지만,
일반적으로 CN- 는 강한장 리간드로 분류되고, H2O의 경우 상황에 따라 다르다. 해당 문제의 H2O를 CN- 리간드와 대비되어 금속 원소 종류와 금속 산화수에 무관하게 약한장이라 가정하여 푼다면 마땅한 답이 보이지 않는다.
그래서 아래와 같은 풀이를 작성하였다. (문제에 문제가 있는 것은 아닌데, 굳이 H2O가 강한장, 약한장으로 작용하는 경우의 수를 다 생각하게끔 하는 것이 어떤 출제 의도를 담은 것인지 궁금할 뿐이다. 아니면, 다른 풀이법이 있는데, 내가 빠른 접근법을 찾지 못한 것일 수도 있다.)
금속 24Cr의 전자 배치는 4s23d4 , 25Mn의 전자 배치는 4s23d5 , 26Fe의 전자 배치는 4s23d5 , 27Co의 전자 배치는 4s23d6 이다.
착이온 (가), (나)의 금속 이온 A의 전하는 모두 A2+이다. (가)와 (나)에서는 모두 금속 이온과 전하가 같으므로 d-오비탈의 전자수는 같다.
따라서 값의 차이는 d-오비탈 내 홀전자 수에만 의존한다. 강한장 CN- 리간드에 의한 (나)의 홀전자 수가 약한장 리간드 H2O에 의한 (가)보다 2개 작다는 뜻이다. 약한장에서 강한장으로 변할 때, 홀전자 수가 2개 줄어드는 것은 d4(Cr2+)와 d7(Co2+) 경우 뿐이다.
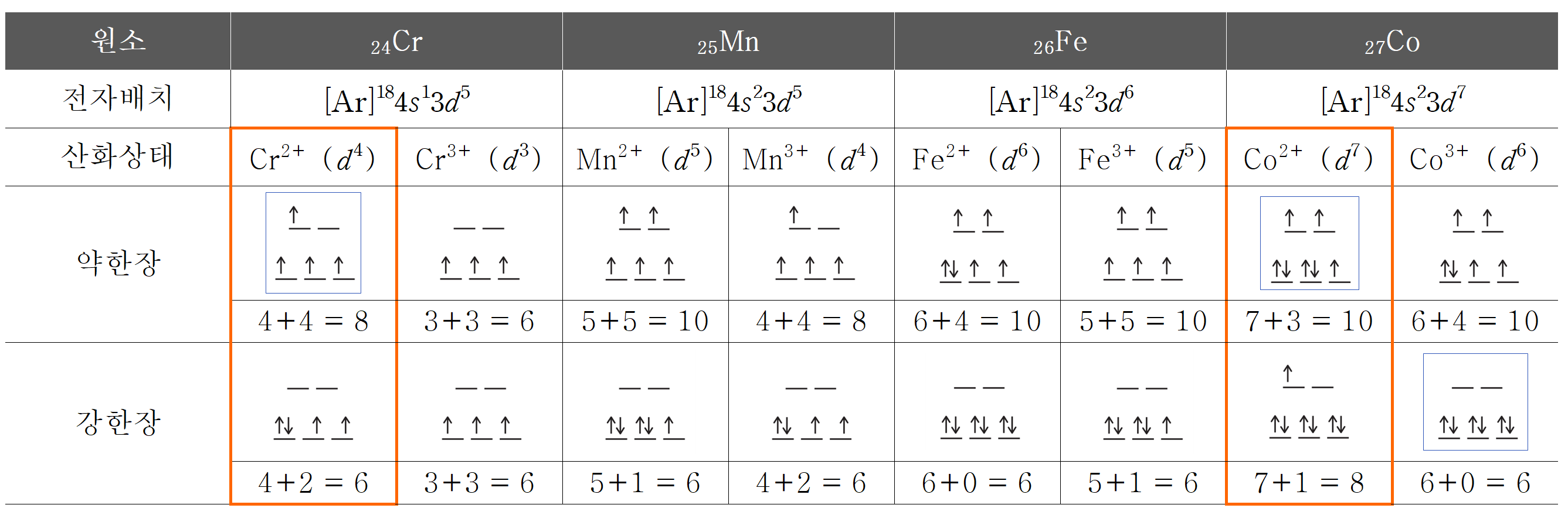
(다)에서 금속 이온 A의 산화수는 +3이다. 표에서 착이온 (다)는 (나)보다 홀전자 수가 2개 더 줄어든다.
(나) = a - 2, (다) = a - 4 이므로,
금속의 산화수 2, 강한장 CN- 리간드 조합보다 (3d+홀전자) 수가 2개 더 줄어드는 것은 코발트(Co) 밖에 없다. Cr3+는 리간드 종류에 무관하게 모두 (3d + 홀전자) 수가 6개이므로, Cr2+와 강한장 리간드 조합과 모두 같다.
(가) Co2+ + 강한장 = 10
(나) Co2+ + 약한장 = 8
(다) Co3+ + 강한장 = 6
또한, A3+ 이온과 약한장 리간드 조합에서 a - 4 조건을 만족시키는 경우는 없다. 따라서 A는 코발트(Co)이고, Co3+와 결합한 H2O는 강한장으로 작용했음을 알 수 있다. a = 10 이다.
착이온 (라)의 금속 B의 산화수는 3이며, H2O와 만든 착이온의 (3d + 홀전자) 수는 (다)와 a - 4 = 6로 같다. 후보가 될 수 있는 금속은 Cr3+(강장, 약장), Mn3+(강장), Fe3+(강장)이다. 이를 바탕으로 보기의 문장을 풀어보면,
ㄱ. (가)의 Co2+의 전자 배치에서 홀전자 수는 3이다. (참)
ㄴ. A 금속에 해당하는 코발트(Co)는 금속 B 후보가 될 수 있는 Cr, Mn, Fe 보다 원자 번호가 크다. (참)
ㄷ. 착물 (다)의 eg에는 전자가 없다. (거짓)
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트하도록 하겠습니다. 위 문제의 출처는 http://www.kpeet.or.kr 한국약학교육협의회 사이트입니다.
[다음 글] 21번 ~ 25번 https://stachemi.tistory.com/323
2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (21번~25번)
2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (21번~25번) 이전 문항 풀이는 아래 링크를 이용해주세요.2023학년도 PEET [1번~10번] https://stachemi.tistory.com/3102023학년도 PEET [11번~20번] https://stachemi.t
stachemi.tistory.com
