2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (1번~10번)
2023학년도 PEET 화학추론(일반화학) 기출문제 풀이 (1번~10번)

답: ②
풀이:
1) X는 플루오린(9F), Y는 나트륨(11Na)이다. 주기율표의 왼쪽 아래로 갈수록 원자반지름이 커지며, 원자 반지름은 Na > F 이다. (거짓)
2) 제2 이온화 에너지는 두번째 전자를 떼어내는과정에서 필요한 에너지의 크기며, Na+ > Mg+ 이다. (참)
3) 같은 주기에서 원자가 전자가 느끼는 유효핵전하는 원자 번호가 증가할수록 커지며, Na < Mg 이다. (거짓)
4) Ne과 같은 전자 배치를 갖는 이온의 가려막기 효과는 모두 같으므로, 이온 반지름은 핵전하에 의해 결정된다. 따라서Mg2+ < F- 이다. (거짓)
5) 기체 상태 원자가 1개의 전자를 받아들일 때, 방출하는 에너지의 크기를 전자친화도(electron affinity)라 하며, 전자친화도는 주기율표 오른쪽 위로 갈수록 커지며, F > Na 이다. (거짓)

답: ⑤
풀이:
1) FNO는 AX2E1 굽은형 구조로, 극성 분자이다. (거짓)
2) NO2-는 FNO와 같은 굽은형 구조(α < 120˚)이며, N2O는 AX2로 직선형 구조(180˚)이다. (거짓)
3) 공유 전자쌍의 수는 FNO는 3쌍, N2O는 4쌍으로 FNO < N2O 이다. (거짓)
4) N2O에서 중심 원자 N의 형식 전하는 +1이다. (거짓)
5) 중심 원자의 혼성 오비탈에서 s 오비탈의 기여도가 커질수록 결합각이 증가한다. 중심 원자의 혼성 오비탈 s 성분이 가장 많은 것은 직선형의 N2O 이다. (참)
sp(180˚) > sp2(120˚) > sp3(109.5˚)
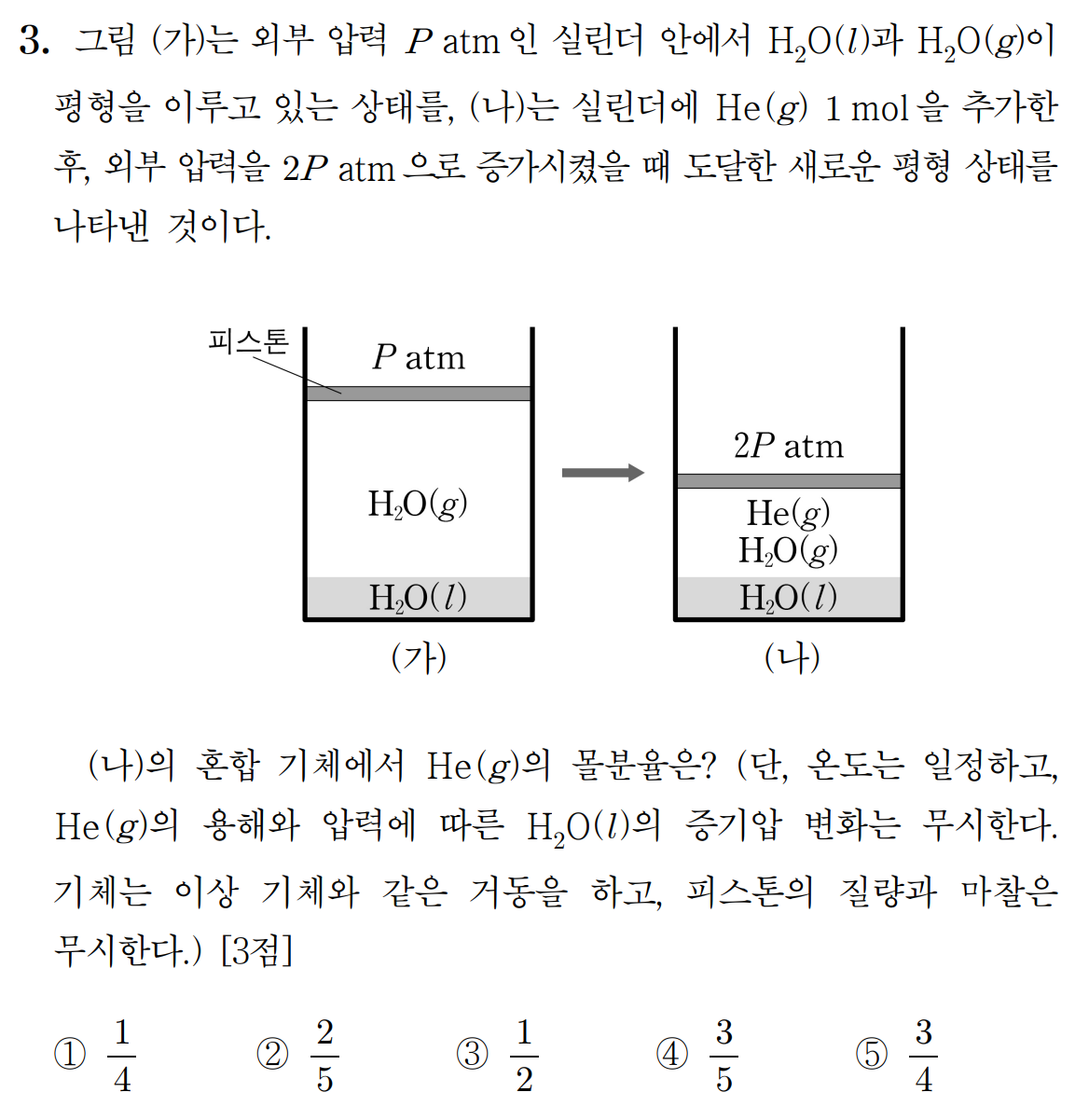
답: ③ 1/2
풀이:
(가)와 (나)의 온도가 일정하다. 따라서 H2O의 증기 압력은 일정하다. 주어진 온도에서 H2O의 증기압력은 P 이며, He 를 첨가해도 이는 변하지 않는다. 그런데, (나)에서 외부압 2P 와 평형을 유지하고 있으므로, 첨가한 He의 부분 압력은 P이다. He의 몰분율은 P/2P = 1/2 이다.

답: ⑤
풀이:
① 탄화수소 n = 2, 4, 6 중 하나이며, n = 4일 때만 a, b가 모두 정수인 균형 화학 반응식이 가능하다.
n = 2 , b = 1 , a = 3/2
n = 4 , b = 2 , a = 3
n = 6 , b = 3 , a = 7/2
화학 반응식은 다음과 같다. (참)
C2H4 + 3O2 → 2CO2 + 2H2O
② 탄화수소의 연소 과정의 생성물 질량 그래프에서 O2의 초기질량이 48 g일 때, 반응이 완결되었음을 알 수 있다. 48 g의 O2 는 1.5 mol에 해당한다.
O2 몰수 = 48 g * (1 mol/32 g) = 1.5 mol
O2 1.5 mol이 반응했을 때, 생성물은 모두 1 mol씩 얻어지며, 18 g이 1 mol에 해당하는 (나)는 H2O임을 알 수 있다. 자연스레 (가)는 CO2이다. (참)
③ 또한 반응물 C2H4와 O2 사이에 1 : 3의 몰비로 반응하므로, C2H4 x g = 0.5 mol에 해당하며, 반응한 x = 14이다. (참)
④ O2의 초기 질량이 24 g이라면, 24/32 = 0.75 mol에 해당하므로, 반응물 C2H4는 0.25 mol만 반응하고, 0.25 mol은 남는다. (참)
⑤ O2의 초기 질량이 60 g이라도, 한계 반응물은 14 g의 C2H4이므로, 완전 연소 후 생성되는 CO2의 양은 1 mol로 일정하다. (거짓)
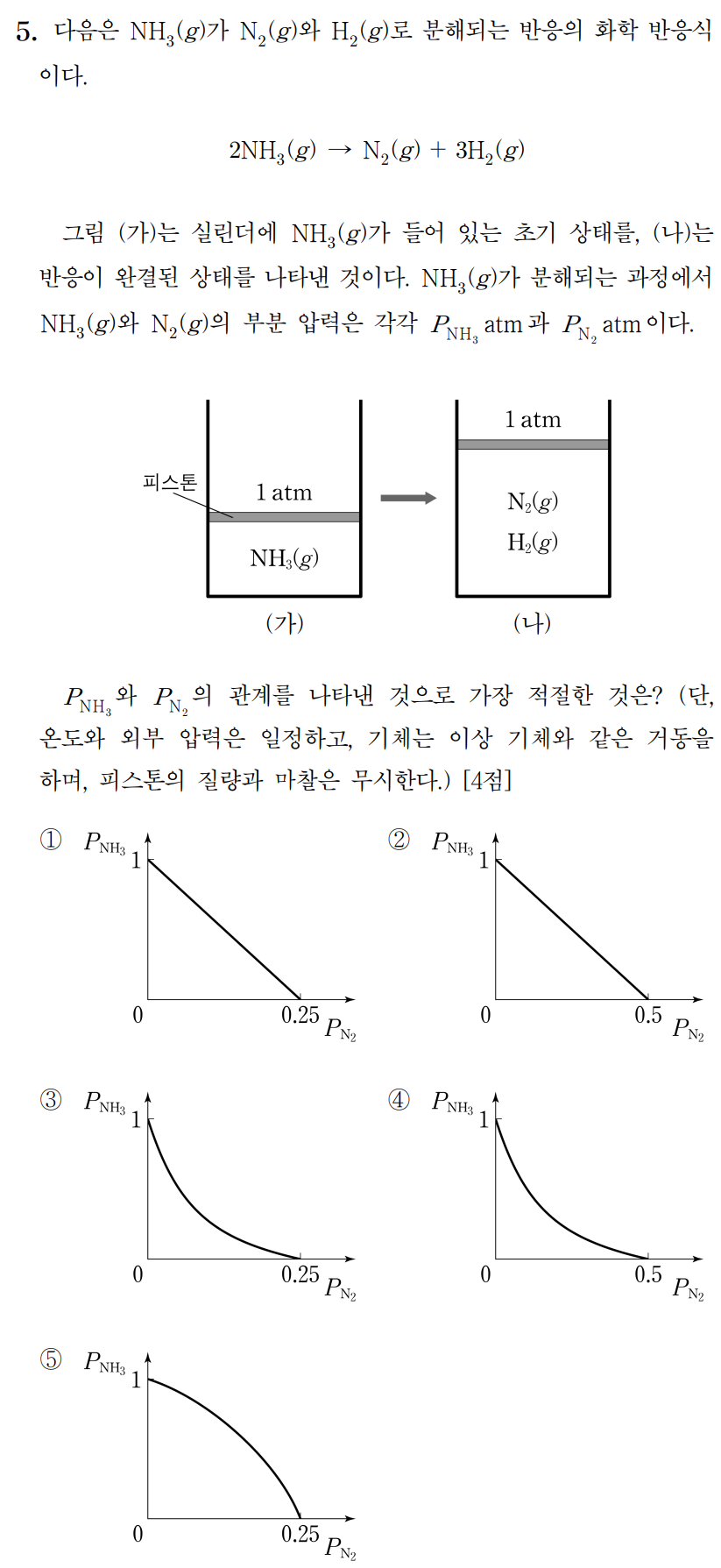
답: ①
풀이:
그림 (가)는 암모니아만 존재하는 반응 초기를 나타낸 것이며, 그림 (나)는 모든 암모니아가 수소와 질소로 분해된 반응 완결 이후이다.
외부 압력은 1 기압으로 변함없이 일정하고, 생성된 질소(N2)와 수소(H2)의 부분 압력 비(몰비)는 화학 반응식에 따라 언제나 1 : 3을 유지한다. 질소 기체의 압력을 x라 하면, 수소 기체의 압력은 3x이다. 그리고, 용기 내 암모니아의 압력을 y 라 한다면,
다음의 관계식을 만족한다.
y + x + 3x = 1 ,
y = - 4x + 1 이다. (①)

답: ④ 5/3
풀이:
두 용액의 퍼센트 농도(%)가 같다. X 용액은 54 g의 용매에 6 g이므로, 퍼센트 농도는 (6/60)*100 = 10 %이다. 용액 X와 Y의 퍼센트 농도는 10 %이다.
용질의 질량, 용매의 질량, 용질의 몰분율을 바탕으로, 용질의 몰질량을 구해보자.
용질 X의 몰수를 n [mol]이라 했을 때, H2O의 몰수는 54/18 = 3 [mol] 이다. 용질의 몰분율이 1/31 이므로, 식으로 나타내면 다음과 같다.
용질 몰수/전체 몰수 = n/(3+n) = 1/31 , n = 0.1
따라서, 6 [g]의 용질 X = 0.1 [mol], X의 몰질량은 60 [g/mol]이다.
X, Y 용액의 어는점 내림(ΔTf)은 용매의 어는점내름 상수(Kf)와 용액의 몰랄 농도(m)에 비례하는데, 두 용액의 퍼센트 농도가 같다고 했으므로, 용질의 질량(w = 6 g), 용매의 질량(W = 54 g)이 모두 같다고 생각할 수 있다.
ΔTf = - Kf * m = - Kf * (용질 몰수/용매 질량) = - Kf * (용질 질량 / (용질 몰질량*용매 질량))
위 식에서 용질 질량(w = 6 g)과 용매 질량(W = 54 g), 용매의 어는점내림 상수(Kf )가 모두 같으므로, 어는점 내림(ΔTf)은 (1/몰질량)에 비례한다.
Y 몰질량 = 100, X 몰질량 = 60 이므로,
X의 어는점 내림 / Y의 어는점 내림 = Y의 몰질량 / X의 몰질량 = 100/60 = 5/3 이다.

답: ① 1/22
풀이:
AgBr의 용해도곱 상수가 매우 작아, 이는 AgBr의 해리 반응의 평형은 모두 반응물 쪽에 (거의) 치우친다고 생각할 수 있다. 따라서 문제에서 주어진 0.4 M의 AgNO3 (aq) 5 mL + 0.4 M NaBr (aq) 5 mL의 (가) 조건은 AgBr (s) 2 mmol 이 존재하는 것처럼 취급할 수 있다.
(가)에 0.2 M Na2S2O3 (aq) 10 mL를 가한 것은 S2O3-2 이온이 2 mmol 첨가된 상황이다. 이를 바탕으로 ICE를 적용해보면,
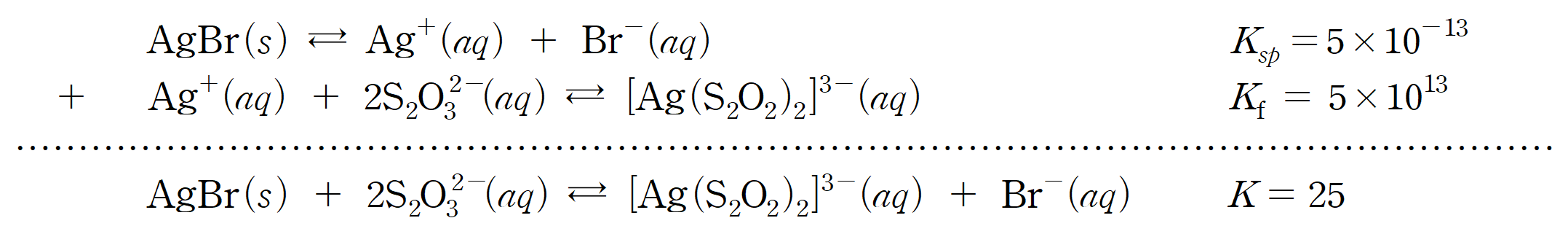
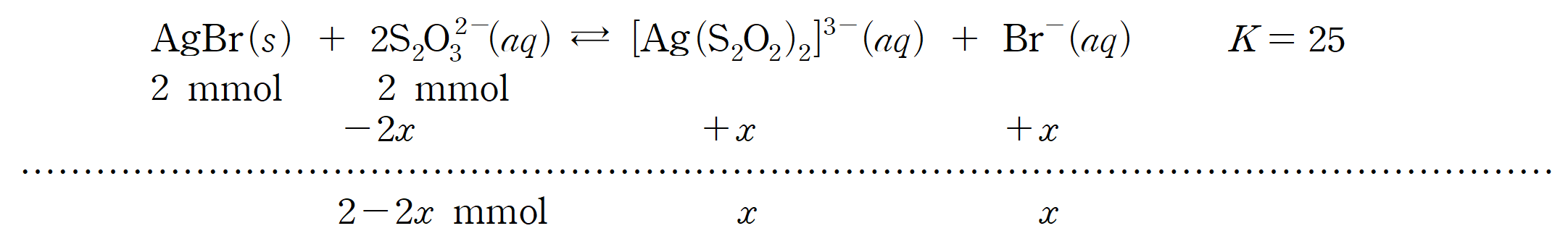
평형 상수를 바탕으로 x 를 구하면, (반응 전후 계수 합이 같아 몰수로 구함)
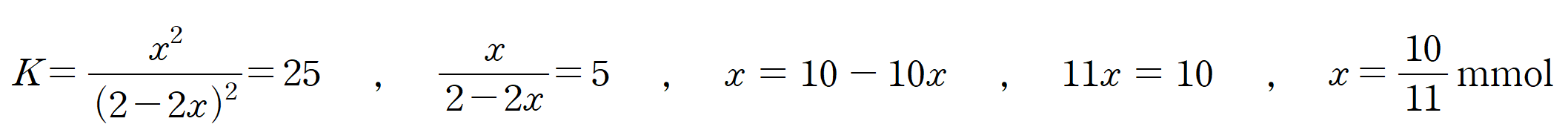
x를 바탕으로 Br-의 농도를 구하면,
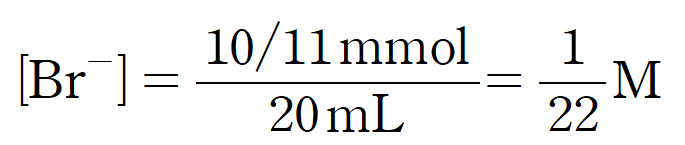
답: ⑤ 3aT ln3
풀이:
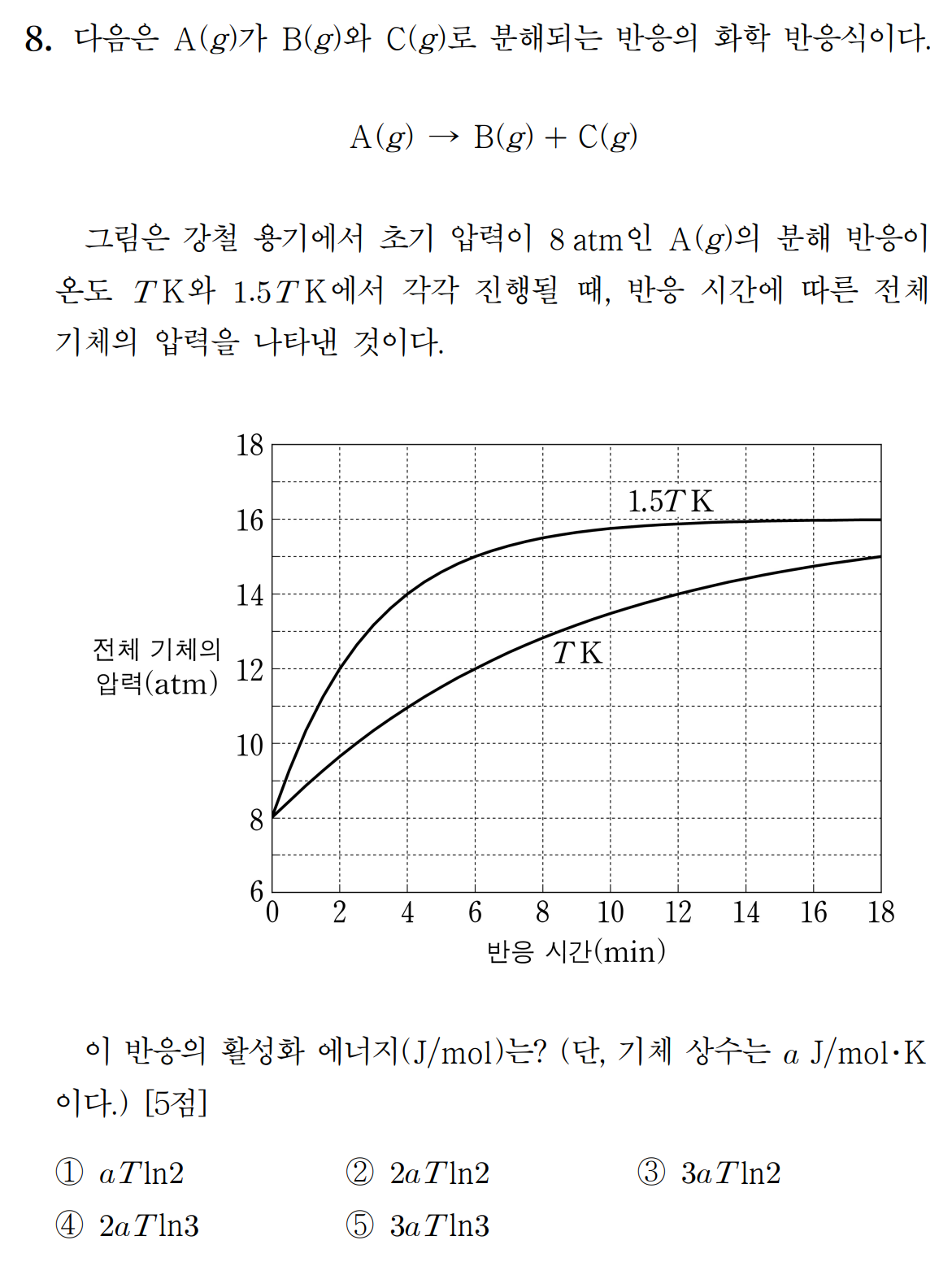
초기 조건은 A만 있는 조건이며, A의 몰수에 해당하는 압력은 8 atm이다.
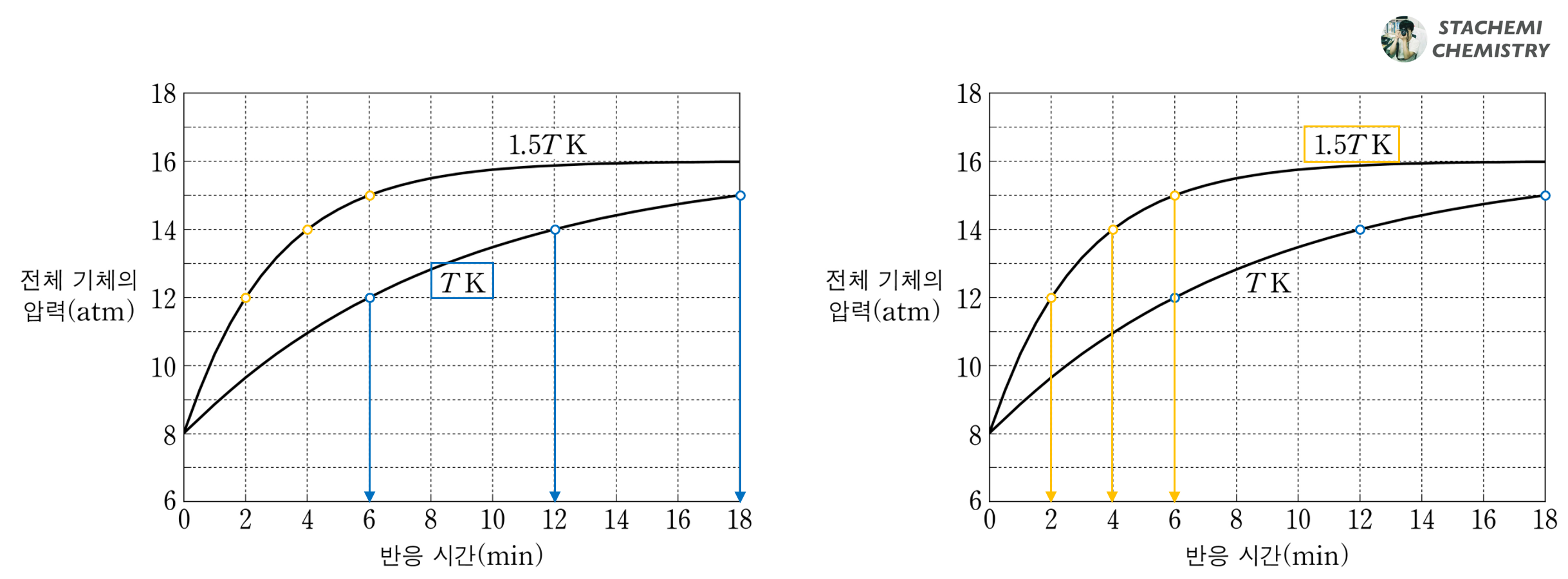
초기 양의 절반인 4 atm에 해당하는 A가 분해(1차 반감기)되면, B와 C가 각각 4 atm에 해당하는 양만큼 생성되며, 전체 압력은 4+4+4=12 atm이 된다.
또 다시 절반에 해당하는 2 atm에 해당하는 A가 분해(2차 반감기)되면, 남아있는 A는 2 atm, 생성된 B와 C는 각각 4+2=6 atm이 되어 총 2+6+6=14 atm이 된다.
또 다시 절반에 해당하는 1 atm의 A가 더 분해(3차 반감기)되면, 남아있는 A는 1 atm, 생성된 전체 B와 C는 각각 4+2+1=7 atm이 되어 전체 압력은 1+7+7=15 atm이 된다.
전체 압력이 8 atm, 12 atm, 14 atm, 15 atm이 될 때까지 걸린 반응시간을 온도 T 와 1.5T 에서 확인해보면, 온도가 T 일 때는 반감기가 6 분, 1.5T 일때는 반감기가 2분이며, 모두 일정하다. 이 반응은 1차 반응이다.
1차 반응의 반감기 t1/2 = ln2/k 으로 나타낼 수 있으므로,
온도 T 에서는 kT = ln2/6 이고, 온도 1.5T 에서는 k1.5T = ln2/2 이다. 1.5T 일 때의 속도 상수(k1.5T )가 T 일 때의 속도 상수(kT )보다 3배 크다.
이제 아레니우스 식을 이용하면,
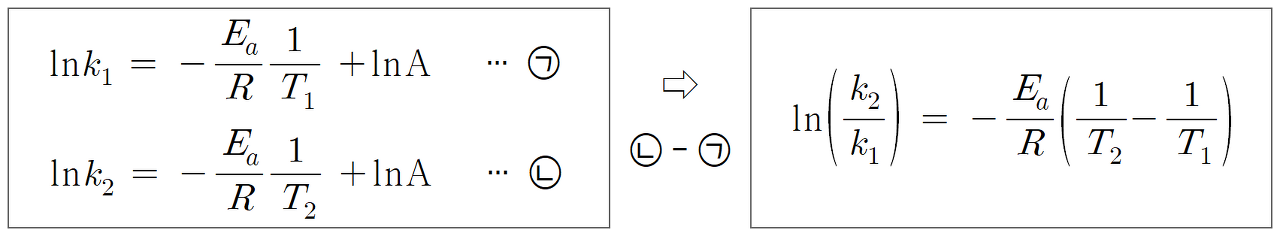
활성화 에너지(Ea)를 나타낼 수 있다. Ea = 3aT ln3 (⑤)이다.
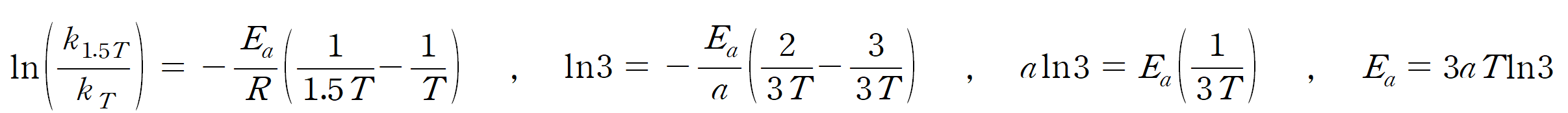

답: ③
풀이:
① 농도를 정확하게 아는 표준 용액을 제조하기 위해 필요한 유리기구는 부피 플라스크이다.
② (나)에서 NaHCO_3 (s)의 몰질량은 84 [g/mol], 질량은 2.1 [g]이므로, 용해된 용질의 몰수는 1/40 [mol]이다. 천체 부피가 1/4 L 이므로, 몰농도는 0.1 M 이다.
③ 적정 과정에서 일어나는 반응의 알짜 이온 반응식은
HCO_3^- (aq) + H^+ (aq) → H_2CO_3 (aq) 이다. (거짓)
④ 제시된 산-염기 중화 반응은 강산과 약염기의 반응으로 중화점이 pH < 7에서 나타난다. 지시약의 변색범위가 중화점을 포함해야하므로, 3.1 ~ 4.4의 변색범위를 갖는 메틸오렌지가 가장 적절하다.
⑤ 0.1 M NaHCO_3 (aq) 25 mL를 취하여 중화 반응했으므로, 포함된 NaHCO_3 몰수는 2.5 mmol이다. 중화 반응에 총 20 mL의 HCl (aq)이 사용되었으므로,
2.5 mmol = x * 20 mL , x = 1/8 M 이다.
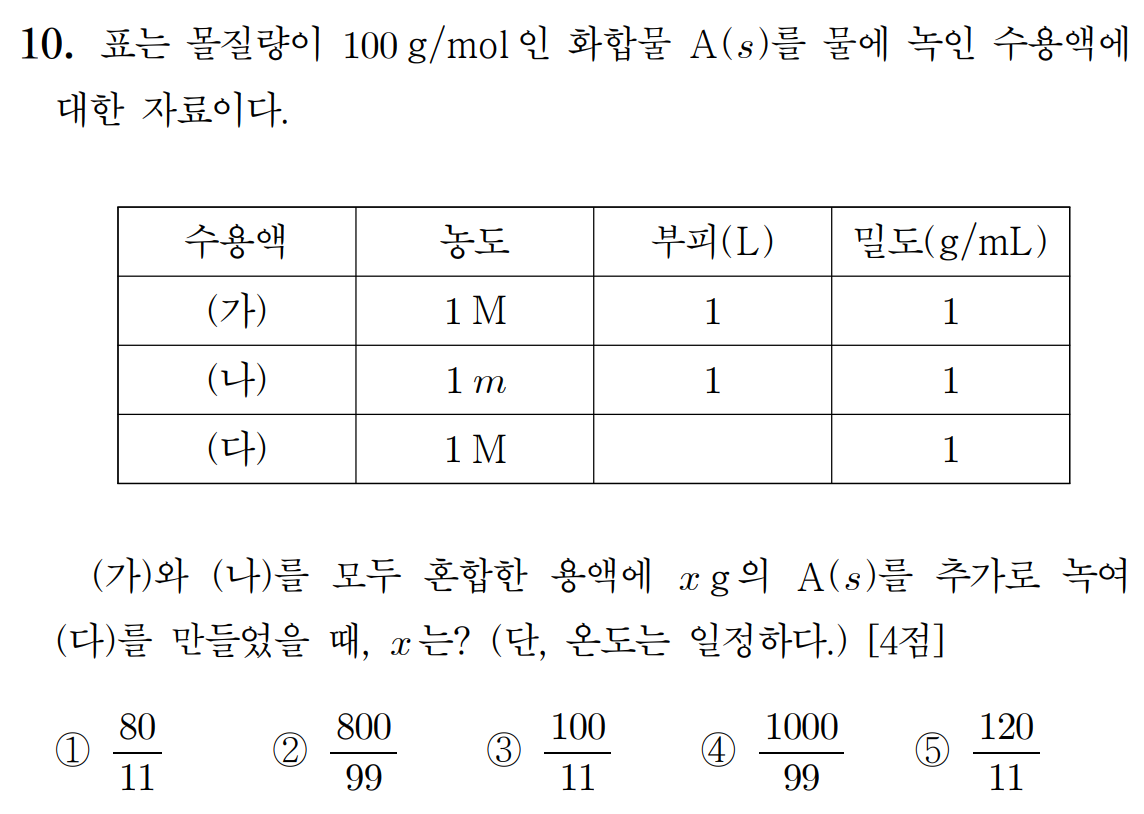
답: ④ 1000/99
풀이:
용액 (다)의 밀도(d)가 1 g/mL 이고, 용질 분자량(Mw)은 100 g/mol, 몰농도(M)가 1 이므로, 퍼센트 농도(a)는 다음과 같다.
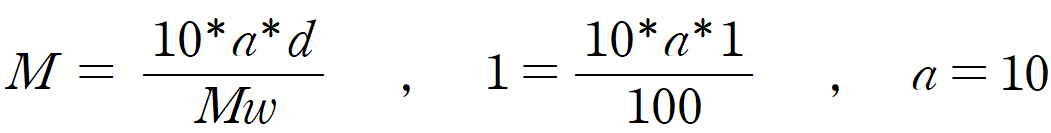
용액 (다)의 퍼센트 농도는 10%이다. 즉, 전체 용질 질량/용액 질량 = 0.1 이다. 이를 식으로 나타내면,
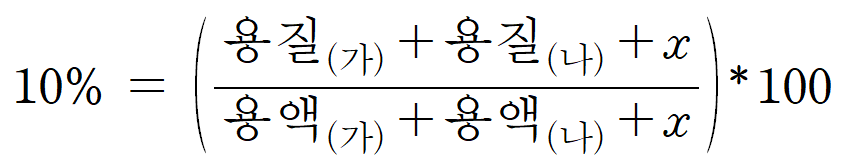
용액 (가)의 경우 용액 부피가 1 L, 밀도가 1 g/mL이므로, 전체 용액 질량은 1000 g, 포함된 용질 몰수가 1 mol이다. (가) 용액의 용질 질량은 100 [g]이다.
용액 (나)의 경우 용액 전체 부피가 1 L, 밀도가 (가)와 마찬가지로 1 g/mL이므로, 전체 용액 질량은 1000 g 포함된 용질의 질량을 y [g] 이라 하면, 몰랄 농도는 다음과 같이 나타낼 수 있다.


용액 (나)에 포함된 A의 질량이 1000/11 [g] 이므로, 이를 용액 (다)의 퍼센트 농도 식에 대입하면,
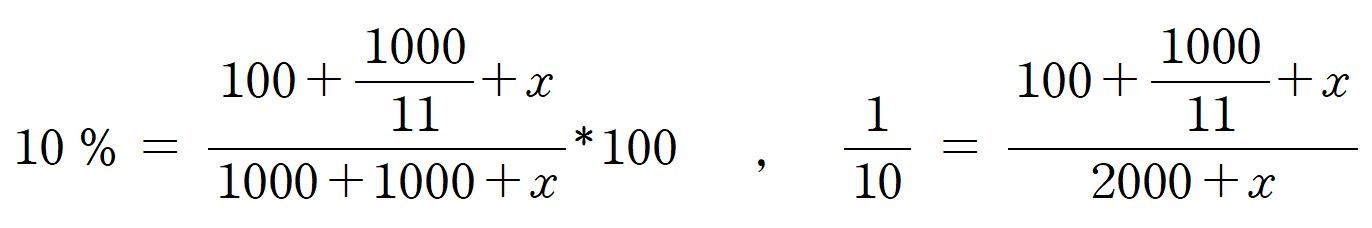
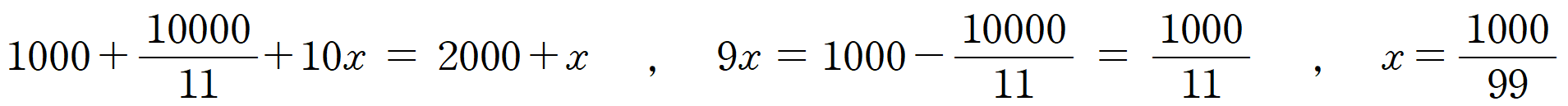
첨가한 용질 x의 질량은 1000/99 [g] 임을 알 수 있다.
* 본문 설명 중 잘못된 부분에 대해 지적해주시면, 참고하여 수정, 업데이트하도록 하겠습니다. 위 문제의 출처는 http://www.kpeet.or.kr 한국약학교육협의회 사이트입니다.